الزِّنْك[1] أو الخارَصِين[1][2] أو التُوتِياء[3] الرمز الكيميائي Zn من عناصر السلسلة الأولى في الفلزات الانتقالية وذلك لوجود مدارات فارغة بالمدار d وبالتالي يستطيع تكوين معقدات، وهو من العناصر الهامة لاستخداماته المتعددة. ينطق الزِّنْك / ziŋk / zingk من الكلمة الألمانية ziŋk و المعروف أيضًا بدخان الزنك وهو عنصر كيميائي معدني،يرمزله بالرمزZn رقمه الذري 30، وهو العنصر الأول في المجموعة 12 من الجدول الدوري. يشبه الزنك في بعض خصائصه المغنزيوم،لان حالة أكسدته تشبه من حيث الحجم الزنك +2.[4]
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فضي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | زنك، 30، Zn | |||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 12، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 65.38(2) غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 7.14 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.57 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 692.68 ك، 419.53 °س، 787.15 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 1180 ك، 907 °س، 1665 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 7.32 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 123.6 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.470 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | +2, +1, 0 (أكاسيده مذبذبة) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.65 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 906.4 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1733.3 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3833 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 134 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±122 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 139 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة | |||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 59.0 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 116 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 30.2 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) (ملفوف) 3850 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 108 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 43 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 70 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 412 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-66-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الزنك | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
يعتبر الزنك العنصر الرابع و العشرون الأكثر وفرة على مستوى القشرة الأرضية كما لديه 5 نظائر مستقرة، وخامات الزنك الرئيسية هي سفاليريت، كبريتيد الزنك ZnS.
وتتواجد المناطق الأكثر إنتاجا له في أستراليا،آسيا،والولايات المتحدة الأمريكية. ويشمل إنتاج الزنك،زبد تعويم الخام التحميص، الاستخراج النهائي باستعمال الكهرباء.. مقاومة التآكل، طلاء الفولاذ بالزنك هي كبرى تطبيقات الزنك، وهناك أخرى في البطاريات والسبائك مثل النحاس الأصفر يشبع استخدام مجموعة متنوعة من مركبات الزنك مثل كاربونات الزنك، غلوكونات الزنك (المكملات الغذائية)، كلوريد الزنك (في مزيلات الروائح)، بيربيتيوني الزنك (في الشامبو المضاد للقشرة)، كبريتيد الزنك (الاضاءة الملونة) وميثيل أو ايثيل الزنك فيستعمل في المغابر العضوية.
الزنك هو أهم معدن في الحالات البيولوجية الاستثنائية واهمية الصحة العمومية،نقص الزنك يؤثر على نحو مليار شخص في العالم النامي ويرتبط بالعديد من الأمراض وعند الأطفال يسبب نقصه تاخر النمو،وتاخر النضج الجنسي، العدوى، الحساسية، الإسهال وهذا ما أدى إلى وفاة ازيد من 800000 طفل في العالم سنويا. الانزيمات لها رد فعل مركزي واسع في الكيمياء الحيوية مثل هيدروجين الكحول عند الإنسان حيث يسبب استهلاك الزنك الزائد الترنح الخمول والنعاس.
التاريخ وأصل التسمية
كلمة الخارصين أو الخارصيني هي التسمية العربية للزنك[5][6]. ويختلف العلماء اللغويون حول أصل كلمة زنك فبينما يرى بعضهم أنها كلمة لاتينية تعنى الراسب الأبيض و يرى آخرون أنها مشتقة من الكلمة الألمانية Zinke وهي تعني أسنان المشط حيث أن شكل الفلز الخام في فرن الصهر يكون شبيها بذلك.
الاستعمال القديم
هناك أمثلة مختلفة عن استعمال الزنك غير النقي، العثور على تمثال ما قبل التاريخ يحتوي على 87,5% من الزنك في الموقع الأثري داقية (موجودة مع رومانيا الحالية)[7].حلي مصنوعة من السبائك تحتوي على ما يقارب %80-90% من الرصاص الحديد القصدير ومعادن أخرى التي يدخل الزنك في تركيبها تم اكتشاف أن عمرها أزيد من 2500 سنة، ولوحة زنكية (مصنوعة من الزنك) تسمى بارم رزمانية الاصل مصنوعة من سبائك الزنك ومؤرخ سترابو ومن فقرة إحدى كتابته الأولى من القرن الرابع قبل الميلاد يشير انه قطرات من الفضة المزيفة التي حين تختلط مع النحاس تسمى سبائك من الزنك النحاسي ’شاراسامهيتا في كتابات في العام 500 قبل الميلاد أو قبل ذلك اشار هذا المعدن حين يتاكسد.
وقد استخدم النحاس الأصفر وهو سبيكة من النحاس والزنك من على الأقل القرن 10 قبل الميلاد،و لم يتم إنتاج معدن الزنك على نطاق واسع حتى القرن 13 في الهند،في حين أن المعدن لم يكن معروفا في أروبا إلى غاية نهاية القرن 16 احرق الكيميائيون الزنك في الهواء للتشكيل ما سموه «صوف الفيلسوف» و«بياض الثلج» العنصر ربما سمي من قبل الكيميائيون براسيلوس بعد الكلمة الألمانية -zink-، منح العالم الألماني اندرياس سيغسمون مارغان فرض من أجل اكتشاف الزنك المعدنية الصرفة في 1746. العمل الذي قام لويجي جالفاني واليساندرو وفولتا كشف خصائص كهرو كيميائية للزنـك بحلول عام 1800
الاكتشاف
مقارنة بمعادن كالحديد والنحاس والرصاص التي اكتشفت قبل قبل الميلاد بالالاف الأعوام. فان اكتشاف الزنك قد جاء متاخرا في القرن الرابع عشر ميلاديا في الهند والصين وقد عثر في الصين على عملات معدنية تحتوى في تكونيها على 99% من الزنك و1% من النحاس وذلك في الفترة من 1368 إلى 1644 م وقد عثرت في الهند على أدوات تشير أن عمليات صهر الزنك تمت في القرن الرابع عشر الميلادى. يعد تاخر اكتشاف الزنك إلى انخفاض درجة غليانه حيث يوجد في الطبيعة غالبًا مع الرصاص والذي كان يصهر في افران درجة حرارتها حوالي 1000 مئوية فكان سرعان ما يتبخر الزنك ولا يبقى الا الرصاص. في عام 1617 عمل لوهنيس على دراسة عينات من الزنك احضرت من الهند والصين واطلق عليه اسم الزنك. في عام 1721 تمكن هنكل من تحضير الزنك من خام السميثسونيت (ZnCO3) إلا أنه احتفظ بالطريقة سرا وفي عام 1746 تمكن الالمانى مارجراف في برلين من إنتاج الزنك بتقطير خام السميثسونيت في وعاء مغلق ووصف الطريقة التي اتبعها والخطوات بدقة وبذلك يكون أول من توصل من تحضير الزنك معمليا.
الوفرة الطبيعية
يوجد الزنك في قشرة الأرض بنسبة 65 غرام لكل طن وهو العنصر رقم 24 من حيث الانتشار في القشرة الأرضية ويوجد في عدة خامات منها
مخلوط الزنك أو السفاليريت و كبريتيد الزنك ZnS.
سميثسونايت ZnCO3
زينسيت (Zn,Mn)O
فيليميت Zn2SiO4
فرانكلينيت ZnFe2O4

يمثل الزنك حوالي ppm) 75%0,075) من القشرة الأرضية مما يجعله العنصر 24 الأكثر وفرة فيها، التربة تحتوي 770,5ppm من الزنك بمتوسط 64ppm، أما مياه البحر فتحتوي على ppm30 من الزنك.
سالفريت((zns عثر على هذا المعدن بالاعتماد على معادن أساسية أخرى مثل النحاس الرصاص في الخامات، ال له علاقة بالاكاسيد الضعيفة على عكس علاقته،الكالكوفيل يشكل صلابة القشرة أثناء قلة الشروط الخاصة بالغلاف الجوى الأرضي السفاليرايت الذي يكون كبريتيد الزنك هي من أثقل المعادن المنجمية التي تحتوي على الزنك الخام لان تركيزها يحتوي على60_62 من الزنك معادن أخرى والتي يستخرج منها الزنك والتي تشمل كربونات الزنك، سيليكات الزنك، آخر كبريتيد الزنك،و في بعض الأحيان كربونات الزنك القاعدية باستثناء آخر كبريتيد الزنك،فإن كل هذه المعادن الأخرى شكلت نتيجة عمليات الناتجة من الحالات الجوية (الطبيعة)على كبريتيد الزنك البدائية. موارد الزنك المعروفة في العالم يصل عددها إلى 1,9 مليار طن،ما يقارب 200 مليون طن تدخل في النطاق الاقتصادي في عام 2008،إضافة إلى الاقتصاد الهامشي الاحتياطي لهذا الرقم، ومجموع الاحتياط التي تم إحصائها (التعرف عليها) يتركز على 500 مليون طن،وأكبر المراكز الخاصة به توجد في أستراليا،كندا، والولايات المتحدة مع أكبر الاحتياطات في إيران. وفي المعدل الحالي للاستهلاك،يفترض أن هذه الاحتياطات تستنفذ ما بين 2027 و2055 حوالي 346 مليون طن تم استخراجها عبر الزمن اٍلى عام 2002،ووجدت اْحد التقديرات اْن حوالي 109مليون طن لا يزال قيد الاستعمال.
كيفية التكوين
يتكوّن الزنك في داخل المستعرات العظمى.[8] الزنك كبيرة وثقيلة جدا تتشكل في نجوم باستخدام طريقة السليكوم المحروق، يتم تكون نموذج الزنك المستقرة من خلال عملية السيبرنوفا وعملية الراديوية.
الإنتاج والاستخلاص
- طالع أيضًا: قائمة الدول حسب إنتاج الزنك
لا يوجد العنصر في الطبيعة منفردا بل يكون مختلطا بعناصر أخرى كالذهب والفضة والكادميوم والرصاص. تتم عملية استخلاص الزنك على عدة مراحل أولها تكسير الخام وطحنه ثم ازالة الشوائب بالتعويم يليه عملية تحميص الخام إلى كبريتيد الزنك ZnS يليه اجراء عملية اكسدة للكبريتيد طبقا للمعادلة ويجب اتمام عملية الاكسدة حتى تلامس ذرات العنصر ذرات الزنك.
بعده يمكن اجراء عملية اختزال بنزع الأكسجين من الزنك بواسطة الكربون أو أول أكسيد الكربون طبقا للمعادلات:
التعدين والتجهيز
الزنك هو المعدن الرابع الأكثر شيوعا من حيث الاستعمال، بالإضافة إلى الحديد والألمنيوم والنحاس بإنتاج سنوي يقدر ب10مليون طن وأكبر الشركات المنتجة للزنك هي (nayza) التابعة لمجموعة أسترالية oz للمعادن والشركات البلجكية umicore حوالي 70% من الزنك العالمي ينتج من المناجم، في حين 30% الباقية تنتج من إعادة تركيز الزنك الثانوية. معدن الزنك ينتج باستعمال المعادن الاستخراجية، بعد طحن الخام، الذي يفصل بشكل انتقائي المعادن من الشوائب المعدنية، وهذا ما يعطى خام مركز. التحميص يحول كبريت الزنك المركز لينتج أكسيد الزنك 2 ZnS + 3 O2 → 2 ZnO + 2 SO2 لمزيد من طرق التجهيز الأساسية المستعملة هي pyrometallurgy يقلل من كبريت الزنك بالكاربون أو أول أكسيد الكربون في درجة حرارة 950° والمعادلات ادناه تشرح بوضوح هذه العملية 2 ZnO + C → 2 Zn + CO2 2 ZnO + 2 CO → 2 Zn + 2 CO2
وباستعمال الكهرباء يتم ترشيح الزنك من الزنك الخام المركزبمعالجته بحمض الكبرتيد
ZnO + H2SO4 → ZnSO4 + H2O
وبعد استخدام هذا التحليل الكهربائي يتم إنتاج معدن الزنك
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
الأثر البيئي
لإنتاج كبريتيد الزنك الخامات تعتمد بشكل كبير لإنتاج ثاني أكسيد الكبريت وانصهاره له مخلفات كثيرة مثل بخار الكاديوم عمليات تعدين الزنك خلفت اثار كبيرة على الأنهار ومختلف المناطق الخضراء المجاورة للمناجم وانتقال الزنك من المناجم حوالي 10 آلاف طن في السنة خلال 2005 الدراسات أثبتت أن هذه الانبعاثات المعدنية تنعكس على البشرية والطبيعة معا ولكن يمكن أن يؤثر سلبا على كمية الأكسجين عند الأسماك مثلا في نهر الراين.
النظائر
للزنك 30 نظيرا معروفا بعدد كتلي يتراوح ما بين 54 و 83، خمسة منها مستقرة وهي: 64Zn, 66Zn, 67Zn, 68Zn et 70Zn, يعتبر 64Zn النظير الأكثر وفرة في الطبيعة (% 48.63).
للزنك خمس و عشرون نظيرا مشعا، يعتبر 65Zn الأكثر إستقرارا و وفرة مع عمر النصف 244.26 يوما، يليه 72Zn مع عمر النصف 46.5 ساعة. بقية النظائر المشعة الأخرى لها عمر النصف أقل من 14 ساعة ومنها من له عمر النصف أقل من ثانية.
| النظير | الوفرة الطبيعية |
|---|---|
| 64Zn | % 48,268 |
| 66Zn | % 27,975 |
| 67Zn | % 4,102 |
| 68Zn | % 19,024 |
| 70Zn | % 0,631 |
الزنك لديه 10 اٍيزوميرات نووية، Zn له مدة حياة 13,76ساعة يشير جهاز متبدل الاستقرار أن نواة النظير الغير مستقر في حالة تهيج (نشاط) ويرجع اٍلى حالة السكون (الخمول)بفقد فتون على شكل γ
65Zn, 71Zn, 78Zn النظائر لديها فقط حالة عدم نشاط اما
لديها 3 حالات و73Zn، ونظام الاضمحالا الأكثر شيوعا الخاص بنظائر الزنك المشعة ذات عدد كتلي اقل من 66 هو التفاط إلكترون، وهذا العنصر المضمحل الناتج من التقاط الإلكترون هونظير النحاس n 30Zn + e− → n 29Cu ونظام الاضمحلال الأكثر شيوعا الخاص بنظائر الزنك المشعة ذات عدد كتلي أكبرمن 66 هو(β–)، الذي ينتج عنه نظير الغاليوم
n 30Zn → n 31Ga + e− + ν e
الخواص الفيزيائية
الزنك فلز لامع أبيض مائل للزرقة من عناصر الفلزات الإنتقالية، صلب و بنيته البلورية على شكل نظام بلوري سداسي. يصبح ليِّنا في درجات حرارة تترواح من °100 إلى °150 مئوية ويصبح قابلا للطرق والسحب و أكثر هشاشة.
أقل كثافة من الحديد و القصدير حيث تبلغ كثافته 7,1.
ينصهر الزنك الخالص ابتداء من درجة الحرارة °419,53 مئوية (نقطة الإنصهار) و يغلي ابتداء من درجة الحرارة °907 مئوية (نقطة الغليان)، أثناء احتراقه يعطي لهبا أخضر مزرق يمكن الكشف عنه عن طريق اختبار اللهب.
تمكن هذه الخصائص من استعماله في الألعاب النارية من أجل إعطاء أثر الدخان.
الزنك معدن موصل للكهرباء موصليته الكهربية ، ضعيف النفاذية المغناطيسية.
مقاوم للصدأ، حيث يقوم الهواء الرطب بإكساب سطح الزنك طبقة رقيقة من أكسيد الزنك تمنع أكسدة الطبقات التالية.
تفاعل الزنك مع حمض الكلوريدريك ينتج عنه غاز ثنائي الهيدروجين وفق المعادلة التالية:
Zn+2NaOH---->Na2ZnO2+H2
يتفاعل مع المحاليل القلوية لينتج غاز الهيدروجين.
يقوم الهواء الرطب باكساب سطح الزنك طبقة رقيقة من أكسيد الزنك تمنع اكسدة الطبقات التالية. ويعد الزنك عامل مختزل قوى.
الخواص الكيميائية
التفاعلية
الزنك لديه الاكترون التنظيم (التمييز)في المدارالثالث 3d104s2 ورقم مجموعته 12 من الجدول الدوري وهو معدن رد فعله متوسط وعامل التقليل كبير سطح المعدن النقي يشوه بسرعة وفي نهاية المطاف تشكيل طبقة وافية من كاربونات الزنك القاعدية Zn5(OH)6(CO3)2، ومن خلال التفاعل مع ثاني أكسيد الكربون في الغلاف الجوي، هذه الطبقة تساعد على منح من التفاعل مع الهواء والماء الزنك يحترق في الهواء بلهب لامع أخضر مزرق وينتج عنه ابخرة أكسيد الزنك. يتفاعل الزنك بسهولة مع الأحماض والالكيلات وغيرها من اللا فلزات ’وعلى وجه الخصوص فان الزنك النقي يتفاعل ببطئ فقط في الغرف الحرارية مع الأحماض، الأحماض القوية مثل حمض هيدروكلوريك أو حمض الكبريت وينتج عنه انطلاق غاز الهيدروجين والماء، يتميز الزنك كيمياءيا بناتج التأكسد +2 وعندها تشكل الغلاف الإلكتروني الخارجي الذي يتم فقده في هذه المرحلة للإلكترونين جزيئات الزنك بالتفلعل مع الكلوريد وتحت درجة حرارة تفوق 285° يتنج عنه Zn2Cl2، تاكسد الزنك+1 الزنك في الكيمياء يشبه النيكل والنحاس (معادن ذات حالة انتقالية في المدار الأول) وهي في هذه الحالة مركبات ضعيفة التمغنط وعديمة اللون في الغالب
المركبات
اسيتات الزنك
كلوريد الزنك
اسيتات الزنك
على الأغلب مركبات ثنائية للزنك تعرف بنسبة للفلزات وكل غير الفلزات باستثناء الغازات النبيلة أكسيد الزنكzno عبارة عن مسحوق أبيض ينحل تقريبا في الماء المقطر المحاليل القاعدية الضعيفة تحتؤي على ايونات Zn2+، هيدروكسيد الزنكZn(OH)2 يتكون على شكل راسب أبيض المحاليل القوية الالكنية ’هذا الهيدروكسيد ينحل ليكون الزنكات [Zn(OH)4]2−).[26]، الملبيداتZnMoO4، سيانيد Zn(CN)2 ’نترات الزنكZn(NO3)2 كلورات Zn(ClO3)2 السلفاتZnSO4الفوسفات Zn3(PO4)2 الارسينات Zn(AsO4)2 كروماتZnCrO4(من بين المركبات الزنكية الملونة) و هي بعض من بين العناصر عير العضوية للزنك هو الاسيتات (Zn(O2CCH3)2)، مركبات الزنك العضوية هي التي تحتوي على كربون الزنك
الأهمية الحيوية
يحتاج الجسم الزنك بكميات ضئيلة لا تتعدى 15 ملغ يوميا ويجب الا تتعدى الكمية من 40 ملغ. ويشكل 160 جزءا من الانزيمات التي يحتاجها الجسم لعمليات القلب والتنفس والهضم وغيرها.
له أهمية للجسم تتمثل في دوره في تقوية جهاز المناعة ودعمه. ولقد اكتشف الأطباء انه بإضافة سلفات الزنك للبلازما عند كبار السن يتم تقوية مناعتهم.
الغذاء
يتواجد الزنك في مختلف اللحوم الحمراء (من 50 مع إلى 120مغ للغرام الواحد)، في مختلف لحوم الأسماك و الدواجن.
و يتواجد أيضًا في الغذاء النباتي[9]، و بنسب متفاوتة، فالعديد من النباتات تحتوي على الزنك، إلا أن مقداره فيها يتغير وفق الكميات التي يتواجد بها في التربة.
فعلى سبيل المثال، يتواجد الزنك في الأفوكادو، في اللفت و الكرفس، الخردل، في البرسيم الحجازي (الفصة)، في بذور اليقطين و حب الشمس[10]، في السمسم، في الشوفان[11] و اللوز و الحمص و غيرها من البقوليات.
هناك أنواع من النباتات تحتوي على حمض الفيتيك كالشعير و القمح (بالضبط الغشاء المحيط بحبة القمح)، هذا الحمض يقوم بامتصاص بعض المواد المعدنية أهمها الزنك و الحديد، المنغنيز و الكالسيوم، وعند أكل هذه النباتات فإن حمض الفيتيك يقوم بامتصاص الزنك الفائض و يزيله من الجسم.
الزنك والصحة
الزنك هو عنصر أساسي لحياة البشر والحيوان والنبات. فهو حيوي بالنسبة للكثير من الوظائف البيولوجية ويؤدي دورا حاسما في أكثر من 300 من الإنزيمات في الجسم البشري. أجسام البالغين تحتوي ما بين 2 و3 جرام من الزنك. وهو يوجد في جميع أجزاء الجسم: الأعضاء الحيوية، الأنسجة، والعظام، الخلايا والسوائل. تحتوي العضلات والعظام على معظم مخزون الجسم من الزنك (90٪).إلا أن أعلى تركيز للزنك ضمن الحجم يقع ضمن غدة البروستاتا والسائل المنوي، ليأتي بعد ذلك العينين.
بفضل خصائصه العلاجية، يستخدم أوكسيد الزنك كعلاج لبعض الأمراض الجلدية لأنه مضاد للإلتهاب، لذا فهو يدخل في تركيب المراهم المضادة للإلتهاب و الحروق، و يعالج أمراضا شائعة كطفح الحفاضات و حب الشباب[12].
المكملات الغذائية
يدخل الزنك على شكل أقراص في تكوين العديد من الفيتامينات و المكملات الغذائية التي نتناولها في حياتنا اليومية، وتحتوي أيضًا على أكسيد الزنك وخلات الزنك حيث تجعلنا نملك خصائص مضادة للاكسدة، والتي تقي من تسارع شيخوخة الجلد والعضلات.
الدور البيولوجي
الزنك هو عنصر تتبع رئيسي وهو ضروري للنباتات والحيوانات والكائنات الحية الدقيقة وقد وجد الزنكفي ما يقارب 100 انزيمات معينة كما يعد المعدن الوحيد الذي يتواجد في الانزيمات، وهناك ما بين 2-4غ من الزنك موزعة على جميع أنحاء جسم الإنسان، وهو معظمه في المخ، العضلات، الكلى مع تركيز أعلى في أجزاء العين ونمو الجهاز التناسلي يلعب الزنك ادوارا بيولوجية مختلفة وموزعة على كامل الجسم يدخل ليضا في ميتابوليزم Rna,dna، في نقل الإشارة والتعبير الجيني
الانزيمات
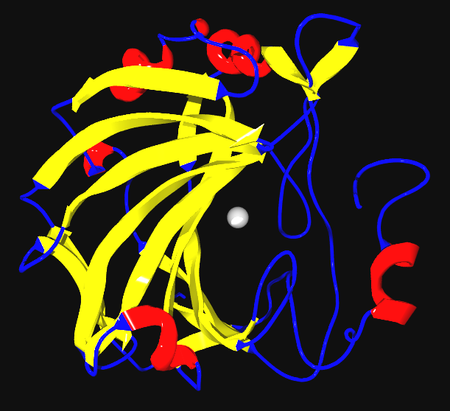
الشريط التنظيمي لكاربونات الانهيداز2عند الإنسان مع ذرة الزنك واضحة في المركز اصابع الزنك تساعد في قراءة سلسلة DNA هذا المعدن له أيضًا هندسة تنسيقية مرنة تسمح بتشكيل البروتينات بسرعة والتحول إلى أجزاء التفاغلات البيولوجية
بروتينات اخرى
يساعد الزنك من خلال بنية التي تسمى اصابع الزنك حيث يركب بعض عمليات النسخ التي هي عبارة عن بروتينات تعرف ب(DNA) تسلسلها ونسخها. ربما يمكن للزنك أن يحمل في الميثالونين عند الكائنات الدقيقة أو في الخلايا المعوية أو الكبد للحيوانات ’ الميثالوثين في الخلايا المعوية قادر على ضبط امتصاص الزنك من 15-40%’لذلك يمكن الإفراط في الزنك أن يكون ضار.
مرجع اختبارات الدم يبين الزنك في اللون الارجواني في يمين الوسط
النقص
- مقالة مفصلة: نقص الزنك
نقص الزنك عند الإنسان يرجع عادة إلى عدم التغذية الكافية أو لسوء هضمه و امتصاصه مما يسبب أمراضا كالتهاب الجلد، أمراض الأمعاء، فقر الدم و ضعف الشهية، وكذلك بعض الأمراض الخارجية مثل الاكتئاب العجز والخمول. الفئات المُعرَّضة أكثر للأمراض الناتجة عن نقص الزنك هم المسنون والأطفال.
نقص الزنك له عواقب وخيمة على نمو الأطفال، بحيث يؤدي إلى نقص في الطول و الإصابة بالتأخر النمو البنيوي، فقد أظهرت دراسات للتدخلات التي أجريت في عدة بلدان وجود علاقة إيجابية بين توفير جرع الزنك المكملة والنمو الخطي لدى الأطفال[13]. ويسبب نقصه أيضًا مرض الإسهال و التهابات الجهاز التنفسي[14][15].
و تشير التقديرات إلى ما يقارب 2 مليار في العالم المتقدم يعانون من نقص الزنك.
سمية الزنك
على الرغم من أن الزنك هو شرط اساسي لصحة جيدة، يمكن أن يكون ضارا وهذا ما يمنع امتصاص الحديد والنحاس. أيون الزنك الحر في المحاليل أكثر خطورة فهو يسبب تسمم النباتات واللافقاريات وحتى الأسماك الفقارية وايون حر هو نموذج نشيط قادر على قتل بعض الأعضاء. المعدة تحتوي على حمض الهيدروكلوريك ’حيث يمكن لمعدن الزنك أن يتحلل ليعطي كلوريد الزنك مما يسبب اضرار على بطانية المعدة بسبب ارتفاع درجة الحموضة ، أما مستويات الزنك التي تزيد على 500 جزء من المليون في التربة تسبب تداخل في قدرة النباتات على امتصاص المعادن الأساسية الأخرى مثل الحديد والمغنيسيوم.
في عام 1982الولايات المتحدة زرعت مجموعة نباتات بالاعتماد على الزنك لكن كان تركيزه كبير مما سبب تسممها، ومن بين الحالات المزمنة التي كان ناتجها الموت هي 425حالة امتصتها البكتريا والفطريات، وكثير من الحالات التي تم دراستها أثبتت معاناة الإنسان من التسمم بواسطة الزنك من جراء ابتلاع قطع معدنية تحتوي عليه الذي يكون قاتلا في بعض الأحيان أو يسبب فقر الدم الشديد أو أمراض الكبد أو القصور الكلوي القيء، الإسهال وهذه الأعراض هي نتيجة التسمم بواسطة الزنك
التوصيات اليومية
التوصيات اليومية في الولايات المتحدة هي 8 مغ يومياً للنساء و11 مغ يومياً للرجال. إن متوسط الاستهلاك في الولايات المتحدة حوالي العام 2000 كان 9 مغ يومياً للنساء و14مغ يومياً للرجال.[16][17]
استخدامات الزنك
- عمل جلفنة الحديد
- صناعة البطاريات المختلفة بالإضافة لصناعة العلبة الخارجية للبطاريات الجافة.
- صناعة سبائك تستخدم في عمليات اللحام والطلاء
يستعمل الزنك في غلفنة الحديد وصناعة البطاريات المختلفة بالاضافة إلى صناعة العلبة الخارجية للبطاريات الجافة وصناعة سبائك تستخدم في عمليات اللحام والطلاء التسمية والدراسات القديمة الزنك عرف قديما من بين العناصر في الطب عند الهنود كتب عنها عند الملك الهندي مادونالا في 1374 وقد دخل الزنك في تركيب الكثير من المواد العضوية عند الهنود في القرن 13 أما الصينيون فلم يدرسوا هذه التقنية إلى غاية القرن 17.
مختلف الرموز الكيميائية التي تمثل عنصر الزنك
احرق الكيميائيون هذا باكسيد الزنك سمي هذا المعدن ربما من قبل مقالة ل paracelsus اولا وهو كيميائي ألماني سويسري الاصل والذي اطلق عليه zencuimاوzenken في كتابة المعادن 2الحرة في القرن 16 وصل الكثير من الكيميائيين إلى عزل معدن الزنك في دول الغرب والقاموس العالمي postleway هو مصدر علمي وتكنولوجي عند الاروبيين لم يشر إلى الزنك قبل 1751 ورغم ذلك قد تم دراسته قبل ذلك في عام 1738،وليام شامبيوا من بريطانيا درس استخراج الزنك من الكلامين وتكنولوجيته كانت مشابهة إلى التقنيات المستعملة في «زاوارا» منجم الزنك في راجستان، ولكن ليس هناك دليل على أنه زار المشرق، وتقنيته استعملت خلال عام1851. الكيميائي الألماني اندرياس مغراف منح منحة من أجل اكتشاف الزنك النقي من خلال دراسات الكيميائي السويدي انطون فون سواب الذي استخلص الزنك من الكلامين 4 سنوات من قبله في تجارب عام 1746’ماغراف اخلط الكلامين والكحول في وعاء مغلق من دون النحاس للحصول على المخدن، وهذه الطريقة أصبحت كيميائيا مستعملة عام1752 الأعمال الأخيرة الغلفنة سميت نسبة للوجي غالفاني أخو ويليام المسمى جون اخترع في عام 1758طريقة التكليس كبريت الزنك إلى أكسيد قابل للاستخدام. حيث يمكن استعمال الكالمين فقط لإنتاج الزنك في 1798جوهان كريستان برهن طريقة بناء الانصهار الأولي استحدم الزنك في الغلفنة الأول مرو من قبل غالفاني، وحاول صديقه اليساندرو مواصلة أبحاثه وتم اكتسلف البطارية الفولطية 1800 يرجع عدم تمغنط الزنك إلى عدم تلونه في المحاليل ومنه اكتشف اهميته الكيميائي والغذائية.
التطبيقات
تطبيقات الزنك تشمل ما يلي: الغلفنة 59%، النحاس والبرونز 10%، المواد الكيمائية 6.0%متفرقات 2.5% مكافحة التآكل والبطاريات

غالبًا ما يستعمل الزنك لمكافحة التأكل وهو طلاء على معدن الحديد يحارب التاكل على المعدن الزنك أكثر تفاعلا من الحديد أو الصلب وبالتالي هذا ما يسمح بالاكسدة المحلية حتى يتاكسد ويفسد تماما و يستعمل الزنك في المعادن التي لها غلاقة بمياه البحر مثل السفن مما يمنع تاكل الحديد يستعمل الزنك كقطب معدني في البطاريات (بطاريات الليتيوم 3.04v والبطاريات الالكيلية.....الخ).
السبائك
أكثر السبائك المستعملة التي تحتوي على الزنك هي سبائك النحاس وهذه السبائك عموما أقوى وأكثر مقاومة للتاكل وهذه الخصائص تجعلها أكثر استعمالا في أجهزة كثيرة.
استخدامات صناعية اخرى

ما يقارب ربع الزنك يستعمل في الولايات المتحدة 2006 ويستهلك على شكل زنك مركب وفي مختلف النشاطات الصناعية أكسيد الزنك يستعمل كصباغة بيضاء في الطلاء.
أكسيد الزنك يستعمل كصباغة بيضاء في الطلاءغالبًا ما يضاف كلوريد الزنك إلى الاخشاب كمثبط للنار، كما يمكن استخدامه كمادة حافظة للخشب، كما يستعمل لتركيب مواد كيمياءية أخرى كما اقترح استعمال الزنك كمادة معدنية لصناعة الأسلحة النووية والكوبالت هو مادة أخرى معروفة للتصليح المعدني.
المراجع
- "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من الأصل في 31 ديسمبر 201918 مارس 2019.
- "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من [http://www.ldlp-dictionary.com/dictionaries/word/6130283/Encyclopedic%20Dictionary%20of%20Geography%20(Eng/Ar)/Zinc الأصل] في 10 يناير 202018 مارس 2019.
- "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من [http://www.ldlp-dictionary.com/dictionaries/word/6130823/Encyclopedic%20Dictionary%20of%20Geography%20(Eng/Ar)/Zinc الأصل] في 10 يناير 202018 مارس 2019.
- "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من الأصل في 31 ديسمبر 201918 مارس 2019.
- البيروني. الجماهر في معرفة الجواهر.
- الخوارزمي. مفاتيح العلوم. الفصل الثاني ص 279.
- 1892-, Weeks, Mary Elvira, ([2003]). The discovery of the elements. [Whitefish, Mont.]: Kessinger Pub. . OCLC 71322678. مؤرشف من الأصل في 31 ديسمبر 2019.
- BBC Four - Atom, The Key to the Cosmos نسخة محفوظة 05 يونيو 2010 على موقع واي باك مشين.
- Foods & nutrition encyclopedia (الطبعة 2nd ed). Boca Raton: CRC Press. 1994. . OCLC 28963802. مؤرشف من الأصل في 31 ديسمبر 2019.
- "Food Composition Databases Show Foods List 12036". ndb.nal.usda.gov (باللغة الإنجليزية). مؤرشف من الأصل في 12 فبراير 201924 ديسمبر 2017.
- 1904-1992., Souci, S. Walter (Siegfried Walter), (2008). Food composition and nutrition tables : on behalf of the Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz (الطبعة 7., revidierte und erg. Aufl.). Stuttgart: MedPharm Scientific Publishers. . OCLC 233572857. مؤرشف من الأصل في 31 ديسمبر 2019.
- [pmid:11586012 www.ncbi.nlm.nih.gov]
- -منظمة الصحة العالمية. [1] نسخة محفوظة 14 يوليو 2017 على موقع واي باك مشين.
- (en) Bhandari N et al. « Effectiveness of Zinc Supplementation Plus Oral Rehydration Salts Compared With Oral Rehydration Salts Alone as a Treatment for Acute Diarrhea in a Primary Care Setting: A Cluster Randomized Trial » Pediatrics 2008;121;e1279-e1285
- (en) Aggarwal R et al. « Role of Zinc Administration in Prevention of Childhood Diarrhea and Respiratory Illnesses: A Meta-Analysis » Pediatrics 2007;119;1120-1130 نسخة محفوظة 17 مايو 2017 على موقع واي باك مشين.
- Zinc - Wikipedia, the free encyclopedia










