التصلب المتعدد[2] ويعرف بأسماء عديدة، منها التصلّب اللويحي [3] والتصلب المنتثر أو التهاب الدماغ والنخاع المنتثر (Multiple sclerosis)، وهو التهاب ينتج عن تلف الغشاء العازل للعصبونات في الدماغ والحبل الشوكي. يُعطّل هذا التلف قدرةَ أجزاءٍ من الجهاز العصبي على التواصل، مما يؤدّي إلى ظهور عددٍ من الأعراض والعلامات المرضية،[4][5] منها أعراض عضوية أو إدراكية عقلية،[5] وأحياناً تكون على شكل مشاكل نفسية.[6] يتّخذُ التصلّب المتعدّد عدّة أشكال مختلفة مع أعراض جديدة تحدث إما على شكلِ نوباتٍ منفصلة (أشكال ناكسة) أو متراكمة بمرور الوقت (أشكال مترقّية).[7] وقد تختفي الأعراض بين النوبات بالكامل، لكن المشاكل العصبية الدائمة تحدث في أغلب الأحيان خصوصاً إذا كان المرض في مراحل متقدمة.[7]
| التصلب اللويحي | |
|---|---|
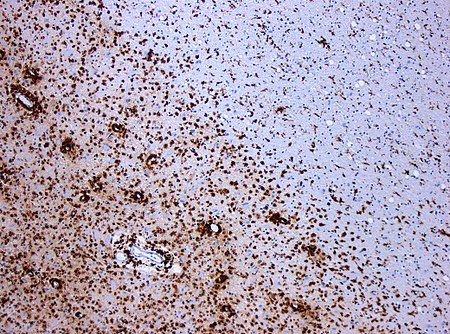
زول النخاعين بواسطة التصلب اللويحي. يُظهر النسيج المُلون بالبروتين السكري سي دي 68 (بروتين) يظهر عدة خلايا أكولة كبيرة في منطقة النسيج المتضرر. المقياس الأصلي هو 100:1.
| |
| معلومات عامة | |
| الاختصاص | طب الجهاز العصبي |
| من أنواع | داء مزيل للميالين |
| الإدارة | |
| أدوية | ميتوكسانترون، ودانترولين، وهايدروكسوكوبالمين، وآزاثيوبرين، وباكلوفين، وإنترفيرون بيتا 1-ألفا، وانترفيون - بيتا، وسيكلوفوسفاميد، وسيانوكوبالامين، وتيريفلونوميد، وفينغوليمود، وأبريميلاست، وأليمتوزوماب، وريتوكسيماب، و4-أمينو البيريدين، وغابابنتين، وداكليزوماب، ومودافينيل، وناتاليزوماب، وأرمودافينيل، وميثيلبريدنيزولون، وبريغابالين، و4-أمينو البيريدين، وبيتاميثازون، وفينغوليمود، وتيريفلونوميد، والهرمون الموجه لقشر الكظر
|
| حالات مشابهة | تَصلُب |
| الوبائيات | |
| انتشار المرض | 0.001671 (31 ديسمبر 2007)[1] |
| التاريخ | |
| المكتشف | جان مارتن شاركو |
| وصفها المصدر | الموسوعة السوفيتية الأرمينية |
في حين أن أسباب المرض غير واضحة إلا أنه يُعتقد أن آلية المرض قد تكون إما تلف في الجهاز المناعي أو فشل في الخلايا المصنعة للمايلين.[8] وتشمل الأسباب المحتملة لهذا المرض عوامل وراثية وعوامل بيئية مثل العدوى. [5][9] يعتمد تشخيص مرض التصلب المتعدد على العلامات والأعراض الموجودة ونتائج الفحوصات الطبية المساعدة.
لا يوجد علاج معروف للتصلب المتعدد. تحاول العلاجات تحسين وظائف الجسم بعد النوبة ومنع حدوث نوبات جديدة.[5] ففي حين تتصف الأدوية المستخدمة لعلاج مرض التصلب المتعدد بأنها متواضعة الفعالية، إلا أنها قد تترافق بتأثيرات سلبية وهي صعبة التحمّل. ويسعى العديد من المرضى للعلاجات البديلة على الرغم من عدم إثبات فاعليتها. يصعب التنبؤ بالنتائج طويلة الأمد، ولكن في كثير من الأحيان تكون النتائج جيدة عند النساء المصابات، وعند الذين أصيبوا بالمرض في سن مبكرة، وعند من يعانون من سير المرض الناكس، والذين عانوا من نوبات قليلة من المرض.[10] يقل متوسط العمر المتوقع بين 5 و10 سنوات مقارنة بالأفراد غير المصابين.[4]
التصلب المتعدد هو مرض مناعي ذاتي شائع يؤثّر على الجهاز العصبي المركزي.[11] ففي عام 2008، كان عدد المصابين بهذا المرض يتراوح بين 2 - 2.5 مليون فرد على مستوى العالم بمعدلات شدة تتفاوت من منطقة إلى أخرى ومن مجموعة سكانية إلى أخرى.[12] عام 2013، ارتفع عدد المتوفين من مرض التصلب المتعدد إلى 20.000 شخص مقارنة بـ 12.000 وفاة عام 1990.[13] يبدأ المرض عادة بين عمري 20 و50 سنة ونسبة إصابة النساء به ضِعف نسبة إصابة الذكور.[3][14] يشير اسم المرض "التصلب المتعدد" إلى الندبات (الصلبة – المعروفة باللويحات أو الآفات) التي تحدث بالأخص في المادة البيضاء في الدماغ والحبل الشوكي.[15] وقد كان جان مارتن شاركو أول من وصف المرض عام 1868.[15] هناك عدد من العلاجات الجديدة وأساليب التشخيص قيد التطوير.
العلامات والأعراض
يمكن أن تظهر لدى الشخص المصاب بالتصلب المتعدد أي علامة من العلامات أو الأعراض العصبية، وأكثرها شيوعاً مشاكل الجهاز العصبي الذاتي والمشاكل البصرية والحركية والحسية.[4]
أما الأعراض النوعية فتظهر بحسب مكان الضرر ضمن الجهاز العصبي، وقد تشمل فقدان الحس والتنميل كالوخز أو الخدر، وضعف العضلات، والتقلص العضلي، والمنعكسات الشديدة جداً، وصعوبة الحركة؛ وصعوبة التنسيق الحركي والتوازن (الترنح)، واضطراب الكلام، وصعوبة البلع، ومشاكل النظر (كالرأرأة والتهاب العصب البصري وازدواج الرؤية)، والإعياء، والألام الحادة أو المزمنة، ومشاكل المثانة والأمعاء وغيرها من الأعراض.[4] ومن الشائع أيضاً ظهور صعوبة في التفكير ومشاكل انفعالية مثل الاكتئاب أو المزاج المتقلّب[4] ومن الأعراض الخاصة المميزة للمرض ظاهرة أوتهوف، وهي تفاقم الأعراض نتيجة التعرض لدرجات حرارة أعلى من المعتادة، وعلامة ليرميت وهو إحساس يشبه مرور تيار كهربائي على طول الظهر عند تحريك الرقبة.[4] يستخدم مقياس اتساع مدى الإعاقة مع قياسات أخرى مثل مقياس المركب الوظيفي للتصلب المتعدد لقياس شدة المرض، ويُعتمد على هذه القياسات بصورة متزايدة في الأبحاث.[16][17][18]
في 85% من الحالات، يبدأ المرض كمتلازمة سريرية مُنعزلة على مدى عدة أيام، مع وجود مشاكل حركية أو حسّية لدى 45% من المصابين، والتهاب العصب البصري لدى 20%؛ وتظهر أعراض تتعلق بالاختلال الوظيفي لجذع الدماغ لدى 10%. أما الـ 25% المتبقين فيُعانون من أكثر من مشكلة مما سبق ذكره.[19] أما سير الأعراض فيمكن أن يحدث مبدئياً حسب أحد النمطين الآتيين: إما نوبات من التفاقم المفاجئ تدوم لبضعة أيام أو لأشهر (وتعرف بالانتكاسات، أو السورات، أو النوبات، أو الهجمات، أو الاحتدامات) يعقبها تحسّنٌ (في 85% من الحالات)، أو نمط التفاقم التدريجي على مدى الزمن بدون فترات شفاء (ويشمل هذا النمط 10 – 15% من الحالات).[14] وقد يحدث مزيج من النمطين.[7] أو قد يبدأ المريض بالنمط الناكس أو المعاود، ثم يتحول بعد ذلك إلى النمط المتطوّر.[14] لا يمكن توقع الانتكاسات عادةً، فهي تحدث دون سابق إنذار.[4] لكن نادراً ما تحدث السورات أكثر من مرتين في السنة.[4] ومع ذلك فبعض الانتكاسات تأتي مسبوقة بمسببات شائعة، وتحدث بصورة أكبر في فصلي الربيع والصيف.[20] وبشكل مماثل، فإن العدوى الفيروسية مثل الزكام أو الإنفلونزا أو الالتهاب المعدي المعوي من شأنها أن تزيد من إمكانية الإصابة.[4] يمكن أن يكون الإجهاد أيضاً مسبباً للهجمة.[21] يُقلل الحمل من إمكانية حدوث الانتكاس، ولكن الأشهر الأولى التالية للولادة تزيد من إمكانية الإصابة.[4] وبوجه عام لا يبدو أن الحمل يؤثر على الإعاقة على المدى طويل الأمد.[4] ويُشار إلى أنه قد ثبت أن العديد من الأمور لا تُؤثّر على معدلات حدوث الانتكاس بما في ذلك التطعيم والرضاعة [4] والاصابات الجسدية [22] وظاهرة أوتهوف.[20]
الأسباب
إن سبب التصلب المتعدد غير معروف، لكن يعتقد أنه يحدث نتيجة مزيج من العوامل الوراثية والبيئية كالعوامل المعدية.[4] تحاول النظريات جمع البيانات وصياغتها في تفسيرات مُرجّحة، ولكن لم تثبت صحة أي منها بعد. على الرغم من وجود العديد من عوامل الخطورة البيئية وبعضها قابل للتعديل جزئياً إلا أنه من الأهمية بمكان إجراء المزيد من البحوث لتحديد إذا كان إلغاء هذه العوامل البيئية سيقي من التصلب المتعدد.[23]
التوزع الجغرافي
يقلُ انتشار المرض كلما اقتربنا من خط الإستواء؛ لكن ثمة استثناءات عن هذه القاعدة.[4][24] وتشمل هذه الاستثناءات بعض المجموعات العرقية البعيدة عن خط الاستواء ونسبة الخطر فيها قليلة، مثل الساميين ووسكان الأمريكتين الأصليين والهوتريتيين في كندا وشعوب الماوري في نيوزيلاندا،[25] وشعب الإنويت الكندي،[14] وبعض المجموعات الأقرب إلى خط الاستواء ونسبة الخطورة فيها مرتفعة نسبياً، مثل السردينيين[14] والفلسطينيين والبارسيون [25]. وأسباب هذا النمط الجغرافي غير واضحة[14] إذ يُلاحظ أن هذا التدرج في مناطق تواجد المرض من الشمال إلى الجنوب أخذَ في التناقصِ ابتداءً من عام 2010،،[24] إلا أنه لا يزال موجوداً.[14] التصلب المتعدد أكثر شيوعاً بين شعوب أوروبا الشمالية [4]، وقد يعكس التباين الجغرافي ببساطة أماكن تواجد الشعوب الأكثر عرضة لخطر الإصابة بهذا المرض.[14] من المعلوم أن قلة التعرض لأشعة الشمس تُسبب نقصاً في فيتامين د، وقد يكون هذا تفسيراً محتملاً للإصابة بالتصلب المتعدد أيضاً.[26][27] إن وجود علاقة بين مواسم الولادات والإصابة بالتصلب المتعدد يُقدم دعماً لهذه الفكرة، حيث تزيد الإصابة بين مواليد شهر تشرين الثاني (نوفمبر) في النصف الشمالي من الكرة الأرضية مقارنةً بنسب إصابة مواليد شهر أيار (مايو).[28] تلعب العوامل البيئية دوراً أثناء مرحلة الطفولة؛ فقد أثبتت عدة دراسات أن الأشخاص الذين ينتقلون من منطقة إلى منطقة مختلفة من العالم قبل سن الخامسة عشرة يكتسبون درجة الخطر في المنطقة الجديدة، أما المهاجرون بعد سن الخامسة عشرة فيحتفظون بدرجة الخطورة الموجودة في موطنهم الأصلي.[4][23] غير أن هناك بعض الأدلة التي تشير إلى أن تأثير الانتقال قد يحدث أيضاً للأشخاص الأكبر من سن الـ15.[4]
الوراثيات
لا يُعتبر التصلب المتعدد مرضاً وراثياً، إلا أنه قد ثبت أن عدداً من التباينات الوراثية تزيد من إمكانية الإصابة بالمرض.[29] وترتفع إمكانية الإصابة بين أقارب الشخص المصاب مع زيادة هذا الاحتمال كلما كانت صلة القرابة أوثق.[5] في التوائم المتماثلة يصاب التوأمان في 30% من الحالات، بينما تقل نسبة الإصابة عند التوائم غير المتماثلة إلى 5%، وإلى 2.5% عند الأشقاء، وإلى نسبة أقل عند أنصاف الأشقاء.[4][5][30] إذا كان كلا الوالدين مصابٌ بالمرض فإن احتمال إصابة أولادهما يعادل عشر أضعاف نسبة إصابة السكان عامةً.[14] كما أن المرض أكثر شيوعاً عند بعض المجموعات العرقية عن سواهم.[31] الجينات النوعية المرتبطة بالتصلب المتعدد تشمل الاختلافات في مستضد الكريات البيضاء البشرية (HLA)، وهي مجموعة من الجينات التي توجد على الكروموسوم 6 الذي يعمل كمعقد التوافق النسيجي الكبير (MHC).[4] ترتبط التغيرات التي تحدث في منطقة مستضد الكريات البيضاء (HLA) بالاستعداد للإصابة بالمرض وهي معروفة منذ أكثر من 30 عاماً.[32] إضافة لذلك، وُجد أن هذه المنطقة مشاركة في تطور أمراض مناعية ذاتية أخرى مثل سكري النمط الأول والذِئْبَةٌ الحمامِيَّةٌ الشاملة.[32] عموماً فإن التقديرات تشير إلى أن التغيرات التي تحدث في HLA هي السبب في حوالي 20 إلى 60% من الاستعداد الوراثي للمرض.[32]
وقد كشفت الأساليب الوراثية الحديثة (دراسات الجينوم البشري) عن وجود 12 جين آخر على الأقل خارج الموقع الكروموسومي لـHLA قد تزيد قليلاً من احتمالية الإصابة بالتصلب المتعدد.[32]
العوامل المسببة للعدوى
اقتُرح أن العديد من الميكروبات قد تكون نقطة بدء الإصابة بالتصلب المتعدد، ولكن لم يتم تأكيد أي من تلك الآراء.[5] إن انتقال شخصٍ في سن صغيرة من أحد الأماكن في العالم إلى مكانٍ آخر يترتب عليه تغيّر إمكانية إصابة ذلك الشخص بالتصلب المتعدد.[9] وقد يكون سبب ذلك أن نوعاً ما من العدوى، التي يُحدِثها ميكروب واسع الانتشار أكثر من كونه نادراً، يتعلق بالمرض.[9] من آليات العدوى المقترحة ما يُعرف بالفرضية الصحية وفرضية الانتشار. وتقترح الفرضية الصحية أن التعرض لبعض العوامل المعدية في سنٍ مبكرة يقي من الإصابة، ويكون المرض استجابةً لمواجهة متأخرة مع تلك العوامل.[4] في حين تقترح فرضية الانتشار أن المرض يرجع إلى عامل مُعدٍ أكثر شيوعاً في المناطق التي ينتشر فيها التصلب المتعدد، حيث يتسبب العامل المعدي بإصابة معظم الأشخاص بحالة عدوى مستمرة بدون أعراض. فقط في حالات قليلة وبعد مرور سنوات عدة يتسبب المرض في إزالة الميالين.[9][33] وقد تلقت الفرضية الصحية قبولاً أكبر من فرضية الانتشار.[9]
تضم الأدلة الخاصة باعتبار الفيروس عاملا مسببا: وجود الشرائط قليلة النسائل في المخ والسائل الدماغي الشوكي لدى معظم المصابين بالتصلب المتعدد، وارتباط العديد من الفيروسات بالتهاب الدماغ والنخاع الشوكي المزيل للميالين في البشر، وحدوث إزالة الميالين في الحيوانات بسبب بعض حالات العدوى الفيروسية.[34] ويعتبر فيروس الهربس البشري من المجموعات الفيروسية المرشحة لذلك. الأفراد الذين لم يُصابوا مطلقاً بفيروس إبشتاين – بار هم أقل لإمكانية الإصابة بالتصلب المتعدد بينما يكون الأفراد الذين أُصيبوا به كشباب بالغين أكثر عرضة للإصابة به مقارنة بمن أصيبوا به في سن أصغر.[4][9] على الرغم من أن البعض يعتبر أن ذلك يتناقض مع الفرضية الصحية، حيث أن من لم يُصابوا ربما خضعوا لتنشئة أكثر تشددا من الناحية الصحية [9] ويعتقد الآخرون أنه لا يوجد تعارض لأن اللقاء الأول مع الفيروس المسبب في مرحلة متأخرة نسبياً من الحياة هو ما يحرك المرض.[4] وتضم الأمراض الأخرى التي قد تكون ذات صلة الحصبة والنكاف والحصبة الألمانية.[4]
عوامل أخرى
أظهر التدخين أنه عامل مخاطرة مستقل للإصابة بالتصلب المتعدد..[26] قد يكون الكرب عامل مخاطرة على الرغم من ضعف الأدلة التي تدعم ذلك.[23] وقد تم تقييم الارتباط بالتعرض المهني للسموم - بصورة أساسية المواد المذيبة- ولكن لم يتم التوصل لاستنتاجات واضحة.[23] كما دُرست التطعيمات كعوامل مسببة؛ ولكن، معظم الدراسات لم تظهر أي ارتباط.[23] وقد تم النظر في عدة عوامل مخاطرة محتملة أخرى، مثل الحمية وتناول الهرمونات؛ ولكن، الأدلة على علاقتها بالمرض "ضئيلة وغير مقنعة".[26] ويقل حدوث داء النقرس عما هو متوقع لدى الأشخاص المصابين بالتصلب المتعدد، كما وُجِدت مستويات أقل من حمض البول فيهم. وقد أدى ذلك إلى وجود النظرية القائلة بأن حمض البول عامل واقٍ، على الرغم أن أهميته الدقيقة تظل غير معروفة.[35]
الفسيولوجيا المرضية
الخصائص الثلاث الأساسية لمرض التصلب المتعدد هي تشكل الآفات في الجهاز العصبي المركزي (والتي تدعى أيضاً اللويحات)، التهاب وتدمير غمد الميالين الخاص بالخلايا العصبية. وتتفاعل تلك الخصائص بطريقة معقدة وغير مفهومة تماماً بعد لتؤدي إلى تحلل نسيج العصب وبالتالي ظهور علامات وأعراض المرض.[4] إضافة لذلك، يُعتقد أن التصلب المتعدد أحد اضطرابات الأمراض الالتهابية الناتجة عن اضطراب المناعة التي تتطور من تداخل بين العوامل الوراثية للفرد ومسببات بيئية غير معروفة بعد.[5] يُعتقد أن الأضرار تكون، على الأقل في جزء منها، بسبب قيام جهاز المناعة الخاص بالفرد نفسه بمهاجمة الجهاز العصبي.[4]
الضرر
يشير الاسم "التصلب المتعدد" إلى الندوب (الصلبة – التي تشيع معرفتها باسم اللويحات أو الآفات) التي تتشَّكل في الجهاز العصبي. تؤثّر هذه الندوب أكثر ما يكون في المادة البيضاء في العصب البصري وجذع الدماغ والعقد القاعدية والنخاع الشوكي أو المادة البيضاء القريبة من البطينات الجانبية.[4] وظيفة خلايا المادة البيضاء هي حمل الإشارات بين مناطق المادة الرمادية، حيث يتم إصدارها، وبين باقي الجسم. ونادراً ما يكون الجهاز العصبي المحيطي مشتركاً بالإصابة.[5]
وبصورة أكثر تحديداً، فإن التصلب المتعدد، يتضمن فقدان الخلايا الدبقية قليلة التغصّن، وهي الخلايا المسؤولة عن تشكيل الطبقة الدهنية والحفاظ عليها – والمعروفة باسم غلاف الميالين- والتي تساعد الخلايا العصبية على حمل الإشارات الكهربائية (احتمالات الحركة).[4] ويؤدي هذا إلى ترقيق أو فقدان الميالين بالكامل، وكلما تقدم المرض، يتحلل المحور العصبي للخلايا العصبية. عندما يُفقد الميالين، لا تستطيع الخلية العصبية أن تنقل الإشارات الكهربائية بصورة فعالة.[5] وتحدث عملية إصلاح تُسمى إعادة الميالين في المراحل المبكرة من المرض، ولكن الخلايا الدبقية قليلة الاستطالات لا تتمكن من إعادة بناء غلاف الميالين الخاص بالخلايا العصبية بصورة كاملة.[36] تؤدي الهجمات المتكررة إلى عملية إعادة الميالين أقل فعالية بالتتابع، إلى أن تظهر صفيحة تشبه الندبة حول المِحوار المتضرر.[36] وتكون تلك الندوب هي مصدر الأعراض وخلال الهجمات، عادة ما يُظهر التصوير بالرنين المغناطيسي أكثر من عشر صفيحات جديدة.[4] ويمكن أن يشير ذلك إلى أن هناك عددا من الآفات التي يستطيع الدماغ معها إصلاح نفسه بدون إن يؤدي ذلك إلى عواقب ملحوظة.[4] كما توجد عملية أخرى تشترك في إحداث الآفات وهي تشكل الخلايا النجمية بصورة غير عادية بسبب تدمير الخلايا العصبية القريبة.[4] وقد تم وصف عدد من أنماط الأفات [37]
الالتهاب
بعيداً عن إزالة الميالين، العلامة الأخرى المميزة للمرض هي الالتهاب. تحدث العملية الالتهابية، بما يلائم التفسير المناعي، بسبب الخلايا التائية، وهي نوع من الخلايا الليمفاوية التي تلعب دوراً هاماً في دفاعات الجسم.[5] تتمكن الخلايا التائية من الدخول إلى الجسم عبر تمزق في الحاجز الدموي الدماغي. وتتعرف الخلايا التائية على الميالين باعتباره دخيلاً وتبدأ في مهاجمته، مما يفسر سبب تسمية تلك الخلايا "الخلايا الليمفاوية ذاتية التفاعل"..[4] يبدأ الهجوم على الميالين عمليات التهابية تحفز خلايا مناعية أخرى وإطلاق عوامل أخرى قابلة للذوبان مثل السيتوكينان والأجسام المضادة. ويتسبب المزيد من كسر الحاجز الدموي الدماغي بحدوث عدد من التأثيرات الضارة الأخرى مثل التورّم (الانتفاخ)، وتفعيل البلاعم، وتفعيل أكثر للسيتوكينات والبروتينات المدمرة الأخرى.[5] يمكن أن يقلل الالتهاب من نقل المعلومات ما بين الخلايا العصبية بثلاث طرق على الأقل.[4] قد تقوم العوامل المذيبة التي تم إطلاقها بإيقاف النقل العصبي في الخلايا السليمة. وقد تؤدي تلك العوامل إلى فقدان الميالين أو تزيد من الفقدان، أو قد تؤدي إلى تحلل المِحوار تماماً.[4]
الحاجز الدموي الدماغي
الحاجز الدموي الدماغي هو جزء من جهاز الشعيرات الدموية الذي يمنع دخول الخلايا التائيّة إلى الجهاز العصبي المركزي. وقد تصبح قابلة لاختراق تلك الأنواع من الخلايا التي تظهر كنتيجة ثانوية للعدوى الفيروسية أو البكتيرية. بعد أن تعمل على إصلاح نفسها، أي بعد الشفاء من العدوى، قد تبقى الخلايا التائيّة محاصرة داخل الدماغ.[5]
التشخيص
يتم تشخيص مرض التصلب المتعدد بناءً على العلامات والأعراض الموجودة، بالإضافة إلى التصوير الطبي والفحوصات المخبرية الداعمة.[19] قد يكون تأكيد المرض صعباً، خاصة في المراحل المبكرة، حيث قد تتشابه علامات المرض وأعراضه مع أمراض أخرى.[4][38] تعتبر معايير ماكدونالد أكثر الطرق المستخدمة في تشخيص مرض التصلب اللويحي، وهي تركّز على على الأدلة السريرية والمخبرية والإشعاعية لوجود الآفات في أوقات مختلفة في مناطق مختلفة[12] كما تعتبر معايير شوماخر ومعايير بوزر الأكثر أهمية تاريخياً.[39] تتيح المعايير السابقة التشخيص غير الباضع، إلا أن البعض يشير إلى أن الدليل القاطع الوحيد على وجود المرض هو إجراء تشريح بعد الوفاة أو أخذ خزعة من الموضع الذي تم التأكد من وجود آفات نمطية للتصلب المتعدد فيه.[4][40][41] قد تكون البيانات السريرية وحدها كافية لتشخيص التصلب المتعدد إذا تعرّض المريض لهجمات منفصلة من الأعراض العصبية التي تميّز المرض.[40] في المرضى الذين يسعون للحصول على رعاية طبية بعد هجمة واحدة فقط، فإن الأمر يحتاج إلى اختبارات أخرى لإجراء التشخيص. أكثر الأدوات التشخيصية استخداماً هي التصوير العصبي، وتحليل السائل الدماغي الشوكي والاستجابات المستثارة. قد يظهر التصوير بالرنين المغناطيسي للمخ والنخاع الشوكي مناطق مزالة الميالين (ندوب أو لويحات). يمكن إعطاء الغادولينيوم من خلال الوريد كمادّة تباين لإلقاء الضوء على اللويحات النشطة ولإظهار وجود آفات قديمة غير مترافقة بأعراض إثناء إجراء التقييم، عن طريق الإلغاء.[40][42] يمكن أن يقدم اختبار السائل الدماغي الشوكي الذي تم الحصول عليه من البزل القطني الدليل على وجود التهاب مزمن في الجهاز العصبي المركزي. يُفحص السائل الدماغي الشوكي للحصول على الشرائط قليلة الأنسال من الغلوبولين المناعي G بواسطة الرحلان الكهربائي، والتي تعتبر واسمات التهابية توُجد لدى 75% - 85 % من الأشخاص المصابين بالتصلب المتعدد.[40][43] قد يستجيب الجهاز العصبي في حالة الإصابة بالتصلب المتعدد بصورة أقل نشاطاً لتحفيز العصب البصري والخلايا العصبية الحسية بسبب زوال الميالين من تلك الممرات. يمكن فحص هذه الاستجابات الدماغية باستخدام الاستجابات المرئية المستثارة والاستجابات المستثارة الحسية.[44]
المسارات السريرية
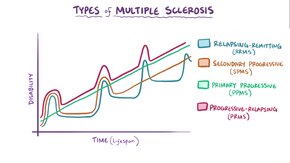
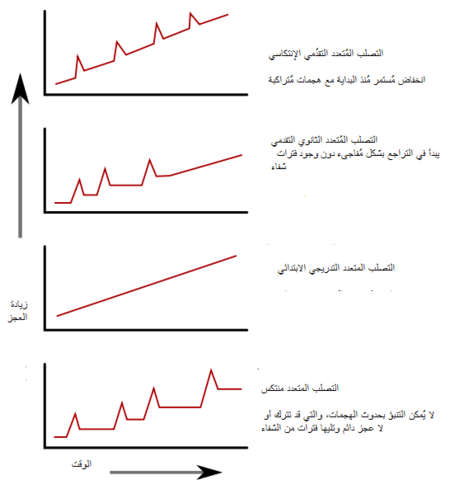
وصفت عدة أنواع فرعية، أو أنماط لتطور الحالة. تعتمد الأنواع الفرعية على السير السابق لهذا المرض في محاولة لـتوقع السير المستقبلي.فهي تكتسب أهميتها ليس فقط من أجل التشخيص بل لاتخاذ قرارات العلاج ايضا. في عام 1996 وصفت الجمعية الوطنية للتصلب المتعدد أربع مسارات سريرية:[7]
ويتميز النوع الفرعي الناكس المعاود بانتكاسات لا يمكن التنبؤ بها تليها فترات تمتد بين أشهر وسنوات من الهدوء النسبي (هجوع) مع عدم وجود علامات جديدة لنشاط المرض. حالات العجز التي تحدثُ أثناء الهجمات قد تتراجع أو تترك مشاكل، وتحدث هذه الأخيرة في حوالي 40٪ من الهجمات وهي أكثر شيوعا كلما كانت فترة المرض أطول [19][4] وهذا يصف سير المرض الأولي لدى 80٪ من الأفراد المصابين بالتصلب المتعدد.[4] عندما تتراجع حالة العجز دائمًا بين الهجمات، يشار إلى ذلك أحيانا بالتصلب المتعدد الحميد MS، [45] على الرغم من أن المصابين سوف يعانون من بعض درجات العجز التي ستتجمع على المدى الطويل.[4] ومن ناحية أخرى، فإن مصطلح التصلب المتعدد الخبيث يستخدم لوصف مرضى التصلب المتعدد الذين يصلون إلى مستوى كبير من العجز في فترة قصيرة من الزمن.[46] يبدأ النوع الفرعي الناكس الهاجع عادة بـ متلازمة معزولة سريريا (CIS). في المتلازمة المعزولة سريريا، يصاب المريض بهجمة توحي بـ إزالة الميالين، دون أن تستوفي معايير مرض التصلب المتعدد.[4][47] ويصاب حوالي 30 - 70٪ من الأشخاص الذين يعانون من المتلازمة المعزولة سريريا بالتصلب المتعدد في مرحلة لاحقة.[47]
يحدث التصلب المتعدد الثانوي المترقي في حوالي 65٪ من المصابين بالتصلب المتعدد الأولي الناكس الهاجع، الذين سيعانون بالنتيجة من لديهم تراجع عصبي متقدم بين الهجمات الحادة دون أي فترات أكيدة من الهجوع.[4][7] قد تظهر من حين لآخر انتكاسات وهجوع طفيف.[7] طول الفترة الزمنية الأكثر شيوعا بين بدء المرض والتحول من نوع التصلب المتعدد الناكس الهاجع إلى الثانوي المترقي هو 19 عاما..[48]
يحدثُ النوع الفرعي الأولي المترقي في حوالي 10-20٪ من الأفراد، ولا يترافق بوجود هجوع بعد الأعراض الأولية.[19][49] ويتميز بتطور العجز من البداية، دون هجوع أو تحسن، أو مع بعض التحسن البسيط أحيانا فقط.[7] السن المعتادة لبدء النوع الأولي المترقي أكثر تأخرا من النوع الناكس الهاجع. وهو مشابه للسن الذي يبدأ فيه عادة النوع الثانوي المترقي عادة في التصلب المتعدد الناكس الهاجع، أي حوالي 40 سنة من العمر.[4]
أما التصلب المتعدد المترقي الناكس فيصف الأفراد الذين يعانون من تراجع عصبي ثابت، منذ بداية المرض ولكنهم يمرون أيضا بهجمات مركبة واضحة. وهذا هو الشكل الأقل شيوعا بين جميع الأنواع الفرعية.[7]
وصفت أنواع غير عادية من التصلب المتعدد، وهي تشمل مرض ديفيتش، تصلب بالو المتحد المركز، تصلب شيلدر المنتشر وتصلب ماربوغ المتعدد. وهناك جدل بشأن ما إذا كانت هذه الأنواع أشكالاً أخرى للتصلب المتعدد أم أنها أمراض مختلفة.[50] يختلف سلوك التصلب المتعدد لدى الأطفال، حيث يستغرق وقتاً أطول للوصول إلى المرحلة المتقدمة.[4] ومع ذلك، فإنهم يصلون إليها في متوسط عمر أقل من البالغين عادة.[4]
تدبير الحالة
على الرغم من عدم توفر علاج شاف معروف لمرض التصلب المتعدد، إلا إن هناك العديد من العلاجات المفيدة. الأهداف الأساسية للعلاج هي استعادة الأداء الوظيفي بعد الهجمة، ومنع وقوع هجمات جديدة، ومنع الإعاقة. وكما هو الحال مع أي علاج طبي، فالأدوية المستخدمة في تدبير حالة التصلب المتعدد لديها العديد من آثار عكسية. ويتابع بعض المرضى العلاجات البديلة، على الرغم من نقص الأدلة الداعمة لها.
الهجمات الحادة
خلال الهجمات العرضية، يعتبر إعطاء جرعات مرتفعة من كورتيكوستيرويد ات عن طريق الوريد، مثل ميثيل بردنيزولون، هو العلاج المعتاد، [4] مع الكورتيكوستيرويدات عن طريق الفم التي يبدو أنها تتمتع بفعالية وهامش أمان مماثلين.[51] على الرغم من فعاليتها عموما في تخفيف الأعراض على المدى القصير، فالعلاجات الكورتيكوستيرويدية لا تبدو ذات تأثير كبير على الشفاء على المدى الطويل.[52] قد تكون عواقب الهجمات الشديدة التي لا تستجيب للكورتيكوستيرويدات قابلة للعلاج بواسطة فصادة البلازما [4].
العلاجات المعدلة للمرض
التصلب المتعدد الناكس الهاجع
تمت الموافقة على ثمانية علاجات معدلة للمرض من قبل الجهات التنظيمية لعلاج التصلب المتعدد الناكس الهاجع (RRMS)، تضم: إنترفيرون بيتا-1A، إنترفيرون بيتا-1B، جلاتيرامير أسيتات، ميتوكزانترون، ناتاليزوماب، فينغوليمود، [53] تيريفلونوميد[54] ودايميثيل فومارات.[55] ولكن لم تثبت جدواها الاقتصادية حسب دراسات 2012.[56]
في التصلب المتعدد الناكس الهاجع، نجد هذه العلاجات فعالة بشكل معتدل في خفض عدد الهجمات.[53] ويعتبر الإنترفيرون وجلاتيرامير اسيتات الخط العلاجي الأول [19] ويعتبر العلاج المبكر والطويل المدى آمنا ويحسن النتائج .[57][58] يقلل ناتاليزوماب من معدل الانتكاس أكثر من علاجات الخط الأول، ولكن نظرا للأمور المتعلقة بالآثار العكسية فهو يعتبر خطاً علاجياً ثانياً يحتفظ به لأولئك الذين لا يستجيبون للعلاجات الأخرى [19] أو للحالات الشديدة من المرض.[59] أما الميتوكزانترون المحدود الاستعمال بسبب آثاره العكسية الشديدة فهو خيار الخط الثالث لأولئك الذين لا يستجيبون للأدوية الأخرى.[19] علاج المتلازمة معزولة سريريا (CIS) بواسطة الانترفيرون يقلل من إمكانية انتقال المرض إلى حالة التصلب المتعدد السريرية.[4][60] وتقدر فعالية الإنترفيرون وجلاتيرامير لدى الأطفال معادلة تقريباً لفعاليتها لدى البالغين.[61] ويبقى دور بعض العوامل الجديدة مثل فينغوليمود وتيريفلونوميد ودايميثيل فومارات، حتى عام 2011، غير واضح بعد تماما.[62]
التصلب المتعدد المترقي
لم يظهر أي علاج قدرته على تغيير مسار التصلب المتعدد الأولي المترقي [19] واعتبارا من عام 2011 حصل دواء واحد فقط، وهو ميتوكزانترون على الموافقة لعلاج التصلب المتعدد الثانوي المترقي.[63] في هذه الفئة من المرضى هناك دليل مبدئي يدعم استخدام ميتوكزاتنرون باعتدال في ابطائه لتطور المرض وانقاصه لمعدلات الانتكاس أكثر من عامين.[64][65]
الآثار العكسية
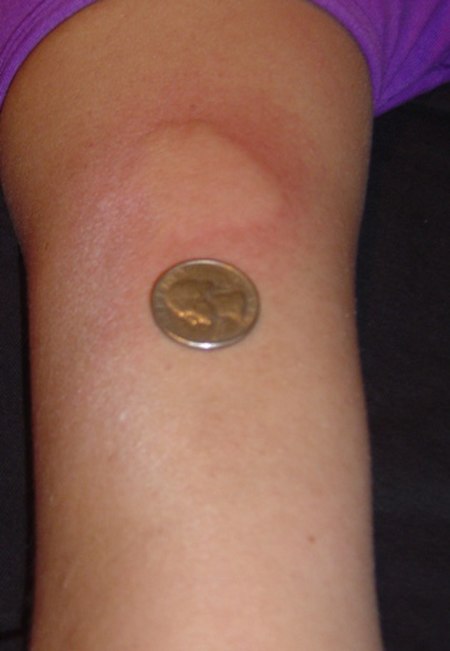
هناك العديد من الآثار العكسية للعلاجات المعدلة للمرض. وأحد أكثرها شيوعا هو تهيج الجلد في موقع حقن جلاتيرامير أسيتات وإنترفيرون (حيث تصل إلى 90٪ عند الحقن تحت الجلد و33٪ عند الحقن العضلي).[66] ومع مرور الوقت، يمكن مشاهدة بروزا في موقع الحقن، ويرجع ذلك إلى التخريب الموضعي للأنسجة الدهنية، والمعروف باسم الضمور الشحمي[66] قد تسبب الانترفيرونات اعراضا مشابهة للانفلونزا [67] ويعاني بعض الأشخاص الذين يتلقون جلاترامير ردود فعل تالية للحقن تتضمن التبيغ، وضيق الصدر، وخفقان القلب وضيق التنفس، والقلق، وهي تستمر لأقل من ثلاثين دقيقة عادة .[68] الآثار العكسية الأكثر خطورة ولكن أقل شيوعا بكثير هي تلف الكبد بسبب الإنترفيرون،[69] الخلل الوظيفي الانقباضي (12٪)، العقم واللوكيميا النخاعية الحادة (0.8٪) بسبب الميتوزانترون ،[64][70] واعتلال بيضاء الدماغ العديد البؤر المترقي الذي يحدث بسبب ناتاليزوماب (التي تحدث لدى 1 من 600 من الأشخاص المعالجين).[19][71]
قد يسبب فنغوليمود حدوث ارتفاع ضغط الدم وبطء القلب وذمة البقعة الصفراء، وارتفاع معدل أنزيمات الكبد أو انخفاض مستويات الخلايا اللمفاوية.[72] هناك أدلة مبدئية تؤيد سلامة تيريفلونوميد على المدى القصير، حيث تشمل الآثار الجانبية الشائعة: الصداع، والتعب، والغثيان، وفقدان الشعر، وآلام الأطراف.[53] وكانت هناك أيضا تقارير عن فشل الكبد واعتلال بيضاء الدماغ العديد البؤر المرافق لاستخدامه كما إنه يسبب خطرا على تطور الجنين.[72] الآثار الجانبية الأكثر شيوعا بسبب ديميثيل فومارات هي التبيغ ومشاكل الجهاز الهضمي.[55][72] وفي حين من الممكن أن يسبب دايميثيل فومارات حدوث انخفاض في عدد خلايا الدم البيضاء إلا إنه لم يتم الإبلاغ عن حدوث حالات من العدوى الانتهازية أثناء التجارب.[73]
الأعراض المُترابطة
لقد أُثبت أن لكل من الأدوية والتأهيلات العصبية القُدرة على تحسين بعضًا الأعراض، لكنها لا تُغير من مسار المرض.[74] من بين الأعراض التي لديها رد جيد بسبب الأدوية والعلاج، المثانة غير المُستقرة والتشنج، بينما قد تطرأ تغييرات بسيطة في القليل من باقي الأعراض.[4] يجبُ اتّباع نهج مُتعدد التخصصات للمشاكل العصبية وذلك للتحسين من نوعية الحياة، فهناك الحاجة إلى الخدمات الصحية المُختلفة.[4] ارتفع نشاط ومشاركة المُصابين بالتصلب المُتعدد في برامج التأهيل المُتعدد ولكنها لا تؤثر على مستوى الإعاقة.[75] لا توجد أدلة كافية على الفعالية الشاملة للتخصصات العلاجية الفردية،[76][77] مع ذلك توجد أدلة قوية وكافية على فعالية بعض من العلاجات الفردية مثل:مُمارسة التمارين الرياضية[78][79] وعلاج علم النفس والعلاج السلوكي المعرفي.[80]
علاجات بديلة
قد يستخدم ما نسبته أكثر من 50% من المصابين بالتصلب المتعدد الطب البديل، على الرغم من أن هُناك تفاوت في هذه النسب بسبب أختلاف تعريف الطب البديل.[81] يفتقر هذا النوع من العلاج إلى الأدلة الواضحة التي تُبين مدى فعاليته أو حتى تُعتبر معدومة.[81][82] تتضمن العلاجات ذات فائدة غير مُثبتة المُستخدمة من المُصابين بالتصلب المُتعدد منها، المكملات الغذائية والخاصة بالحمية الغذائية[81][83][84] وفيتامين دي[85] وبعض أساليب الأسترخاء مثل اليوغا[81] والتداوي بالأعشاب (والقنب الطبي)[81][86] والمعالجة بالإكسجين عالي الضغط[87] والعلاج الدودي وعلم المنعكسات والوخز بالأبر.[81][88] يتم استخدام العلاج بنسبة أكبر من قبل النساء والمُصابين بالتصلب المتعدد لفترة أطول أو من يعانون من اعاقة.[81]
توقعات سير المريض

لا توجد معلومات <13 13–16 16–19 19–22 22–25 25–28 | 28–31 31–34 34–37 37–40 40–43 >43 |
تعتمدُ توقعات سير المريض على أمور كثيرة منها النوع الفرغي للمرض والعمر والجنس وعلى الأعراض الأولية للشخص وكذلك درجة الإعاقة الخاصة بالمريض.[10] تُوجد علاقة مُشتركة ما بين (النساء والتهاب العصب البصري ونوع فرعي مُنتكس أو بعض من الأعراض الحسية في البداية وقليل من الهجمات المرضية في السنوات الأولى أو في سن مُبكرة في البداية) وما بين توقعات سير جيدة للمريض.[10][89]
يبلغُ مُتوسط العمر المتوقع للمُصابين 30 عامًا مُنذ بداية الإصابة بتصلب المتعدد، أقل بخمس حتى عشرة سنوات بالنسبة للإشخاص غير المُصابين بالمرض.[4] تبلغُ 40% نسبة المُصابين بالمرض التي تبلغ أعمارهم السبعون عامًا.[89] على الرغم من ذلك، فإن ثلثي المُصابين يعود سبب وفاتهم إلى عواقب المرض،[4] يُعد الانتحار عند المُصابين أكثر شيوعًا، بينما تُعد الالتهابات والمُضاعفات الأخرى أشجُ خطرًا عند الإشخاص المُصابين بإعاقة.[4] على الرغم من أن يفقدُ الكثير من المُصابين قُدرتهم على المشي قبل الوفاة، فتبلغ 90% نسبه القادرين على المشي وحدهم بعد 10 سنوات مُنذ الإصابة بالمرض بينما تبلغ 75% بعد 15 سنة.[90]
الوبائيات
يُعد التصلب المُتعدد الاضطراب المناعي الذاتي الأكثر شيوعًا الذي يُصيب الجهاز العصبي المركزي.[11] ففي عام 2010، بلغ عدد المُصابين بالتصلب المتعدد ب 2-2,5 مليون (أي ما يُعادل 30 اصابة لكل 100,000 شخص) في العالم، حيث تتراوح معدلات الإصابة حسب المنطقة.[12][14] يُسبب المرض ب18،000 حالة وفاة سنويًا.[91] حيث تبلغُ ما يقلُ عن 0,5 لكل 100,000 حالة إصابة في أفريقيا و2،8 لكل 100,000 بينما تبلغ في جنوب شرق اسيا 8,3 وفي أوروبا 80 لكل 100,000 حالة اصابة.[12] تزيد معدل الوفيات لبعض المجموعات من أصول تنحدر من أوروبا الشمالية.[14] هناك زيادة في معدل الحالات الجديدة ب2،5 لكُل 100,000 شخص في العالم.[12] ويبدو أن عدد المصابين أخذ بالارتفاع،[14][33] ويمكن تفسير ذلك بسبب أرتفاع جودة تشخيص المريض.[9][23][26]
يظهر عادةُ مرض تصلب متعدد عند الأشخاص في أواخر العشرينات وبداية الثلاثينيات ولكن يُمكن أن يصاب الأطفال به وكذلك من تجاوز عمره الخمسون لكنها نادرة الحدوث.[12][14] يُعد النوع الفرعي التدريجي الأكثر شيوعًا بين الأشخاص في الخمسين من العُمر.[49] تُعد النساء أكثر عُرضةُ للإصابة بالمرض من الرجل، كما هو الحال في أكثر الأمراض المناعية الذاتية وتستمر بالتزايد أيضًا.[4][24] ففي عام 2008، تم أثبات أن نسبة الإصابة بالمرض عند النساء هي الضعف مُقارنة بالرجال.[12] أما عند الأطفال، فيصيب الأناث أكثر من الذكور،[4] أما عند الأشخاص بعد سن الخمسون فتكون نسبة الإصابة مُتساويةً تقريبًا.[49]
التاريخ

تاريخ الاكتشاف
وصف أستاذ علم الأمراض البريطاني روبرت كارسويل(1793-1857) وأستاذ علم التشريح وعلم الأمراض الفرنسي جان كروفييه (1791-1873) العديد من التفاصيل والأعراض السريرية المُتعلقة بمرض التصلب المُتعدد، لكنهما لم يعرّفاه كمرض مُنفصل بحد ذاته.[92] قام العالم كارسويل بوصف الإصابات ب"كآفه ملحوظه في الحبل الشوكي مع ضمور".[4] أشار الطبيب الشرعي السويسري إدوارد فون رندفلايش (1836-1908) في عام 1863 أن الآفات المُصاحبة للالتهابات تنتشرُ حول الأوعية الدموية.[93][94]
كان طبيب الأمراض العصبية الفرنسي جان مارتن شاركو (1825-1893) أول شخص من فام بتعريف واكتشاف التصلب المتعدد كمرض متميز وكان ذلك في عام 1868.[92] وذلك بالاستعانة بالتقارير والمعلومات السابقة وإضافة إلى مُلاحظاته السريرية والمرضية ولقد لُقب شاركو بsclerose en plaques.
التشخيص
كان شاركو أول من حاول لوضع معايير لتشخيص مرض التصلب المتعدد، ما تُعرف الآن باسم "ثالوث شاركو"، والتي تتضمن رأرأة ورجفان قصدي وكلام تلغرافي،[95] وكما لاحظ شاركو بإن مرضاه كانوا يُعانوا من تغييرات في الإدراك والمعرفة، حيث قام بوصف مرضاه بأنهم يُعانون من ضعف ملحوظ في الذاكرة واستعياب بطئ للأفكار والمعلومات.[15]
وكان يُعتمد على ثالوث شاركو والملاحظات السريرية لتشخيص المرض حتى قام شوماخر بأول مُحاولة لتوحيد معايير لتشخيص المرض وكان ذلك في عام 1965 وتتضمنت التالي:أعراض سريرية لمشكلة ما في الجهاز العصبي المركزي وأدلة على مشاركة منطقتين أو أكثر للجهاز العصبي المركزي وأدلة مشاركة المادة البيضاء وغيرها.[95] وتم حاليًا إدراجه في معايير ماكدونالد ومعايير بوسير في عام 2010 ويتم حاليًا الأستعانة بها للتشخيص.
بدأ ظهور علاجات فعالة من خلال نظريات القرن 20.[4]
البحوث
الأدوية

تهدُف الأبحاث الحالية اكتشاف طرق للعلاج حيثُ تكون أكثر فعالية وأسهلُ إدارةًً في حالة التصلب المُتعدد المُنتكس، أكتشاف علاج من أجل الأنواع الفرعية التقدمية، تكوين أستراتيجيات خاصة بالحماية العصبية وأكتشاف علاج فعال للأعراض.[96]
في أعوام 2000 و2010، تمت الموافقة على بعض من الأدوية التي تؤخذ عن طريق الفم حيثُ من المتوقع أن ترتفع وتيرة أستخدام هذه الأدوية.[97] حاليًا، تخضع أدوية أخرى للأبحاث منها لاكوينيمود، حيث وصل إلى المرحلة الثالثة للإبحاث وذلك في شهر أغسطس عام 2012، ولم يتم الحصول على نتائج حاسمة في المراحل السابقة.[98] في نفس الوقت، توجد عدة أبحاث أخرى والتي تهتم بزيادة فعالية العلاج الحالي وكذلك التسهيل من إدارته. يتضمن العلاج أنواع من الأدوية الجديدة مثل إنترفيرون بيتا 1-ألفا، حيث كان من المتوقع أن يتم أستخدامه عند فواصل زمنية أطول لكن بالحفاظ على ردود فعل مُشابهة.[99][100] ومن المُنتظر أن تتم الموافقة على بيغإنترفيرون بيتا 1-ألفا في عام 2013.[100]
توجد آثار بسبب مضادات وحيد النسيلة. أثبتت المضادات وحيد النسيلة مثل أليمتوزوماب وداكليزوماب وسي دي 20 وريتوكسيماب وأوفاتوموماب أنها تمتلك بعض المُميزات وما زالت في مرحلة الأبحاث كأحتمال للعلاج.[101] لكن أدى أستخدام هذه الأدوية إلى حدوث بعض من الأعراض الجانبية الخطيرة خاصةً العدوة الانتهازية.[97] وهناك إبحاث أخرى تخص أكتشاف أختبار خاص باأضداد فيروس جي سي، حيثُ من المُمكن أن يساعد على التعرف على المُصابين الأكثر عُرضة للإصابة باعتلال بيضاء الدماغ متعدد البؤر التقدمية وذلك عند الحصول على عينة من ناتاليزوماب.[97] على الرغم من أن تلعب المضادات وحيد النسيلة دورًا في علاج التصلب المُتعدد في المُستقبل إلا أنه بسبب عوامل الخطورة المُرافقة لهذا العلاج، فسيكون أستعمال هذا العلاج مُنخفض.[97]
توجد أستراتيجية أخرى مُستخدمة في الأبحاث والتي تتضمن عمل تقييم لفعالية أستخدام أثنان من الأدوية أو أكثر بما يُعرف العلاج المُركب.[102] ويرجع هدف أستخدام العلاج المُركب في التصلب المُتعدد إلى أن العلاج يستهدف آليات مُختلفة لذلك فليس من الضرورة أستبعادها. التآزريات،[102] في هذه الحالات بعض الأدوية تقوم بتحفيز آثار الأدوية الأخرى، يعتبر أمر مُمكن الحدوث لكن له بعض العيوب مثل حجب عمل بعض الأدوية أو زيادةً في أظهار آثارها الجانبية.[102] هناك بعض الدراسات السريرية الخاصة بالعلاج المًركب، لكن لم تُثبت أيً منها نتائج إيجابية لكي يتم أعتبارها كعلاج فعال لمرض التصلب المُتعدد.[102]
ما زالت الأبحاث الخاصة بالحماية العصبية والعلاجات التجديدية وكذلك العلاج بالخلايا الجذعية بالمراحل الابتدائية على الرغم من أهميتها الكبيرة.[103] في نفس الوقت، لا يوجد علاج للمراحل المُتطورة للمرض. من المُمكن تقييم الكثير من الأدوية الجديدة وكذلك الأدوية التي ما زالت تحت نطاق العمل والتطوير حاليًا كعلاج من أجل التصلب المتعدد البدئي المترق والتصلب المتعدد الثانوي المترق.[97]
الواصمات الحيوية للمرض

لن تتغير معايير التشخيص الخاصة بالمرض في المستقبل القريب على الرغم من ذلك، فإن في الوقت الحالي هُناك الكثير من الجهود من أجل أستكشاف بعض من الواصمات الحيوية التي سوف تُساعد على التشخيص وتوقع تطور المرض.[97] وتتضمن الطرق الجديدة للتشخيص كُل من دراسات المُتعلقة بالأجسام المُضادة المُكافحة للميلين ودراسات عن السائل الدماغي الشوكي والمَصْل، لكن لم تُعطى أيً منها أي نتائج إيجابية واضحة.[105]
لا توجد في الوقت الحاضر فحوصات مخبرية تؤدي إلى العلم مُسبقًا بتطور المرض. اقتُرحت عدة حلول منحت بعض الآمال، مثل: إنترلوكين 6 وأحادي أكسيد النيتروجين وحمض النتريك سينثاز و"Osteopontin" وغلوبولين جنيني-ألف.[105] يعود سبب تطور المرض إلى تدهور وانحلال العصبونات، تكمُن وظيفة البروتينات بتبين بفقدان النسيج العصبي مثل الخيط العصبي وبروتين تاو وحمض ن-أسيتيل الأسبارتيك، حيث أنها تخضع للأبحاث.[105] في نفس الوقت، هناك مُحاولات لاكتشاف واصمات لتُساعد على تمييز المرضى الذين سيستجيبون للعلاج عن أولئك الذين لن يستجيبوا للعلاج.[105]
قصور وريدي دماغي نخاعي مزمن
في عام 2008، أيد جراح الأوعية الدموية باولو زامبوني كتصلب المتعدد تؤدي إلى عملية تضييق الأوعية الدموية التي تُغذي الدماغ، وقد أطلق على هذه العملية أسم قصور وريدي دماغي نخاعي مزمن. أكتشف زامبوني كجميع مرضاة المُصابين بالتصلب المُتعدد كانوا يعانوا من القصور الوريدي الدماغي النخاعي المُزمن، حيثُ يجرى عملية جراحية لتصحيح هذه المُشكلة، وسُميت هذه العملية في الإعلام ب"إِجْراءات تحريرية"، وصرح الجراح بأن 73% من الأشخاص الذين خضعوا لهذه العملية أظهروا حالة من التحسن.[106] أكتسبت هذه النظرية أهتمامًا من قبل الإعلام والمُصابين بالتصلب المُتعدد خصوصًا في كندا.[107] لا تُعد أفتراضات زامبوني مؤكدة معلوماتيًا ويعود السبب إلى أن الدراسات السريرية التي أجريت ليست بعمياء ولا بمفحوصة والتي أثارت بعض المخاوف.[108] في نفس الوقت، لم تكشف الدراسات اللاحقة أي علاقة ما بين القصور الوريدي الدماغي النُخاعي المُزمن والتصلب المُتعدد [109] أو أكتُشف علاقة ما بينهما لكن ليست بواضحة، ولكن أدت أفتراضية زامبوني إلى أثارة أعتراضات جادة للفرضية.[110] تم نقد "إِجْراءات تحريرية" وذلك بسبب المُضاعفات الخطيرة الناجمة عنها وموت المُصابين، من دون أي فوائدة مُثبتة.[108] في عام 2013، لم يكن موصى بهذه الفرضية كعلاج للتصلب المُتعدد.[111] حاليًا، تُجرى العديد من الأبحاث بخصوص فرضية القصور الوريدي الدماغي النخاعي المزمن.[112]
مقالات ذات صلة
المراجع
- العنوان : Prevalence of Multiple Sclerosis in Iceland — المجلد: 51 — الصفحة: 50-56 — العدد: 1-2 — نشر في: Neuroepidemiology — https://dx.doi.org/10.1159/000489472 — https://pubmed.ncbi.nlm.nih.gov/29940573
- "WHO EMRO - WHO EMRO - Unified Medical Dictionary". مؤرشف من الأصل في 17 أبريل 2019.
- موقع ويب طب:التصلب اللويحي ما هو التصلب اللويحي، والأعراض والأسباب وعوامل الخطر والمضاعفات والتشخيص والعلاج تاريخ الولوج 17.سبتمبر.2016 نسخة محفوظة 01 يوليو 2017 على موقع واي باك مشين.
- Compston A, Coles A (2008). "Multiple sclerosis". Lancet. 372 (9648): 1502–17. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977.
- Compston A, Coles A (April 2002). "Multiple sclerosis". Lancet. 359 (9313): 1221–31. doi:10.1016/S0140-6736(02)08220-X. PMID 11955556.
- Murray ED, Buttner EA, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Daroff R, Fenichel G, Jankovic J, Mazziotta J (المحرر). Bradley's neurology in clinical practice (الطبعة 6th ed.). Philadelphia, PA: Elsevier/Saunders. .
- Lublin FD, Reingold SC; National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis (1996). "Defining the clinical course of multiple sclerosis: results of an international survey". Neurology. 46 (4): 907–11. doi:10.1212/WNL.46.4.907. PMID 8780061.
- Nakahara, J (2012 Feb). "Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy". Clinical reviews in allergy & immunology. 42 (1): 26–34. PMID 22189514.
- Ascherio A, Munger KL (April 2007). "Environmental risk factors for multiple sclerosis. Part I: the role of infection". Annals of Neurology. 61 (4): 288–99. doi:10.1002/ana.21117. PMID 17444504.
- Weinshenker BG (1994). "Natural history of multiple sclerosis". Annals of Neurology. 36 (Suppl): S6–11. doi:10.1002/ana.410360704. PMID 8017890.
- Berer K, Krishnamoorthy G (April 2014). "Microbial view of central nervous system autoimmunity". FEBS Letters. S0014-5793 (14): 00293–2. doi:10.1016/j.febslet.2014.04.007. PMID 24746689.
- World Health Organization (2008). Atlas: Multiple Sclerosis Resources in the World 2008 ( كتاب إلكتروني PDF ). Geneva: World Health Organization. صفحات 15–16. . مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 13 مايو 2014.
- GBD 2013 Mortality and Causes of Death, Collaborators (17 December 2014). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013". Lancet. 385: 117–171. doi:10.1016/S0140-6736(14)61682-2. PMC . PMID 25530442.
- Milo R, Kahana E (March 2010). "Multiple sclerosis: geoepidemiology, genetics and the environment". Autoimmun Rev. 9 (5): A387–94. doi:10.1016/j.autrev.2009.11.010. PMID 19932200.
- Clanet M (June 2008). "Jean-Martin Charcot. 1825 to 1893". Int MS J. 15 (2): 59–61. PMID 18782501. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 08 أبريل 2020.
* Charcot, J. (1868). "Histologie de la sclerose en plaques". Gazette des hopitaux, Paris. 41: 554–5. مؤرشف من الأصل في 30 مارس 2019. - Kurtzke JF (1983). "Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)". Neurology. 33 (11): 1444–52. doi:10.1212/WNL.33.11.1444. PMID 6685237.
- Amato MP, Ponziani G (1999). "Quantification of impairment in MS: discussion of the scales in use". Mult. Scler. 5 (4): 216–9. PMID 10467378.
- Rudick RA, Cutter G, Reingold S (2002). "The multiple sclerosis functional composite: a new clinical outcome measure for multiple sclerosis trials". Mult. Scler. 8 (5): 359–65. PMID 12356200.
- Tsang, BK (2011 Dec). "Multiple sclerosis- diagnosis, management and prognosis". Australian family physician. 40 (12): 948–55. PMID 22146321.
- Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). "Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis". Neuroepidemiology. 27 (1): 28–32. doi:10.1159/000094233. PMID 16804331.
- Heesen C, Mohr DC, Huitinga I; et al. (2007). "Stress regulation in multiple sclerosis: current issues and concepts". Mult. Scler. 13 (2): 143–8. doi:10.1177/1352458506070772. PMID 17439878.
- Martinelli V (2000). "Trauma, stress and multiple sclerosis". Neurol. Sci. 21 (4 Suppl 2): S849–52. doi:10.1007/s100720070024. PMID 11205361. مؤرشف من الأصل في 1 نوفمبر 2013.
- Marrie RA (December 2004). "Environmental risk factors in multiple sclerosis aetiology". Lancet Neurol. 3 (12): 709–18. doi:10.1016/S1474-4422(04)00933-0. PMID 15556803.
- Alonso A, Hernán MA (July 2008). "Temporal trends in the incidence of multiple sclerosis: a systematic review". Neurology. 71 (2): 129–35. doi:10.1212/01.wnl.0000316802.35974.34. PMC . PMID 18606967.
- Pugliatti M, Sotgiu S, Rosati G (2002). "The worldwide prevalence of multiple sclerosis". Clin Neurol Neurosurg. 104 (3): 182–91. PMID 12127652.
- Ascherio A, Munger KL (June 2007). "Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors". Annals of Neurology. 61 (6): 504–13. doi:10.1002/ana.21141. PMID 17492755.
- Ascherio A, Munger KL, Simon KC (2010). "Vitamin D and multiple sclerosis". Lancet Neurol. 9 (6): 599–612. doi:10.1016/S1474-4422(10)70086-7. PMID 20494325.
- Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). "Vitamin D: an evidence-based review". J Am Board Fam Med. 22 (6): 698–706. doi:10.3122/jabfm.2009.06.090037. PMID 19897699.
- Dyment DA, Ebers GC, Sadovnick AD (2004). "Genetics of multiple sclerosis". Lancet Neurol. 3 (92): 104–10. doi:10.1016/S1474-4422(03)00663-X. PMID 14747002.
- Hassan-Smith, G (2011 Oct). "Epidemiology and diagnosis of multiple sclerosis". British journal of hospital medicine (London, England : 2005). 72 (10): M146-51. PMID 22041658.
- Rosati G (2001). "The prevalence of multiple sclerosis in the world: an update". Neurol. Sci. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614.
- Baranzini SE (2011). "Revealing the genetic basis of multiple sclerosis: are we there yet?". Curr. Opin. Genet. Dev. 21 (3): 317–24. doi:10.1016/j.gde.2010.12.006. PMC . PMID 21247752.
- Kurtzke JF (October 1993). "Epidemiologic evidence for multiple sclerosis as an infection". Clin. Microbiol. Rev. 6 (4): 382–427. doi:10.1128/CMR.6.4.382. PMC . PMID 8269393. مؤرشف من الأصل في 6 أبريل 2020.
- Gilden DH (2005). "Infectious causes of multiple sclerosis". ذا لانسيت. 4 (3): 195–202. doi:10.1016/S1474-4422(05)01017-3. PMID 15721830.
- Spitsin S, Koprowski H (2008). "Role of uric acid in multiple sclerosis". Curr. Top. Microbiol. Immunol. 318: 325–42. PMID 18219824.
- Chari DM (2007). "Remyelination in multiple sclerosis". Int. Rev. Neurobiol. 79: 589–620. doi:10.1016/S0074-7742(07)79026-8. PMID 17531860.
- Pittock SJ, Lucchinetti CF (2007). "The pathology of MS: new insights and potential clinical applications". Neurologist. 13 (2): 45–56. doi:10.1097/01.nrl.0000253065.31662.37. PMID 17351524.
- Trojano M, Paolicelli D (November 2001). "The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes". Neurol. Sci. 22 (Suppl 2): S98–102. doi:10.1007/s100720100044. PMID 11794488. مؤرشف من الأصل في 20 أكتوبر 2014.
- Poser CM, Brinar VV (2004). "Diagnostic criteria for multiple sclerosis: an historical review". Clin Neurol Neurosurg. 106 (3): 147–58. doi:10.1016/j.clineuro.2004.02.004. PMID 15177763.
- McDonald WI, Compston A, Edan G; et al. (2001). "Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis". Ann. Neurol. 50 (1): 121–7. doi:10.1002/ana.1032. PMID 11456302.
- Polman CH, Reingold SC, Edan G; et al. (2005). "Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann. Neurol. 58 (6): 840–6. doi:10.1002/ana.20703. PMID 16283615.
- Rashid W, Miller DH (February 2008). "Recent advances in neuroimaging of multiple sclerosis". Semin Neurol. 28 (1): 46–55. doi:10.1055/s-2007-1019127. PMID 18256986.
- Link H, Huang YM (November 2006). "Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness". J. Neuroimmunol. 180 (1–2): 17–28. doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427.
- Gronseth GS, Ashman EJ (May 2000). "Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 54 (9): 1720–5. doi:10.1212/WNL.54.9.1720. PMID 10802774.
- Pittock SJ, Rodriguez M (2008). "Benign multiple sclerosis: a distinct clinical entity with therapeutic implications". Curr. Top. Microbiol. Immunol. 318: 1–17. doi:10.1007/978-3-540-73677-6_1. PMID 18219812.
- Feinstein, A (2007). The clinical neuropsychiatry of multiple sclerosis (الطبعة 2nd ed.). Cambridge: Cambridge University Press. صفحة 20. .
- Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (2005). "Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis". Lancet Neurol. 4 (5): 281–8. doi:10.1016/S1474-4422(05)70071-5. PMID 15847841.
- Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (2006). "Secondary progressive multiple sclerosis: current knowledge and future challenges". Lancet Neurol. 5 (4): 343–54. doi:10.1016/S1474-4422(06)70410-0. PMID 16545751.
- Miller DH, Leary SM (2007). "Primary-progressive multiple sclerosis". Lancet Neurol. 6 (10): 903–12. doi:10.1016/S1474-4422(07)70243-0. PMID 17884680.
- Stadelmann C, Brück W (2004). "Lessons from the neuropathology of atypical forms of multiple sclerosis". Neurol. Sci. 25 (Suppl 4): S319–22. doi:10.1007/s10072-004-0333-1. PMID 15727225.
- Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care ( كتاب إلكتروني PDF ). London: Royal College of Physicians. 2004. صفحات 54–57. . PMID 21290636. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 8 أبريل 202006 فبراير 2013.
- He, D (2012 Dec 12). Zhou, Hongyu (المحرر). "Teriflunomide for multiple sclerosis". Cochrane database of systematic reviews (Online). 12: CD009882. doi:10.1002/14651858.CD009882.pub2. PMID 23235682.
- "FDA approves new multiple sclerosis treatment Aubagio" (Press release). US FDA. 2012-09-12. مؤرشف من الأصل في 18 يناير 201721 يناير 2013.
- "Biogen Idec's TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis" (Press release). Biogen Idec. 2013-03-27. مؤرشف من الأصل في 1 نوفمبر 201304 يونيو 2013.
- Manouchehrinia, A (2012 Oct). "Cost-effectiveness of disease-modifying therapies in multiple sclerosis". Current neurology and neuroscience reports. 12 (5): 592–600. PMID 22782520.
- Freedman MS (2011). "Long-term follow-up of clinical trials of multiple sclerosis therapies". Neurology. 76 (1 Suppl 1): S26–34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679.
- Qizilbash N, Mendez I, Sanchez-de la Rosa R (2012). "Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis". Clin Ther. 34 (1): 159–176.e5. doi:10.1016/j.clinthera.2011.12.006. PMID 22284996.
- Hassan-Smith G, Douglas MR (November 2011). "Management and prognosis of multiple sclerosis". British journal of hospital medicine (London, England : 2005). 72 (11): M174–6. PMID 22082979.
- Bates D (2011). "Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials". Neurology. 76 (1 Suppl 1): S14–25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678.
- Johnston J, So TY (2012). "First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview". Drugs. 72 (9): 1195–211. doi:10.2165/11634010-000000000-00000. PMID 22642799.
- Killestein J, Rudick RA, Polman CH (2011). "Oral treatment for multiple sclerosis". Lancet Neurol. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
- Kellerman, Rick D.; Edward N. Hanley Jr MD (2011). Conn's Current Therapy 2012: Expert Consult - Online and Print. Philadelphia: Saunders. صفحة 627. . مؤرشف من الأصل في 22 أكتوبر 2014.
- Martinelli Boneschi, F (2013 May 31). "Mitoxantrone for multiple sclerosis". Cochrane database of systematic reviews (Online). 5: CD002127. PMID 23728638.
- Marriott, JJ (2010 May 4). "Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology". Neurology. 74 (18): 1463–70. PMID 20439849.
- Balak, DM (2012 Dec). "Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review". Multiple sclerosis (Houndmills, Basingstoke, England). 18 (12): 1705–17. PMID 22371220.
- Sládková T, Kostolanský F (2006). "The role of cytokines in the immune response to influenza A virus infection". Acta Virol. 50 (3): 151–62. PMID 17131933.
- Munari L, Lovati R, Boiko A (2004). Munari, Luca M. (المحرر). "Therapy with glatiramer acetate for multiple sclerosis". Cochrane database of systematic reviews (Online) (1): CD004678. doi:10.1002/14651858.CD004678. PMID 14974077.
- Tremlett H, Oger J (2004). "Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis". J. Neurol. 251 (11): 1297–303. doi:10.1007/s00415-004-0619-5. PMID 15592724.
- Comi G (2009). "Treatment of multiple sclerosis: role of natalizumab". Neurol. Sci. Suppl 2 (S2): S155–8. doi:10.1007/s10072-009-0147-2. PMID 19882365.
- Hunt, D (2012 Feb). "Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring". Practical neurology. 12 (1): 25–35. PMID 22258169.
- Killestein J, Rudick RA, Polman CH (2011). "Oral treatment for multiple sclerosis". Lancet Neurol. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
- "NDA 204063 - FDA Approved Labeling Text" ( كتاب إلكتروني PDF ). US Food and Drug Agency. 27 March 2013. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 25 فبراير 201705 أبريل 2013.
"NDA Approval" ( كتاب إلكتروني PDF ). 27 March 2013. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 12 فبراير 20175 Apr. - Kesselring J, Beer S (October 2005). "Symptomatic therapy and neurorehabilitation in multiple sclerosis". Lancet Neurol. 4 (10): 643–52. doi:10.1016/S1474-4422(05)70193-9. PMID 16168933.
- Khan F, Turner-Stokes L, Ng L, Kilpatrick T (2007). Khan F (المحرر). "Multidisciplinary rehabilitation for adults with multiple sclerosis". Cochrane Database Syst Rev (2): CD006036. doi:10.1002/14651858.CD006036.pub2. PMID 17443610.
- Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (2005). "Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews". Clinical rehabilitation. 19 (3): 247–54. doi:10.1191/0269215505cr870oa. PMID 15859525.
- Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (2003). Steultjens EE (المحرر). "Occupational therapy for multiple sclerosis". Cochrane database of systematic reviews (Online) (3): CD003608. doi:10.1002/14651858.CD003608. PMID 12917976.
- Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A (2007). "Physical training and multiple sclerosis". Ann Readapt Med Phys. 50 (6): 373–6, 369–72. doi:10.1016/j.annrmp.2007.04.004. PMID 17482708.
- Rietberg MB, Brooks D, Uitdehaag BM, Kwakkel G (2005). Kwakkel G (المحرر). "Exercise therapy for multiple sclerosis". Cochrane Database of Systematic Reviews (1): CD003980. doi:10.1002/14651858.CD003980.pub2. PMID 15674920.
- Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (2006). Thomas PW (المحرر). "Psychological interventions for multiple sclerosis". Cochrane Database of Systematic Reviews (1): CD004431. doi:10.1002/14651858.CD004431.pub2. PMID 16437487.
- Huntley A (January 2006). "A review of the evidence for efficacy of complementary and alternative medicines in MS". Int MS J. 13 (1): 5–12, 4. PMID 16420779.
- Olsen SA (2009). "A review of complementary and alternative medicine (CAM) by people with multiple sclerosis". Occup Ther Int. 16 (1): 57–70. doi:10.1002/oti.266. PMID 19222053.
- Farinotti, M; Vacchi, L; Simi, S; Di Pietrantonj, C; Brait, L; Filippini, G (12 December 2012). "Dietary interventions for multiple sclerosis". The Cochrane database of systematic reviews. 12: CD004192. doi:10.1002/14651858.CD004192.pub3. PMID 23235605.
- Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (September 2011). "N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis". J Biol Chem. 286 (46): 40133–41. doi:10.1074/jbc.M111.277814. PMC . PMID 21965673.
- Pozuelo-Moyano B, Benito-León J, Mitchell AJ, Hernández-Gallego J (2013). "A systematic review of randomized, double-blind, placebo-controlled trials examining the clinical efficacy of vitamin D in multiple sclerosis". Neuroepidemiology (Systematic review). 40 (3): 147–53. doi:10.1159/000345122. PMC . PMID 23257784.
the available evidence substantiates neither clinically significant benefit nor harm from vitamin D in the treatment of patients with MS
- Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (2006). "Cannabis use in patients with multiple sclerosis". Mult. Scler. 12 (5): 646–51. doi:10.1177/1352458506070947. PMID 17086912.
- Bennett M, Heard R (2004). Bennett, Michael H (المحرر). "Hyperbaric oxygen therapy for multiple sclerosis". Cochrane database of systematic reviews (Online) (1): CD003057. doi:10.1002/14651858.CD003057.pub2. PMID 14974004.
- Adams, Tim (23 May 2010). "Gut instinct: the miracle of the parasitic hookworm". The Observer. مؤرشف من الأصل في 24 يونيو 2013.
- Phadke JG (May 1987). "Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland". J. Neurol. Neurosurg. Psychiatr. 50 (5): 523–31. doi:10.1136/jnnp.50.5.523. PMC . PMID 3495637.
- Myhr KM, Riise T, Vedeler C, Nortvedt MW, Grønning R, Midgard R, Nyland HI (February 2001). "Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension". Mult. Scler. 7 (1): 59–65. doi:10.1177/135245850100700110. PMID 11321195.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY (15 December 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- Compston A (October 1988). "The 150th anniversary of the first depiction of the lesions of multiple sclerosis". J. Neurol. Neurosurg. Psychiatr. 51 (10): 1249–52. doi:10.1136/jnnp.51.10.1249. PMC . PMID 3066846.
- Lassmann H (October 1999). "The pathology of multiple sclerosis and its evolution". Philosophical Transactions of the Royal Society B. 354 (1390): 1635–40. doi:10.1098/rstb.1999.0508. PMC . PMID 10603616.
- Lassmann H (July 2005). "Multiple sclerosis pathology: evolution of pathogenetic concepts". Brain Pathology. 15 (3): 217–22. doi:10.1111/j.1750-3639.2005.tb00523.x. PMID 16196388.
- R. Milo, A. Miller, Revised diagnostic criteria of multiple sclerosis, Autoimmunity Reviews 13 (2014), 12 January 2014, 518-524
- Cohen JA (July 2009). "Emerging therapies for relapsing multiple sclerosis". Arch. Neurol. 66 (7): 821–8. doi:10.1001/archneurol.2009.104. PMID 19597083.
- Miller AE (2011). "Multiple sclerosis: where will we be in 2020?". Mt. Sinai J. Med. 78 (2): 268–79. doi:10.1002/msj.20242. PMID 21425270.
- Jeffrey, susan (9 August 2012). "CONCERTO: A Third Phase 3 Trial for Laquinimod in MS". Medscape Medical News. مؤرشف من الأصل في 23 أغسطس 201621 مايو 2013.
- Kieseier BC, Calabresi PA (March 2012). "PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis". CNS Drugs. 26 (3): 205–14. doi:10.2165/11596970-000000000-00000. PMID 22201341.
- "Biogen Idec Announces Positive Top-Line Results from Phase 3 Study of Peginterferon Beta-1a in Multiple Sclerosis" (Press release). Biogen Idec. 24 January 2013. مؤرشف من الأصل في 1 نوفمبر 201321 مايو 2013.
- Saidha S, Eckstein C, Calabresi PA (January 2012). "New and emerging disease modifying therapies for multiple sclerosis". Annals of the New York Academy of Sciences. 1247: 117–37. doi:10.1111/j.1749-6632.2011.06272.x. PMID 22224673.
- Milo R, Panitch H (February 2011). "Combination therapy in multiple sclerosis". J. Neuroimmunol. 231 (1–2): 23–31. doi:10.1016/j.jneuroim.2010.10.021. PMID 21111490.
- Luessi F, Siffrin V, Zipp F (September 2012). "Neurodegeneration in multiple sclerosis: novel treatment strategies". Expert Rev Neurother. 12 (9): 1061–76, quiz 1077. doi:10.1586/ern.12.59. PMID 23039386. مؤرشف من الأصل في 08 أبريل 2020.
- Mehta V, Pei W, Yang G, Li S, Swamy E, Boster A, Schmalbrock P, Pitt D (2013). "Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions". PLoS ONE. 8 (3): e57573. doi:10.1371/journal.pone.0057573. PMC . PMID 23516409.
- Harris VK, Sadiq SA (2009). "Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making". Mol Diagn Ther. 13 (4): 225–44. doi:10.1007/BF03256329. PMID 19712003.
- Zamboni P, Galeotti R, Menegatti E, Malagoni AM, Tacconi G, Dall'Ara S, Bartolomei I, Salvi F (April 2009). "Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis". J. Neurol. Neurosurg. Psychiatr. 80 (4): 392–9. doi:10.1136/jnnp.2008.157164. PMC . PMID 19060024. مؤرشف من الأصل في 4 أغسطس 2009.
- Pullman D, Zarzeczny A, Picard A (2013). "Media, politics and science policy: MS and evidence from the CCSVI Trenches". BMC Med Ethics. 14: 6. doi:10.1186/1472-6939-14-6. PMC . PMID 23402260.
- Qiu J (May 2010). "Venous abnormalities and multiple sclerosis: another breakthrough claim?". Lancet Neurol. 9 (5): 464–5. doi:10.1016/S1474-4422(10)70098-3. PMID 20398855.
- Ghezzi A, Comi G, Federico A (February 2011). "Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis". Neurol. Sci. 32 (1): 17–21. doi:10.1007/s10072-010-0458-3. PMID 21161309.
- Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW (October 2010). "Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis". J NeuroIntervent Surg. 2 (4): 309–311. doi:10.1136/jnis.2010.003947. PMID 21990639.
- Baracchini C, Atzori M, Gallo P (March 2013). "CCSVI and MS: no meaning, no fact". Neurol. Sci. 34 (3): 269–79. doi:10.1007/s10072-012-1101-2. PMID 22569567.
- van Zuuren EJ, Fedorowicz Z, Pucci E, Jagannath VA, Robak EW (12 December 2012). "Percutaneous transluminal angioplasty for treatment of chronic cerebrospinal venous insufficiency (CCSVI) in multiple sclerosis patients". Cochrane database of systematic reviews (Online). 12: CD009903. doi:10.1002/14651858.CD009903.pub2. PMID 23235683.