مرض الانسداد الرئوي المزمن (مرض إ. ر. م.) [2][3][4] أو مرض الرئة الانسدادي المزمن[3] (يرمز له بالاختصار COPD من Chronic Obstructive Pulmonary Disease) أو كما يعرفه المعجم الطبي الموحد باسم "الدَّاءُ الرِّئَوِيُّ المُسِدُّ المُزْمِن" أو قد يسمى "مرض انسداد مجرى الهواء المزمن" هو مرض مزمن يتميز بانسداد الشعب الهوائية وقلة تدفق الهواء بشكل مزمن وقصور في وظائف الرئة. ويتفاقم هذا القصور تدريجياً وهو غير قابل للرجوع كلياً بواسطة الأدوية الموسعة للشعب الهوائية.[5]. ويعد التدخين السبب الرئيس لهذا المرض الذي يصيب ما بين 10-20% من الذين تجاوزوا الـ 40 عام كما يتسبب بحوالي 2.5 مليون وفاة سنوياً[6] وتشمل أعراض المرض الرئيسية ضيق في التنفس والسعال وإفراز البلغم.[7] ويشار إلى أن معظم المصابين بالالتهاب الشعبي يصابون بمرض الانسداد الرئوي المزمن.
| داء الانسداد الرئوي المزمن | |
|---|---|
| معلومات عامة | |
| الاختصاص | طب الرئة |
| من أنواع | مرض الرئة الانسدادي |
| الأسباب | |
| الأسباب | تدخين، وغبار |
| عوامل الخطر | تدخين[1] |
| الإدارة | |
| أدوية | |
يندرج تحت هذا المرض حالتان هما: الالتهاب الشعبي المزمن (chronic bronchitis) وهو وجود كحة وبلغم لمدة ثلاثة أشهر في سنتين متتاليتين والنفاخ الرئوي emphysema وهو تشخيصٌ تشريحيّ يصف تغيّر بُنية الرئتين من توسع الشعيبات الهوائية وتلف جُدر الحويصلات الهوائية.
يعتبر تدخين التبغ المسبب الأكثر شيوعاً لمرض الانسداد الرئوي المزمن، بالإضافة إلى عدد من العوامل الأخرى مثل تلوث الهواء والوراثة التي تلعب دوراً أصغر.[8] في العالم النامي، ثمة عوامل أخرى مسببة للمرض كلهب وسائل الطبخ والتدفئة سيئة التهوية، فهو من المصادر الشائعة لتلوث الهواء. التعرض الطويل المدى لهذه المهيجات يسبب استجابة التهابية في الرئتين ما يؤدي إلى ضيق في الممرات الهوائية الصغيرة وتحلل أنسجة الرئة ويعرف هذا باسم النفاخ الرئوي .[9] ويستند التشخيص على ضعف تدفق الهواء والذي يقاس بواسطة اختبار وظيفة الرئة.[10] وعلى النقيض من الربو، نجد أن نقص تدفق الهواء لا يتحسن بشكل ملحوظ مع استخدام الموسعات القصبية.[11][12]
يمكن الوقاية من مرض الانسداد الرئوي المزمن عن طريق الحد من التعرض للأسباب المعروفة. وهذا يشمل بذل الجهد لخفض معدلات التدخين وتحسين نوعية الهواء في الأماكن المغلقة والمفتوحة. تشمل علاجات مرض الانسداد الرئوي المزمن: الإقلاع عن التدخين، التطعيم، إعادة التأهيل الرئوي، واستعمال موسع قصبي والستيرويدات عن طريق الاستنشاق. قد يستفيد بعض الناس من العلاج بالأوكسجين طويل الأجل أو زراعة الرئة.[9] أما عند المرضى الذين يعانون من تدهور حاد وتفاقم في المرض، قد تكون هناك حاجة إلى زيادة استخدام الأدوية ودخول المستشفى.
في جميع أنحاء العالم، يؤثر مرض الانسداد الرئوي المزمن على 329 مليون نسمة أو ما يقرب من 5% من إجمالي عدد السكان. عام 2012، كان احتل هذا المرض المرتبة الثالثة في قائمة الأسباب الرئيسية للوفيات، مسبباً وفاة أكثر من 3 ملايين نسمة.[13] ومن المتوقع أن يزداد عدد الوفيات بسبب ارتفاع معدلات التدخين وارتفاع معدلات شيخوخة السكان في العديد من البلدان.[14] ونتج عنه تكلفة اقتصادية قدرت بقيمة 2.1 تريليون دولار عام 2010.[15]
الأعراض
الأعراض الأكثر شيوعاً لمرض الانسداد الرئوي المزمن هي إفراز البلغم، ضيق التنفس والسعال.[16] وتستمر هذه الأعراض لفترة طويلة من الزمن [17] وعادة ما تزداد سوءاً مع مرور الزمن.[9] ومن غير الواضح ما إذا كانت هناك أنواع مختلفة من مرض الانسداد الرئوي المزمن.[8] في حين كانت تقسم سابقاً إلى النفاخ الرئوي والتهاب القصبات المزمن، فإن النفاخ الرئوي هو وصف لتغيرات الرئة فقط وليس مرضاً بذاته، والالتهاب الشعبي المزمن هو مجرد وصف للأعراض التي قد تحدث أو قد لا تحدث مع مرض الانسداد الرئوي المزمن.[7]
السعال
السعال المزمن يكون عادةً أول أعراض المرض. وعندما يستمر لأكثر من ثلاثة أشهر في السنة لأكثر من سنتين، ويصاحبه إفراز للبلغم بدون وجود تفسير آخر، فإن ذلك ما يعرف بالتهاب الشعب الهوائية المزمن. ويمكن أن تحدث هذه الحالة قبل أن يتطور مرض الانسداد الرئوي المزمن بشكل كامل. يمكن لكمية البلغم المنتجة أن تتغير بين الساعات والأيام. في بعض الحالات قد لا يكون السعال موجوداً أو يحدث فقط من وقت لآخر وقد لا يكون مصحوباً ببلغم. ينسب بعض الناس المصابين بمرض الانسداد الرئوي المزمن الأعراض إلى "سعال المدخن". وقد يتم ابتلاع البلغم أو بصقه، وهذا يتوقف غالباً على العوامل الاجتماعية والثقافية. قد يؤدي السعال القوي إلى كسور في الأضلاع أو فقدان وجيز للوعي. وغالباً ما يكون لدى المصابين بمرض الانسداد الرئوي المزمن تاريخ من "نزلات البرد" التي تستمر لفترة طويلة.[16]
ضيق في التنفس
ضيق التنفس هو العَرَض الذي غالباً ما يزعج الناس أكثر من غيره.[18] ومن الشائع وصفه بأنه "تنفس يتطلب جهداً"، ويصفه المصاب بـ "أشعر أن نَفَسي مقطوع" أو "لا أستطيع الحصول على ما يكفي من الهواء".[19] وعلى أي حال، قد تستعمل مصطلحات مختلفة في الثقافات المختلفة.[16] عادةً ما يسوء ضيق التنفس عند الإجهاد، ويستمر لفترات طويلة، ويتفاقم مع مرور الوقت.[16] وفي المراحل المتقدمة، يحدث ضيق التنفس أثناء الراحة وربما يكون موجوداً باستمرار.[20][21] يتسبب ضيق التنفس بالقلق وسوء نوعية الحياة للمصابين بمرض الانسداد الرئوي المزمن.[16] وترى كثيراً من الناس الذين يعانون من مرض الانسداد الرئوي المزمن المتقدم يتنفسون بزمّ الشفاه، وهذه الطريقة في التنفس قد تخفف من حدة ضيق التنفس لدى البعض.[22][23]
علامات أخرى
في مرض الانسداد الرئوي المزمن، قد يستغرق الزفير وقتاً أطول من الشهيق.[24] قد يحدث ضيق في الصدر [16] ولكن هذا ليس شائعاً ويمكن أن يكون ناجماً عن مشكلة أخرى.[18] أما الذين يعانون من صعوبة في تدفق الهواء فقد يكون لديهم صفير أو أصوات منخفضة مع دخول الهواء عند فحص الصدر باستخدام سماعة الطبيب.[24] يعتبر الصدر البرميلي علامة مميزة لمرض الانسداد الرئوي المزمن، ولكنه غير شائع نسبياً.[24]
يؤدي مرض الانسداد الرئوي المزمن المتقدم إلى ارتفاع ضغط شرايين الرئة، والذي يجهد البطين الأيمن للقلب.[9][25][26] ويشار إلى هذه الحالة باسم القلب الرئوي، وتؤدي إلى أعراض تورم الساق [16] وانتفاخ أوردة الرقبة.[9] ومرض الانسداد الرئوي المزمن هو أكثر الأمراض الرئوية المسببة لمرض القلب الرئوي شيوعاً[25]، لكن مرض القلب الرئوي أصبح أقل شيوعاً بسبب استخدام الأكسجين الإضافي.[17]
غالباً ما يحدث مرض الانسداد الرئوي المزمن مصاحباً لعدد من الحالات الأخرى، ويرجع ذلك جزئياً إلى عوامل الخطر المشتركة.[8] وتشمل هذه الحالات: مرض القلب لنقص التروية، ضغط الدم المرتفع، السكري، هزال العضلات، هشاشة العظام، سرطان الرئة، اضطراب القلق والاضطراب الاكتئابي الشديد.[8] يعتبر الشعور الدائم بالتعب أمراً شائعاً عند الذين يعانون من مرض شديد.[16] أما تعجر أظافر الأصابع فهو غير خاص بمرض الانسداد الرئوي المزمن ويجب إجراء فحوصات عاجلة لسرطان الرئة الأولي.[27]
تفاقم المرض
تعرّف الحالة الحادة عند الشخص المصاب بمرض الانسداد الرئوي المزمن بأنها زيادة ضيق التنفس، وزيادة إفراز البلغم، وتغير في لون البلغم من صافٍ إلى اللون الأخضر أو الأصفر، أو زيادة السعال.[24] وقد يوجد هذا مع علامات بزيادة عملية التنفس مثل التنفس السريع، سرعة معدل دقات القلب، التعرق الغزير، والاستخدام المستمر للعضلات في الرقبة، لون أزرق خفيف على الجلد، والتشوش أو السلوك العدواني أثناء السورات الحادة جداً للمرض.[24][28] وقد تسمع خشخشة أيضاً في الرئتين عند الفحص بسماعة الطبيب.[29]
المسببات
السبب الرئيسي لمرض الانسداد الرئوي المزمن هو التدخين، بما في ذلك تدخين السجائر والأرجيلة والسيجار، بالإضافة إلى التعرض المزمن للغبار الصناعي والمواد الكيماوية ومشتقاتها بالنسبة للأشخاص العاملين في الصناعات التي تتعامل مع هذه المواد (التعرض المهني) والتلوث داخل البيوت الناتج عن طريق إيقاد النار بدون وجود تهوية كافية وهو أحد أسباب الإصابة عند النساء خصوصاً في الدول النامية.[7] وعادةً يجب أن يحدث هذا التعرض على مدى عدة عقود قبل ظهور الأعراض.[7] ويؤثر أيضاً التركيب الوراثي للشخص في خطورة المرض.[7]
التدخين


إن عامل الخطر الرئيسي لمرض الانسداد الرئوي المزمن على مستوى العالم هو تدخين التبغ.[7] ويقدّر أن حوالي 20% من المدخنين يصابون بمرض الانسداد الرئوي المزمن،[31] وسوف يصاب حوالي نصف أولئك الذين يدخنون مدى الحياة بمرض الانسداد الرئوي المزمن.[32] في الولايات المتحدة والمملكة المتحدة، يقدّر أن 80-90% من المصابين بمرض الانسداد الرئوي المزمن هم إما مدخنون حاليون أو مدخنون سابقون.[31][33][34] كما أن احتمال تطور مرض الانسداد الرئوي المزمن يزيد مع التقدم في العمر (أي مع تراكم التعرض للدخان).[35] بالإضافة إلى ذلك، فإن النساء أكثر عرضة للآثار الضارّة للدخان من الرجال.[34] عند غير المدخنين، يتسبب التدخين السلبي في نحو 20% من الحالات.[33] كما تمثل أنواع التدخين الأخرى خطورة كتدخين الماريوانا، والسيجار، والنارجيلة (الشيشة).[7] بالنسبة للنساء اللواتي يدخنّ خلال فترة الحمل فقد يزدن من إمكانية إصابة الجنين بمرض الانسداد الرئوي المزمن.[7]
تلوث الهواء
إيقاد نار الطهي بدون وجود تهوية كافية، والتي غالباً ما تستخدم الفحم أو الوقود الحيوي مثل الخشب وروث الحيوانات، يؤدي إلى تلوث الهواء في الأماكن المغلقة. ويعد هذا أحد أكثر الأسباب شيوعاً لمرض الانسداد الرئوي المزمن في البلدان النامية.[36] لكن تحضير النار بهذه الطريقة أمر أساسي للطهي والتدفئة لقرابة 3 مليار شخص وتظهر تأثيراتها الصحية بين النساء أكثر ما يكون بسبب كثرة تعرضهن لها.[7][36] ويتم استخدامها كمصدر رئيسٍ للطاقة في 80% من المنازل في الهند والصين والدول الأفريقية جنوب الصحراء.[37]
معدل إصابة سكان المدن الكبيرة بمرض الانسداد الرئوي المزمن أكبر منه لدى الأشخاص الذين يعيشون في المناطق الريفية.[38] ففي حين يعتبر تلوث الهواء في المناطق الحضرية عاملاً مساهماً في تفاقم المرض، إلا أن دوره بشكل عام كسبب لمرض الانسداد الرئوي المزمن غير واضح.[7] ففي المناطق ذات نوعية الهواء الطلق الرديء، الذي يحتوي على غازات العادم، نجد فيها معدلات أعلى من هذا المرض بشكل عام.[37] وعلى أي حال يُعتقد أن التأثير العام المتعلق بالتدخين قليل.[7]
التعرض المهني
التعرض الكثيف في مكان العمل للغبار والمواد الكيميائية والأبخرة ولمدة طويلة يزيد من خطر مرض الانسداد الرئوي المزمن لدى كل من المدخنين وغير المدخنين.[39] ويُعتقد أن التعرض في مكان العمل يتسبب في 10-20% من الحالات.[40] في الولايات المتحدة يعتقدون أنها مرتبطة بأكثر من 30% من الحالات بين الأشخاص الذين لم يدخنوا قط، وربما تمثل خطراً أكبر في البلدان التي لا يوجد لديها لوائح تنظيمية كافية.[7]
من الصناعات والمصادر المسببة للمرض ما يلي:[37] المستويات العالية من الغبار في مناجم الفحم، ومناجم الذهب، وصناعات المنسوجات القطنية والمهن التي تستخدم الكادميوم والأيزوسيانيت، والأبخرة الناتجة عن اللحام.[39] العمل في الزراعة هو أيضاً خطر.[37] في بعض المهن، تم تقدير المخاطر بما يعادل تدخين من نصف علبة إلى علبتين من السجائر يومياً.[41] قد يؤدي التعرض لغبار السليكا أيضاً إلى مرض الانسداد الرئوي المزمن، مع خطر غير مرتبط بمرض السحار السيليسي.[42] تتضح الآثار السلبية للتعرض للغبار ودخان السجائر كعبء مضاف أو ربما أكثر من عبء مضاف.[41]
الوراثة
تلعب الوراثة دوراً في تطور مرض الانسداد الرئوي المزمن.[7] فهو أكثر شيوعاً بين أقارب المصابين بمرض الانسداد الرئوي المزمن الذين يدخنون مقارنة بالمدخنين غير الأقارب.[7] حالياً، عامل الخطر الوحيد الذي يورث بوضوح هو عوز ألفا1 أنتيتريبسين (AAT).[43] ويكون هذا الخطر مرتفعاً خاصةً إذا كان الشخص الذي يعاني من نقص عوز ألفا1 أنتيتريبسين يدخن أيضاً.[43] وهو مسؤول عن حوالي 1-5% من الحالات [43][44] والحالة موجودة لدى حوالي 3-4 أشخاص بين كل 10,000 شخص.[17] وهناك عوامل وراثية أخرى يجري التحقق منها، [43] والتي من المرجح أن تكون كثيرة.[37]
عوامل أخرى
ثمة عدد من العوامل الأخرى الأقل ارتباطاً بمرض الانسداد الرئوي المزمن. والخطر أكبر بين الفقراء، على الرغم من أنه ليس من الواضح إذا كان مرجع ذلك إلى الفقر بحد ذاته أو إلى عوامل الخطر الأخرى المرتبطة بالفقر، كتلوث الهواء وسوء التغذية.[7] هناك دليل ضعيف على أن الذين يعانون من الربو وفرط استجابة مجرى الهواء أكثر عرضة لخطر الإصابة بمرض الانسداد الرئوي المزمن.[7] عوامل الولادة مثل انخفاض الوزن عند الولادة قد تلعب دوراً أيضاً فضلاً عن تسببها بعدد من الأمراض المعدية التي تتضمن الإيدز والسل.[7] لا يبدو أن حالات العدوى في الجهاز التنفسي مثل ذات الرئة تزيد من خطر مرض الانسداد الرئوي المزمن، على الأقل بين البالغين.[17]
تفاقم المرض
تحدث نوبة تفاقم حادة (تدهور مفاجئ للأعراض)[45] عادةً عن طريق العدوى أو الملوثات البيئية، أو في بعض الأحيان بسبب عوامل أخرى مثل الاستخدام غير السليم للأدوية.[46] ويبدو أن العدوى هي السبب في 50 إلى 75 % من الحالات،[46][47] حيث تسبب البكتيريا 25% منها، والفيروسات 25%، وكلاهما في 25%.[48] وتشمل الملوثات البيئية نوعية الهواء السيئة في كل من الأماكن المغلقة والمفتوحة.[46] التعرض للتدخين الشخصي والتدخين السلبي يزيد من الخطر.[37] كما قد تلعب درجات الحرارة المنخفضة دوراً أيضاً إذ تزداد النوبات عادةً في فصل الشتاء.[49] ويصاب الذين يعانون من مرض كامن أكثر شدة بنوبات أكثر تكراراً: في المرض الخفيف 1.8 مرة في السنة، والمعتدل 2 إلى 3 مرات في السنة، والشديد 3.4 مرة في السنة.[50] ويعاني الذين يصابون بنوبات كثيرة من تدهور وظائف الرئة بمعدل أسرع.[51] يمكن أن يؤدي الانصمام الرئوي (تجلط الدم في الرئتين) إلى تفاقم الأعراض عند المصابين بمرض الانسداد الرئوي المزمن.[8]
فسيولوجيا المرض

مرض الانسداد الرئوي المزمن هو نوع من أمراض الرئة السادّة حيث يكون هناك نقص مزمن قابل للتراجع غير الكامل في تدفق الهواء (تدفق محدود للهواء) مع عدم القدرة على إخراج هواء الزفير بشكل كامل (احتباس الهواء).[8] يحدث ضعف تدفق الهواء نتيجة لتلف نسيج الرئة (معروف باسم النفاخ الرئوي) ومرض الشعب الهوائية الصغيرة المعروف باسم التهاب الشعيبات الهوائية الانسدادي. وتتفاوت التأثيرات النسبية لهذين العاملين بين الأشخاص.[7] ويمكن أن يؤدي التلف الشديد في الشعب الهوائية الصغيرة إلى تكوين جيوب هوائية كبيرة—تعرف باسم الفقاعات—التي تحل محل نسيج الرئة. ويسمى هذا الشكل من المرض بنفاخ الرئة الفقاعي.[52]

تلف الرئة
ينشأ مرض الانسداد الرئوي المزمن كتفاعل التهابي قوي ومزمن للمثيرات المستنشقة.[7] وقد تضاف أيضاً العدوى البكتيرية المزمنة إلى هذه الحالة الالتهابية.[51] وتشمل الخلايا الالتهابية المعنية الخلايا الأكولة الكبيرة والخلايا المتعادلة، وهما نوعان من خلايا الدم البيضاء. وتوجد لدى المدخنين خلايا Tc1 المسممة للخلايا، في حين نجد الخلايا الحمضية لدى بعض الأشخاص المصابين بمرض الانسداد الرئوي المزمن كما توجد لدى المصابين بالربو.
تضيق مجرى الهواء
تضيق الشعب الهوائية بسبب حدوث التهاب وندوب داخلها. وهذا يساهم في عدم القدرة على إخراج الزفير بشكل كامل. يحدث الانخفاض الأكبر في تدفق الهواء عند الزفير، لآن الضغط داخل الصدر يكون على الشعب الهوائية في هذا الوقت.[53] هذا يمكن أن يؤدي إلى بقاء المزيد من الهواء من النفس السابق داخل الرئتين عند بدء النفس التالي، مما يؤدي إلى زيادة كمية الهواء في الرئتين في أي وقت معطى، وهي عملية تسمى زيادة التضخم أو احتباس الهواء.[53][54]
المرحلة النهائية
يمكن أن يحدث انخفاض مستويات الأكسجين في الدم وبالتالي يحدث فرط ثاني أكسيد الكربون في الدم بسبب سوء تبادل الغازات الناتج عن انخفاض التهوية نتيجة انسداد الشعب الهوائية، وزيادة التضخم وانخفاض الرغبة في التنفس.[7] أثناء نوبات تفاقم المرض، يزداد التهاب الشعب الهوائية أيضاً، مما يؤدي إلى زيادة التضخم، وانخفاض تدفق هواء الزفير وسوء نقل الغازات. وهذا يمكن أن يؤدي أيضاً إلى قلة التهوية وأخيراً، انخفاض مستويات الأكسجين في الدم.[9] يمكن لانخفاض مستويات الأكسجين، إذا كان موجوداً لفترة طويلة، أن يؤدي إلى ضيق الشرايين في الرئتين، في حين يؤدي النفاخ الرئوي إلى تلف الشعيرات الدموية في الرئتين. كل واحدة من هذه التغييرات تؤدي إلى زيادة ضغط الدم في الشرايين الرئوية، والتي قد تسبب مرض القلب الرئوي.[7]
التشخيص
يجب أن يؤخذ تشخيص مرض الانسداد الرئوي المزمن في الاعتبار عند أي شخص فوق سن 35 -40 يعاني من ضيق في التنفس وسعال مزمن وإفراز بلغم، أو نزلات برد متكررة في فصل الشتاء وتاريخ من التعرض لعوامل الخطر لهذا المرض.[16][18] ويستخدم قياس التنفس بعد ذلك لتأكيد التشخيص.[16][55]
قياس التنفس
يقيس جهاز قياس التنفس كمية إعاقة تدفق الهواء الموجود، ويتم عادةً بعد استخدام موسع للشعب، وهو دواء لتوسيع الشعب الهوائية.[55] يتم قياس مكونين رئيسيين لإجراء التشخيص: حجم الزفير القسري في ثانية واحدة (FEV1)، وهو أكبر حجم من الهواء الذي يمكن إخراجه في الثانية الأولى من التنفس، والسعة الحيوية القسرية (FVC)، وهو أكبر حجم من الهواء يمكن إخراجه في زفير واحد كبير.[56] عادةً، يخرج 75-80% من السعة الحيوية القسرية في الثانية الأولى [56] وإذا كان حجم الزفير القسري1 /نسبة السعة الحيوية القسرية1/نسبة السعة الحيوية القسرية أقل من 70% لدى شخص لديه أعراض مرض الانسداد الرئوي المزمن فإنه يحدد إصابة هذا الشخص بالمرض.[55] وبناء على هذه القياسات، فإن قياس التنفس يؤدي إلى تشخيص أفضل لمرض الانسداد الرئوي المزمن لدى كبار السن.[55] تتطلب معايير المعهد الوطني لامتياز الرعاية الصحية والسريرية بشكل إضافي أن يكون حجم الزفير القسري FEV1 أقل من 80% من المتوقع.[18]
إن إجراء قياس التنفس بين الأفراد الذين لا أعراض لديهم في محاولة تشخيص مبكر للحالة له تأثير غير مؤكد وبالتالي لا ينصح به حالياً.[16][55] إن اختبار "ذروة تدفق الزفير" (السرعة القصوى للزفير)، المألوف استخدامه لدى مرضى الربو، لا يكفي لتشخيص مرض الانسداد الرئوي المزمن.[18]
يقسم التشخيص تبعاً لذلك إلى أربع مراحل:
- المرحلة البدائية FEV1/FVC <70%; FEV≥ 80% في هذه الحالة لا يشعر المريض بخلل وظيفي لرئتي
- المرحلة المتوسطة FEV1/FVC <70%; 50% ≤ FEV1<80% في هذه المرحلة يطرق المريض باب الطبيب نتيجة لبدء الأعراض المزمنة أو تفاقم المرض نتيجة عدوى
- المرحلة الخطرة FEV/FVC <70%; 30% ≤ FEV<50% المريض يعاني من قصر التنفس ونقص القدرة البدنية وتكرار حدوث التفاقم المرضي مما يؤثر بشكل أساسي على نوعية الحياة اليومية
- المرحلة الخطرة جدا FEV/FVC <70%; FEV<30% في هذه المرحلة تتدنى جودة الحياة والتفاقم المرضي قد يكون مهددا للحياة.
| الفرق | مرض إ. ر. م | الربو |
|---|---|---|
| بداية المرض | في منتصف العمر | مبكرا كثيرًا عادة منذ الطفولة |
| تطور المرض | تدريجيا | عادة بسرعة |
| ضيق التنفس | عند الإجهاد | فجائي |
| تبادل الغازات | منخفض | طبيعي |
| تفاقم المرض | عادة عن طريق العدوى | مثيرات الحساسية |
| قصر تدفق الهواء | قابل للرجوع بشكل جزئي | قابل للرجوع للحالة الطبيعية |
هناك عدد من الطرق لتحديد مدى تأثير مرض الانسداد الرئوي المزمن على شخص معين.[16] الاستبيان المعدل الصادر عن "مجلس البحوث الطبية" في المملكة المتحدة (mMRC) أو اختبار تقييم مرض الانسداد الرئوي المزمن (CAT) هي استبيانات بسيطة يمكن استخدامها لتحديد شدة الأعراض.[16] تتراوح النقاط في اختبار تقييم مرض الانسداد الرئوي المزمن (CAT) بين 40-0 نقطة حيث تعني الدرجة الأعلى أن المرض أكثر شدة.[57] يساعد قياس التنفس على تحديد شدة عجز تدفق الهواء.[16] وعادةً ما يعتمد هذا على حجم الزفير القسري 1 كنسبة مئوية للنتيجة المتوقعة "الطبيعية" وفقاً لعمر الشخص، وجنسه، وطوله ووزنه.[16] وقد نصحت كل من الإرشادات الأمريكية والأوروبية بالاعتماد جزئياً على توصيات العلاج عن طريق قياس حجم الزفير القسري1.[55] وتقترح إرشادات غولد (المبادرة العالمية لمرض الانسداد الرئوي المزمن) تقسيم الناس إلى أربع فئات استناداً إلى تقييم الأعراض ومحدودية تدفق الهواء.[16] كما يجب وضع نقص الوزن وضعف العضلات، وكذلك وجود أمراض أخرى، في الاعتبار.[16]
اختبارات أخرى
قد يفيد تصوير الصدر بالأشعة السينية والعد الدموي الشامل في استبعاد أسباب أخرى في وقت التشخيص.[58] والسمات المميزة للأشعة السينية هي التمدد الشديد للرئتين، وانبساط الحجاب الحاجز، وزيادة حيز الهواء خلف القص، والأمراض الجلدية، في حين أنها قد تساعد في استبعاد أمراض الرئة الأخرى مثل ذات الرئة ووذمة الرئة أو الاسترواح الصدري.[59] يمكن لصورة الصدر عالية الوضوح باستخدام التصوير المقطعي المحوسب بالأشعة السينية أن تبين توزيع النفاخ الرئوي في جميع أنحاء الرئتين ويمكن أيضاً أن تكون مفيدة في استبعاد أمراض الرئة الأخرى.[17] إذا لم يكن مخططاً لإجراء عملية جراحية، فهذا نادراً ما يؤثر على العلاج.[17] ويتم استخدام غازات الدم الشرياني لتحديد مدى الحاجة إلى الأكسجين؛ ويوصى به لمن يُتوقع أن يكون حجم الزفير القسري لديهم1 أقل من 35%، والذين لديهم تشبع أكسجين محيطي أقل من 92% والذين تظهر لديهم أعراض قصور القلب الاحتقاني.[16] في مناطق العالم التي يشيع فيها نقص مضاد التريبسين ألفا-1، يجب أن يوضع في الاعتبار اختبار الأشخاص المصابين بمرض الانسداد الرئوي المزمن (خاصة من هم دون سن 45 ولديهم نفاخ رئوي يؤثر على الأجزاء السفلية من الرئتين).[16]
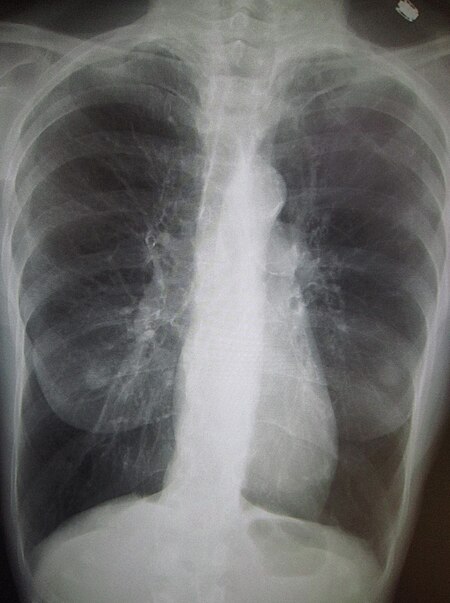
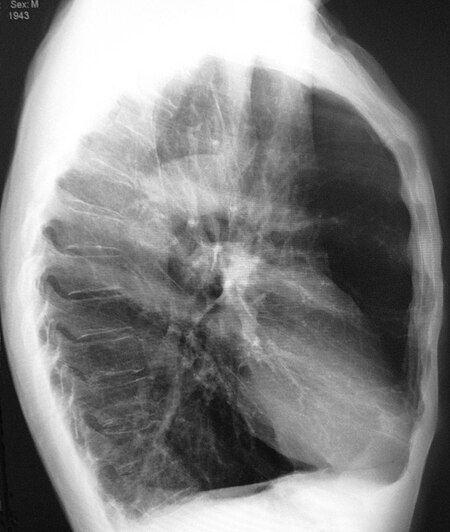
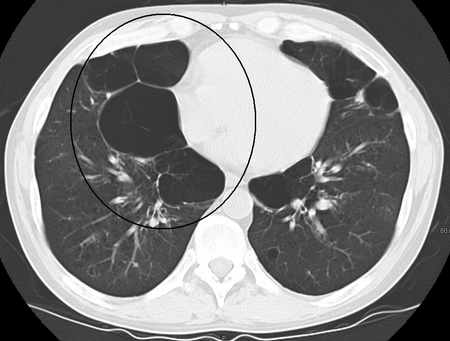
فقاعة رئة كما تبدو عند تصوير الصدر بالأشعة السينية لدى شخص يعاني من داء الانسداد الرئوي المزمن الحاد
التشخيص التفريقي
يجب التفريق بين مرض الانسداد الرئوي المزمن وبين أسباب ضيق النفس الأخرى كقصور القلب والانصمام الرئوي والالتهاب الرئوي والاسترواح الصدري. ويعتقد كثير من الناس خطأً أنهم مصابون بالربو.[24] يتم التمييز بين الربو ومرض الانسداد الرئوي المزمن على أساس الأعراض، وتاريخ التدخين، وما إذا كان نقص تدفق الهواء قابلاً للعكس باستخدام موسعات الشعب الهوائية عند إجراء قياس التنفس.[60] وقد يظهر السل أيضاً مترافقاً بالسعال المزمن ويجب وضعه في الاعتبار في الأماكن التي يشيع وجوده فيها.[16] وتشمل الحالات الأقل شيوعاً التي قد تكون أعراضها مشابهة التهاب القصيبات المسد وخلل التنسج القصبي الرئوي.[58] قد يحدث التهاب الشعب الهوائية المزمن مع تدفق طبيعي للهواء، وفي هذه الحالة لا تُصَنف على أنها مرض الانسداد الرئوي المزمن.[17]
الوقاية
يمكن الوقاية من معظم حالات مرض الانسداد الرئوي المزمن عن طريق تقليل التعرض للدخان وتحسين نوعية الهواء.[37] ويقلل التطعيم ضد الإنفلونزا سنوياً من تفاقم المرض ويحد من احتمالية دخول المستشفيات أو الموت.[61][62] وقد يكون التطعيم ضد المكورات الرئوية مفيداً أيضاً.[61]
الإقلاع عن التدخين
يعتبر الابتعاد عن التدخين أحد الجوانب الرئيسية للوقاية من مرض الانسداد الرئوي المزمن.[63] كما ينبغي على الحكومات تفعيل سياسات الحد من التدخين؛ إذ يمكن أن تعمل هيئات الصحة العامة والمنظمات المناهضة للتدخين على تقليل معدلات التدخين عن طريق تشجيعهم على الإقلاع عن التدخين.[64] كما أن حظر التدخين في الأماكن العامة وأماكن العمل هي تدابير هامة لتقليل التعرض للتدخين السلبي.[37]
أما بالنسبة للمدخنين، فالإقلاع عن التدخين هو الإجراء الوحيد الذي أظهر قدرته على إبطاء تفاقم مرض الانسداد الرئوي المزمن.[65] وحتى في مرحلة متأخرة من المرض، يمكنه التقليل من سرعة تدهور وظائف الرئة وتأخير بداية العجز والوفاة.[66] يبدأ الإقلاع عن التدخين باتخاذ القرار بالتوقف عن التدخين. وغالباً ما يحتاج الأمر إلى عدة محاولات قبل تحقيق الامتناع على المدى الطويل.[64] تؤدي المحاولات التي تتعدى 5 سنوات إلى النجاح لدى ما يقرب من 40% من الأشخاص.[67]
يمكن لبعض المدخنين تحقيق الإقلاع عن التدخين على مدى طويل بقوة الإرادة وحدها. ويعتبر التدخين، على كل حال، مسبباً قوياً للإدمان،[68] ويحتاج الكثير من المدخنين إلى مزيد من الدعم. تم تحسين فرص الإقلاع عن التدخين عن طريق الدعم الاجتماعي، والمشاركة في برامج الإقلاع عن التدخين واستخدام الأدوية مثل العلاج ببدائل النيكوتين، والبوبروبيون أو فارينيكلين.[64][67]
الصحة المهنية
تم اتخاذ عدد من التدابير للحد من احتمال تعرض العمّال في الصناعات الخطرة -مثل مناجم الفحم والبناء ومقالع لأحجار- للإصابة بمرض الانسداد الرئوي المزمن.[37] تتضمن الأمثلة على هذه التدابير: وضع سياسة عامة،[37] وتوعية العمال والإدارة حول المخاطر، وتشجيع الإقلاع عن التدخين، فحص العمال للكشف عن العلامات المبكرة لمرض الانسداد الرئوي المزمن، واستخدام قناع التنفس، والسيطرة على الغبار.[69][70] ويمكن تحقيق السيطرة على الغبار بفعالية من خلال تحسين التهوية، واستعمال بخاخات الماء وباستخدام تقنيات المناجم التي تقلل من إنتاج الغبار.[71] إذا أصيب عامل بمرض الانسداد الرئوي المزمن، يمكن الحد من المزيد من تدهور الرئة عن طريق تجنب التعرض المستمر للغبار، عن طريق تغيير دوره في العمل على سبيل المثال.[72]
تلوث الهواء
من الممكن تحسين نوعية الهواء في كل من الأماكن المغلقة والمفتوحة، مما قد يحول دون الإصابة بمرض الانسداد الرئوي المزمن أو إبطاء تفاقم المرض الموجود.[37] ويمكن تحقيق ذلك عن طريق جهود السياسة العامة، وتغيير العادات، والمشاركة الشخصية.[73]
الهواء في الأماكن المفتوحة
نجحت عدد من الدول المتقدمة في تحسين نوعية الهواء في الأماكن المفتوحة من خلال القوانين التنظيمية. وقد أدى ذلك إلى تحسّن في وظائف الرئة لدى مواطنيها.[37] من الممكن أن يعاني المصابون بمرض الانسداد الرئوي المزمن من أعراض أقل إذا بقوا في منازلهم في الأيام التي تكون نوعية الهواء الخارجي فيها رديئة.[9]
الهواء في الأماكن المغلقة
كما تبذل جهود للحد من التعرّض للدخان الناتج عن وقود الطهي والتدفئة من خلال تحسين تهوية المنازل واستخدام مواقد ومداخن أفضل.[73] فالمواقد المناسبة قد تحسّن من نوعية الهواء في الأماكن المغلقة بنسبة 85%. ويعتبر استخدام مصادر الطاقة البديلة مثل الطهي الشمسي والتدفئة الكهربائية إجراءات فعّالة، كما في حال استخدام أنواع الوقود مثل الكيروسين أو الفحم بدلاً من الكتلة الحيوية.[37]
العلاج
لا يوجد علاج معروف لمرض الانسداد الرئوي المزمن، ولكن الأعراض قابلة للعلاج ويمكن تأخير تقدمها.[63] تتمثل الأهداف الرئيسية لتدبير الحالة في الحد من عوامل الخطر، وتدبير الحالات المستقرة من مرض الانسداد الرئوي المزمن، ومنع وعلاج النوبات الحادة، وعلاج الأمراض المرافقة له.[9] التدابير الوحيدة التي ثبت فعاليتها في الحد من الوفيات هي الإقلاع عن التدخين والأكسجين الإضافي.[74] يقلل الإقلاع عن التدخين من خطر الوفاة بنسبة 18%.[8] وهناك توصيات أخرى تشمل: التطعيم ضد الأنفلونزا مرة واحدة في السنة، والتطعيم ضد المكورات الرئوية مرة واحدة كل 5 سنوات، والحد من التعرض للهواء الملوث.[8] بالنسبة للمصابين بحالات متقدمة من المرض، قد تقلل الرعاية التلطيفية من الأعراض، ومع استخدام المورفين يتحسن الإحساس بالضيق في التنفس.[75] وقد يتم استخدام التنفس الصناعي لدعم التنفس.[75]
العلاج الدوائي: تساعد الأدوية فقط في تخفيف الأعراض ولعلاج التفاقم المرضي ولا تؤدي إلى توقيف تقدم المرض، لا تستعمل هذه الأدوية عند المرضى بدون أعراض. استعمال الموسعات الشعبية: ينصح باستعمال مضادات كولينية قصيرة الأمد مثل الإبراتروبيوم أو الأوكسيتروبيوم بروميد أو الطويلة الأمد مثل التيوتروبيوم. المقلدات الودية الاستنشاقية القصيرة الأمد مثل السالبوتامول والتربوتالين والفينوتيرول عند الحاجة. استعمال المقلدات الودية طويلة الأمد مثل الفورموترول والسالمترول يمكن أن يحسن المستوى المعيشي ويخفف الأعراض. استعمال الثيوفيلين الطويل الأمد عن طريق الفم.
تمرين
يمكن تنسيق برنامج من التمارين لإعادة التأهيل الرئوي، وعلاج طرق تدبيرالمرض وتقديم المشورة المخصصة لمساعدة المصاب.[76] بالنسبة للذين عانوا مؤخراً من نوبة شديدة للمرض، يبدو أن إعادة التأهيل الرئوي تحسّن نوعية الحياة ككل والقدرة على ممارسة التمارين، وتحدّ من حالات الوفاة.[77] وقد تبين أيضاً أنه يحسن من شعور الشخص بقدرته على التحكم في مرضه وانفعالاته.[78] ويبدو أن دور تمارين التنفس في حد ذاتها محدود.[23]
إذا كان المصاب ذا وزن زائد أو قليل، فمن الممكن أن يؤثر هذا على الأعراض ودرجة العجز وإنذار مرض الانسداد الرئوي المزمن. يمكن للأشخاص الذين يعانون من مرض الانسداد الرئوي المزمن ولديهم نقص في الوزن تحسين قوة عضلات التنفس عن طريق زيادة السعرات الحرارية المتناولة.[9] وعندما يقترن هذا بالقيام بممارسة التمارين بانتظام أو برنامج إعادة التأهيل الرئوي، يمكن أن يؤدي إلى تحسن في أعراض مرض الانسداد الرئوي المزمن. وقد تكون التغذية التكميلية مفيدة عند الذين يعانون من سوء التغذية.[79]
موسعات الشعب الهوائية
العلاج الأساسي المستخدم هو الموسعات القصبية المستنشقة[8] وهي عموماً ذات فائدة قليلة.[80] هناك نوعان رئيسيان من الموسعات: ناهضات مستقبلات بيتا 2 الأدريناليةβ2 ومضادات الكولين؛ ويتوفر كلاهما في أشكال ذات مفعول طويل الأجل وأشكال ذات مفعول قصير الأجل. وهي تقلل من ضيق التنفس، والأزيز والعجز عن ممارسة التمارين، ما يؤدي إلى تحسين جودة الحياة.[81]
ينصح المرضى الذين يعانون من درجة مرض خفيفة باستخدام المضادات قصيرة المفعول عند الحاجة.[8] أما عند المصابين بحالات أكثر شدة، ينصح باستخدام المضادات طويلة المفعول.[8] إذا كانت موسعات الشعب الهوائية طويلة المفعول غير كافية، تضاف إليها عادةً الكورتيكوستيرويدات المستنشقة.[8] فيما يتعلق بالمواد طويلة المفعول، من غير الواضح ما إذا كان التيوتروبيوم (مضاد الكولين طويل المفعول) أو ناهضات مستقبلات بيتا طويلة المفعول (LABAs) هو الأفضل، وقد يكون من الأجدر تجربة كلا منهما ثم الاستمرار في استخدام أفضلهما.[82] ويبدو أن كلا النوعين يقللان من مخاطر النوبات الحادة من 15-25%.[8] في حين قد يفيد استخدام كلاهما في نفس الوقت؛ لكن أهمية هذه الفائدة إن وجدت مشكوك فيها.[83]
ناهضات مستقبلات بيتا
هناك العديد من ناهضات مستقبلات بيتا قصيرة المفعول 2 ومنها سالبيوتامول (فينتولين) وتيربوتالين.[84] وهي تخفف من الأعراض لمدة أربع إلى ست ساعات.[84] أما ناهضات مستقبلات بيتا طويلة المفعول 2 مثل سالبيوتامول وفورموتيرول فتستخدم غالباً كعلاج وقائي. يرى البعض أن الدليل على فوائدها محدود [85] في حين يرى آخرون ثبوت فوائدها.[86][87] ويبدو أن الاستخدام طويل المدى آمن في مرض الانسداد الرئوي المزمن[88] مع وجود آثار سلبية تتضمن ارتعاش وخفقان القلب.[8] وعند استخدامها مع الستيرويدات المستنشقة فإنها تزيد من إمكانية الإصابة بذات الرئة.[8] وفي حين من الممكن أن تعمل الستيرويدات و LABAs معاً بشكل أفضل، [85] إلا إنه من غير الواضح ما إذا كانت هذه الفائدة الطفيفة تفوق المخاطر المتزايدة.[89]
مضادات الكولين
هناك نوعان رئيسيان من مضادات الكولين يستخدمان في مرض الانسداد الرئوي المزمن هما، إبراتروبيوم وتيوتروبيوم. الإبراتروبيوم هو عامل قصير المفعول بينما التيوتروبيوم هو عامل طويل المفعول. ويرتبط التيوتروبيوم بتناقص نوبات تفاقم المرض وتحسين نوعية الحياة،[90] وهو يعطي تلك الفوائد بشكل أفضل من الإبراتروبيوم.[91] ولا يبدو أنه يؤثر على معدل الوفيات أو معدل دخول المستشفى ككل.[92] يمكن لمضادات الكولين أن تسبب جفاف الفم وأعراضاً بولية.[8] كما أنها ترتبط بزيادة خطر الإصابة بأمراض القلب والسكتة الدماغية.[93][94] أكليدينيوم هو عامل آخر طويل المفعول تم تداوله في عام 2012، وقد استخدم كبديل للتيوتروبيوم.[95][96]
الكورتيكوستيرويدات
يستخدم الكورتيزون عادة بشكله المستنشق، ولكن يمكن أيضاً أن يستخدم كأقراص لعلاج النوبات الحادة والوقاية منها. وفي حين لم يُظهِر الكورتيزون المستنشق (ICS) فائدة لدى مرضى الانسداد الرئوي المزمن الخفيف، إلا إنه يقلل النوبات الحادة لدى المرضى ذوي الحالات المتوسطة أو الشديدة.[97] وعندما يستخدم مع أحد ناهضات مستقبلات بيتا طويلة المفعول فإنه يخفض معدل الوفيات أكثر من استخدام الكورتيزون أو مستقبلات بيتا طويلة المفعول منفردين.[98] وليس له أي تأثير على معدل الوفيات ككل خلال عام واحد ويترافق بزيادة معدلات الإصابة بذات الرئة.[74] ومن غير الواضح ما إذا كان له تأثير على تقدم المرض.[8] ويرتبط العلاج طويل الأمد بأقراص الستيرويد بآثار جانبية كبيرة.[84]
علاجات أخرى
ينقص استخدام المضادات الحيوية لمدة طويلة، وتحديداً تلك التي تنتمي إلى مجموعة ماكروليد مثل إريثروميسين، من تكرار النوبات لدى أولئك الذين تحدث لهم نوبات مرتين أو أكثر في السنة.[99][100] قد تكون هذه الطريقة مجدية اقتصادياً في بعض مناطق العالم.[101] وهناك مخاوف من حدوث مقاومة المضادات الحيوية ومشاكل في السمع نتيجة استخدام الزانتين.[100] وبشكل عام، يسبب استعمال زانتين مثل تيوفيلين أضراراً أكثر من المنافع وهو بالتالي غير مستحسن عادة،[102] ولكن يمكن استخدامه كدواء خط ثاني لمن لا تجدي التدابير الأخرى مع حالاتهم.[9] ولا ينصح باستخدام أدوية السعال.[84]
الأكسجين
ينصح باستخدام العلاج بالأكسجين لمن لديهم مستويات منخفضة من الأكسجين أثناء الراحة (الضغط الجزئي للأكسجين يكون أقل من 50-55 ملم زئبق أو درجة الإشباع بالأكسجين أقل من 88%).[84][103] يقلل استخدام الأكسجين عند هؤلاء المصابين من إمكانية الإصابة بقصور القلب والموت في حال استخدامه لمدة 15 ساعة يومياً [84][103] ويمكن أن يحسن من قدرة الأشخاص على ممارسة التمارين.[104] قد يحسن الأكسجين التكميلي من ضيق التنفس لدى من لديهم مستويات طبيعية أو منخفضة قليلاً من الأكسجين.[105] هناك خطر حدوث الحرائق وفائدة قليلة عند من يعالج بالأكسجين ويستمر في التدخين.[106] وفي هذه الحالة يوصي البعض بعدم استخدامه.[107] يحتاج الكثيرون أثناء النوبات الحادة إلى العلاج بالأكسجين؛ وقد يفضي استخدام تركيزات عالية من الأكسجين دون الأخذ بعين الاعتبار درجة الإشباع بالأكسجين، إلى زيادة مستويات ثاني أكسيد الكربون وسوء النتائج.[108][109] عند الأشخاص المعرضين لمخاطر ارتفاع مستويات ثاني أكسيد الكربون بدرجة عالية، يُنصح أن يكون درجة الإشباع بالأكسجين من 88-92% في حين يوصى أن تكون درجة الإشباع الموصى بها من 94-98% لمن ليس لديهم هذا الخطر.[109]
الجراحة
بالنسبة للذين يعانون من الحالات الشديدة جدا من المرض، تعتبر الجراحة مفيدة أحياناً وقد تشمل زرع الرئة أو جراحة تصغير حجم الرئة.[8] تتضمن جراحة تصغير حجم الرئة إزالة الأجزاء الأكثر تضررًا من الرئة بسبب النفاخ الرئوي لتسمح لباقي الرئة الجيدة نسبياً بالتمدد والعمل بشكل أفضل.[84] يتم زرع الرئة أحياناً للذين يعانون من مرض الانسداد الرئوي المزمن الشديد جداً، لا سيما للأشخاص الأصغر سناً.[84]
علاج تفاقم الحالة
يتم علاج نوبات تفاقم المرض الحادة عادة عن طريق زيادة استخدام موسعات الشعب الهوائية قصيرة المفعول.[8] وهذا يشمل عادةً مزيجاً من ناهضات مستقبلات بيتا قصيرة المفعول المستنشقة ومضادات الكولين.[45] يمكن إعطاء هذه الأدوية إما عن طريق جهاز استنشاق بالجرعات المقننة مع مفساح الربو أو عن طريق البخاخة وكلاهما فعالٌ بنفس القدر.[45] استنشاق الرذاذ قد يكون أسهل بالنسبة لمن هم أكثر توعكاً.[45]
تحسن الكورتيكوستيرويدات عن طريق الفم فرصة الشفاء وتقلل المدة الإجمالية للأعراض.[8][45] وتحسن المضادات الحيوية النتائج عند الذين يعانون من نوبة شديدة.[110] وهناك عدد من المضادات الحيوية المختلفة التي يمكن استخدامها وتتضمن: أموكسيسيلين، دوكسيسايكلين، أزيثرومايسين؛ ومن غير الواضح إذا كان أحدهما أفضل من سواه.[61] وليس هناك دليل واضح عند المصابين بحالات أقل شدة.[110]
الأشخاص الذين يعانون من مشاكل توقف التنفس (أي من لديهم مستويات عالية جداً من ثاني أكسيد الكربون CO2 يمكن استخدام التنفس الصناعي لتقليل احتمال الوفاة أو الحاجة لدخول العناية المركزة.[8] بالإضافة إلى ذلك، قد يكون للتيوفيلين دورٌ عند الذين لا يستجيبون للتدابير الأخرى.[8] أقل من 20% من نوبات المرض تتطلب دخول المستشفى.[45] أما بالنسبة للمرضى الذين لا يعانون من حماض نتيجة القصور التنفسي، فقد تساعد الرعاية المنزلية ("مستشفى في المنزل") في تجنب تكرار الدخول للمستشفى.[45][111]
المآل

لا يوجد بيانات ≤110 110–220 220–330 330–440 440–550 550–660 | 660–770 770–880 880–990 990–1100 1100–1350 ≥1350 |
عادةً ما يسوء مرض الانسداد الرئوي المزمن تدريجياً مع مرور الوقت ويمكن أن يؤدي في النهاية إلى الوفاة. ويقدر أن 3% من عدد سنوات العمر باحتساب العجز ترتبط بمرض الانسداد الرئوي المزمن.[113] انخفضت نسبة الإعاقة من مرض الانسداد الرئوي المزمن عالمياً من عام 1990 إلى 2010 نتيجة لتحسين نوعية الهواء في الأماكن المغلقة وبخاصة في آسيا.[113] ومع ذلك، فقد ازداد عدد السنوات الإجمالي التي يعيشها الشخص بوجود مرض الانسداد الرئوي المزمن.[114]
تختلف سرعة تفاقم مرض الانسداد الرئوي المزمن مع وجود العوامل المنذرة بنتيجة متواضعة وتشمل: الإعاقة الشديدة لتدفق الهواء، والقدرة الضعيفة على ممارسة التمارين، وضيق التنفس، ونقص الوزن أو زيادته بشكل كبير، وقصور القلب الاحتقاني، والتدخين المتواصل، والنوبات المتكررة.[9] يمكن تقدير النتائج طويلة الأمد في مرض الانسداد الرئوي المزمن باستخدام مؤشر BODE الذي يعطي درجة من صفر إلى عشرة تبعاً لحجم الزفير القسري 1FEV ومؤشر كتلة الجسم، وعن طريق المسافة المقطوعة سيراً على الأقدام في ست دقائق، وضيق النفس.[115] يعتبر فقدان الوزن بشكل كبير علامة سيئة.[17] كما تعتبر نتائج قياس التنفس مؤشراً جيداً لتقدم المرض في المستقبل ولكنها ليست جيدة كمؤشر BODE.[17][18]
الوبائيات
اعتبارا من عام 2010، أثّر مرض الانسداد الرئوي المزمن على ما يقرب من 329 مليون نسمة (4.8% من السكان) على مستوى العالم، وهو أكثر شيوعاً بشكل طفيف بين الرجال مقارنة بالنساء.[114] في حين تأثّر بهذا المرض حوالي 64 مليون نسمة عام 2004.[116] ويعتقد أن الزيادة في العالم النامي بين عام 1970 والعقد الأول من القرن العشرين ترتبط بزيادة معدلات التدخين في هذه المناطق، فضلاً عن تزايد أعداد السكان وارتفاع معدلات شيخوخة السكان بسبب انخفاض الوفيات الناتجة عن أسباب أخرى كالأمراض المعدية.[8] وقد شهدت بعض البلدان المتقدمة زيادة في معدلات الإصابة، لكن ظل المرض مستقراً في دول أخرى، وشهد بعضها انخفاضاً في معدلات انتشار مرض الانسداد الرئوي المزمن.[8] ومن المتوقع أن تستمر زيادة الأعداد على مستوى العالم بسبب انتشار عوامل الخطر واستمرار زيادة أعمار السكان.[63]
بين عامي 1990 و 2010 انخفض عدد الوفيات من مرض الانسداد الرئوي المزمن قليلاً من 3.1 مليون إلى 2.9 مليون.[117] وهو يعتبر بشكل عام السبب الرئيسي الرابع للوفاة.[8] في بعض البلدان، انخفض معدل الوفيات لدى الرجال ولكنه ازداد عند النساء.[118] يرجع هذا على الأرجح إلى تقارب معدلات التدخين بين النساء والرجال.[17] مرض الانسداد الرئوي المزمن أكثر شيوعاً بين كبار السن[7] فهو يؤثر على 34-200 من كل 1000 شخص يتجاوز عمره 65 سنة، حسب المجموعات السكانية المدروسة.[7][59]
في إنجلترا، يقدّر عدد الذين شُخّصت إصابتهم بمرض الانسداد الرئوي المزمن بنحو 0.84 مليون نسمة (من 50 مليون)؛ أي أن شخصاً واحداً تقريباً من كل 59 شخص ستشخص إصابته بمرض الانسداد الرئوي المزمن في مرحلة ما من حياته. وفي المناطق الأكثر حرماناً اجتماعياً واقتصادياً من البلاد، تم تشخيص الإصابة بمرض الانسداد الرئوي المزمن لدى واحد من كل 32 شخص، مقارنةً بواحد من كل 98 في المناطق الأكثر ثراءً.[119] في الولايات المتحدة تم تشخيص مرض الانسداد الرئوي المزمن لدى حوالي 6.3% من السكان البالغين، بمجموع حوالي 15 مليون نسمة.[120] وقد يرتفع إجمالي عدد المصابين بمرض الانسداد الرئوي المزمن إلى 25 مليون شخص إذا أخذت الحالات غير المشخصة حالياً بالحسبان.[121] في عام 2011، كان هناك حوالي 730,000 حالة استشفاء في الولايات المتحدة بسبب مرض الانسداد الرئوي المزمن.[122]
تاريخ

وكلمة "النفاخ الرئوي" مشتقة من اللغة اليونانية ἐμφυσᾶν بمعنى "انتفاخ" – وتتألف من ἐν en، بمعني "داخل"، و φυσᾶν physan، وتعني "نفس، نفخة".[123] بدأ استخدام مصطلح الالتهاب الشعبي المزمن في عام 1808[124] في حين يعتقد أن مصطلح مرض الانسداد الرئوي المزمن قد استخدم لأول مرة في عام 1965.[125] وقد كان يعرف في السابق بعدد من الأسماء المختلفة وتشمل: مرض الانسداد الشعبي الرئوي المزمن، ومرض انسداد الجهاز التنفسي المزمن، وإعاقة تدفق الهواء المزمن، وقلة تدفق الهواء المزمن، ومرض انسداد الرئة المزمن، والمرض الرئوي المزمن غير المحدد، ومتلازمة الانسداد الرئوي المنتشر. رسمياً، تم وضع تعريف مصطّلّحي "الالتهاب الشعبي المزمن" و"النفاخ الرئوي" في عام 1959 في ندوة استضافتها شركة نوفارتس، وفي عام 1962 خلال اجتماع لجنة معايير التشخيص التابعة للجمعية الأمريكية لأمراض الصدر.[125]
تشمل الأوصاف الأولى للنفاخ الرئوي المحتمل ما وضعه ت. بونيت عام 1679 لوصف وجود حالة "الرئة الضخمة" وما وضعه جيوفاني باتيستا مورغاني عام 1769 لرئتين كانتا "متورمتين بوضوح من الهواء".[125][126] في عام 1721 قدّم "رويش" الرسومات الأولى للنفاخ الرئوي.[126] تلتها صور وضعها ماثيو بيللي في عام 1789 مع وصف للطبيعة المدمرة للحالة. في عام 1814 استخدم "تشارلز بدهام" مصطلح "النزلات" لوصف السعال والمخاط الزائد في التهاب الشعب الهوائية المزمن. استخدم رينيه ليناك، الطبيب الذي اخترع سماعة الطبيب، مصطلح "النفاخ الرئوي" في كتابه بحث حول أمراض الصدر والإصغاء المباشر (1837) لوصف الرئة التي لم تنخمص عند فتحه الصدر أثناء تشريح إحدى الجثث. وأشار إلى أنها لم تنخمص كالعادة لأنها كانت مملوءة بالهواء والشعب الهوائية مملوءة بالمخاط. في عام 1842، اخترع جون هتشنسون مقياس التنفس spirometer، والذي أتاح قياس السعة الحيوية للرئتين. على أي حال، يمكن لهذا المقياس قياس حجم الهواء فقط، وليس تدفقه. في عام 1947 وصف تيفينيو وبينيلي مبادئ قياس تدفق الهواء.[125]
في عام 1953، وضع الدكتور جورج ل. والدبوت، الطبيب الأمريكي المختص بالحساسية، لأول مرة وصفاً لمرض جديد سماه "المتلازمة التنفسية للمدخن" في مجلة الجمعية الطبية الأميركية لعام 1953. وكان هذا أول ربط بين تدخين التبغ والأمراض التنفسية المزمنة.[127]
كانت العلاجات القديمة تشمل الثوم والقرفة وعرق الذهب وغيرها.[124] ثم طُوّرت العلاجات الحديثة خلال النصف الثاني من القرن العشرين. ونشرت الأدلة المؤيدة لاستخدام السترويدات في علاج مرض الانسداد الرئوي المزمن في أواخر الخمسينات من القرن الماضي. وبدأ استخدام موسعات الشعب الهوائية في الستينات بعد تجربة واعدة لاستخدام آيزوبرينالين. واستخدمت موسعات الشعب الهوائية الأخرى، مثل سالبوتامول، في السبعينات، كما بدأ استخدام ناهضات مستقبلات بيتا طويلة المفعول في منتصف التسعينات.[128]
المجتمع والثقافة
يشار لمرض الانسداد الرئوي المزمن بأنه "رئة المدخن".[129] ويعرف المصابون بالنفاخ الرئوي باسم "النافخون الورديون" أو "النوع أ" بسبب بشرتهم الوردية اللون باستمرار، ومعدل التنفس السريع والشفاه المزمومة،[130][131] وقد يشار إلى الأشخاص الذين يعانون من التهاب الشعب الهوائية المزمن باسم "المنتفخون الزرق" أو "النوع ب" بسبب اللون الذي غالباً ما يكون ضارباً للزرقة، أي لون الجلد والشفتين المزّرق نتيجة انخفاض مستويات الأكسجين وتورم كواحلهم.[131][132] هذا المصطلح لم يعد مقبولاً لأن معظم الأشخاص الذين لديهم مرض الانسداد الرئوي المزمن لديهم مزيج من الاثنين معاً.[17][131]
تجد العديد من النظم الصحية صعوبة في ضمان وضع التعريف والتشخيص والرعاية المناسبة للأشخاص الذين يعانون من مرض الانسداد الرئوي المزمن؛ وقد حددت الإدارة الصحية في بريطانيا هذا الأمر باعتباره قضية رئيسية تخص الهيئة الوطنية للخدمات الصحية، واستحدثت إستراتيجية محددة لمعالجة هذه المشاكل.[133]
اقتصادياً
عالمياً، واعتباراً من عام 2010، يقدر أن تبلغ التكلفة الاقتصادية لمرض الانسداد الرئوي المزمن 2.1 تريليون دولار، يحدث نصفها في العالم النامي.[15] ويقدر 1.9 تريليون دولار من هذا المجموع بالتكاليف المباشرة مثل الرعاية الطبية، بينما يعتبر 0.2 تريليون دولار تكاليف غير مباشرة مثل فقد العمل.[134] ومن المتوقع أن ترتفع هذه التكلفة لأكثر من الضعف خلال العشرين سنة القادمة.[15] في أوروبا، يمثل مرض الانسداد الرئوي المزمن 3% من الإنفاق على الرعاية الصحية.[7] في الولايات المتحدة، تقدر تكاليف هذا المرض بمبلغ 50 مليار دولار، ويرجع معظمها إلى تفاقم النوبات.[7] كان مرض الانسداد الرئوي المزمن من بين أكثر الحالات تكلفة في مستشفيات الولايات المتحدة خلال عام 2011، بتكلفة إجمالية قدرها حوالي 5.7 مليار دولار.[122]
الأبحاث
تم اختبار إنفليكسيماب، وهو جسم مضاد وحيد النسيلة كابت للمناعة، في مرض الانسداد الرئوي المزمن، لكن لم يكن هناك دليل على فائدته مع احتمال أن يسبب أذى.[135] يبدو الروفلوميلاست واعداً في خفض معدل النوبات ولكنه لا يحدث أي تغيير في نوعية الحياة.[8] وهناك عدد من المواد الجديدة طويلة المفعول قيد التطوير.[8] ويخضع العلاج بواسطة الخلايا الجذعية للدراسة.[136] رغم أنها تعد آمنة بوجه عام وذات بيانات واعدة عند الحيوان، إلا أن هناك القليل من البيانات الخاصة بالبشر حتى عام 2014.[137]
في الحيوانات
قد يحدث مرض الانسداد الرئوي المزمن في عدد من الحيوانات الأخرى ويمكن أن يحدث نتيجة التعرض لدخان السجائر.[138][139] على أي حال، تعتبر معظم حالات المرض خفيفة نسبياً.[140] في الخيول يُعرف المرض أيضاً باسم انسداد مجرى الهواء الراجع وعادة ما يكون بسبب رد فعل تحسسي تجاه القش الذي يحتوي على الفطريات.[141] وعادةً ما يوجد مرض الانسداد الرئوي المزمن في الكلاب كبيرة السن.[142]
مقالات ذات صلة
وصلات خارجية
- GOLD ماذا بإمكانك أن تفعل بشأن مرض الانسداد الرئوي المزمن.
مراجع
- https://pubmed.ncbi.nlm.nih.gov/27268422
- ويب طب، تاريخ الولوج 3 مارس 2015 نسخة محفوظة 1 يوليو 2017 على موقع واي باك مشين.
- وزارة الصحة السعودية - تصفح: نسخة محفوظة 10 يوليو 2017 على موقع واي باك مشين.
- الجزيرة دوت نت، تاريخ الولوج 3 مارس 2015 نسخة محفوظة 28 سبتمبر 2018 على موقع واي باك مشين.
- GOLD - the Global initiative for chronic Obstructive Lung Disease - تصفح: نسخة محفوظة 13 يوليو 2007 على موقع واي باك مشين.
- oxford handbook of clinical medicine 8th edition
- Vestbo, Jørgen (2013). "Definition and Overview" ( كتاب إلكتروني PDF ). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. صفحات 1–7.
- Decramer M, Janssens W, Miravitlles M (April 2012). "Chronic obstructive pulmonary disease". Lancet. 379 (9823): 1341–51. doi:10.1016/S0140-6736(11)60968-9. PMID 22314182.
- Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J (September 2007). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". Am. J. Respir. Crit. Care Med. 176 (6): 532–55. doi:10.1164/rccm.200703-456SO. PMID 17507545. مؤرشف من الأصل في 2 يناير 2013.
- Nathell L, Nathell M, Malmberg P, Larsson K (2007). "COPD diagnosis related to different guidelines and spirometry techniques". Respir. Res. 8 (1): 89. doi:10.1186/1465-9921-8-89. PMC . PMID 18053200.
- "Chronic obstructive pulmonary disease (COPD)". www.who.int (باللغة الإنجليزية). مؤرشف من الأصل في 21 أبريل 202026 مايو 2020.
- "Asthma vs. COPD: What's the Difference?". WebMD (باللغة الإنجليزية). مؤرشف من الأصل في 26 ديسمبر 201926 مايو 2020.
- "The 10 leading causes of death in the world, 2000 and 2011". World Health Organization. July 2013. مؤرشف من الأصل في 23 أبريل 201829 نوفمبر 2013.
- Mathers CD, Loncar D (November 2006). "Projections of Global Mortality and Burden of Disease from 2002 to 2030". PLoS Med. 3 (11): e442. doi:10.1371/journal.pmed.0030442. PMC . PMID 17132052. مؤرشف من الأصل في 09 مارس 2020.
- Lomborg, Bjørn (2013). Global problems, local solutions : costs and benefits. Cambridge University Pres. صفحة 143. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Vestbo, Jørgen (2013). "Diagnosis and Assessment" ( كتاب إلكتروني PDF ). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. صفحات 9–17.
- Reilly, John J.; Silverman, Edwin K.; Shapiro, Steven D. (2011). "Chronic Obstructive Pulmonary Disease". In Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph (المحررون). Harrison's Principles of Internal Medicine (الطبعة 18th). McGraw Hill. صفحات 2151–9. .
- المعهد الوطني للصحة وتفوق الرعاية. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Mahler DA (2006). "Mechanisms and measurement of dyspnea in chronic obstructive pulmonary disease". Proceedings of the American Thoracic Society. 3 (3): 234–8. doi:10.1513/pats.200509-103SF. PMID 16636091.
- "What Are the Signs and Symptoms of COPD?". المعهد الوطني للقلب والرئة والدم. July 31, 2013. مؤرشف من الأصل في 21 أكتوبر 201429 نوفمبر 2013.
- مدلاين بلس Chronic obstructive pulmonary disease
- Morrison, [edited by] Nathan E. Goldstein, R. Sean (2013). Evidence-based practice of palliative medicine. Philadelphia: Elsevier/Saunders. صفحة 124. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Holland AE, Hill CJ, Jones AY, McDonald CF (2012). Holland, Anne E (المحرر). "Breathing exercises for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 10: CD008250. doi:10.1002/14651858.CD008250.pub2. PMID 23076942.
- Gruber, Phillip (November 2008). "The Acute Presentation of Chronic Obstructive Pulmonary Disease In the Emergency Department: A Challenging Oxymoron". Emergency Medicine Practice. 10 (11). مؤرشف من الأصل في 24 مايو 2019.
- Weitzenblum E, Chaouat A (2009). "Cor pulmonale". Chron Respir Dis. 6 (3): 177–85. doi:10.1177/1479972309104664. PMID 19643833.
- "Cor pulmonale". Professional guide to diseases (الطبعة 9th). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2009. صفحات 120–2. .
- Mandell, editors, James K. Stoller, Franklin A. Michota, Jr., Brian F. (2009). The Cleveland Clinic Foundation intensive review of internal medicine (الطبعة 5th). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. صفحة 419. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Brulotte CA, Lang ES (May 2012). "Acute exacerbations of chronic obstructive pulmonary disease in the emergency department". Emerg. Med. Clin. North Am. 30 (2): 223–47, vii. doi:10.1016/j.emc.2011.10.005. PMID 22487106.
- Spiro, Stephen (2012). Clinical respiratory medicine expert consult (الطبعة 4th). Philadelphia, PA: Saunders. صفحة Chapter 43. . مؤرشف من الأصل في 6 أكتوبر 2014.
- World Health Organization (2008). WHO Report on the Global Tobacco Epidemic 2008: The MPOWER Package ( كتاب إلكتروني PDF ). Geneva: World Health Organization. صفحات 268–309. . مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 8 أغسطس 2019.
- Ward, Helen (2012). Oxford Handbook of Epidemiology for Clinicians. Oxford University Press. صفحات 289–290. . مؤرشف من الأصل في 10 أكتوبر 2014.
- Laniado-Laborín, R (January 2009). "Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21st century". International journal of environmental research and public health. 6 (1): 209–24. doi:10.3390/ijerph6010209. PMC . PMID 19440278.
- Rennard, Stephen (2013). Clinical management of chronic obstructive pulmonary disease (الطبعة 2nd). New York: Informa Healthcare. صفحة 23. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Anita Sharma ; with a contribution by David Pitchforth ; forewords by Gail Richards; Barclay, Joyce (2010). COPD in primary care. Oxford: Radcliffe Pub. صفحة 9. . مؤرشف من الأصل في 17 مايو 2016.
- Goldman, Lee (2012). Goldman's Cecil medicine (الطبعة 24th). Philadelphia: Elsevier/Saunders. صفحة 537. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Kennedy SM, Chambers R, Du W, Dimich-Ward H (December 2007). "Environmental and occupational exposures: do they affect chronic obstructive pulmonary disease differently in women and men?". Proceedings of the American Thoracic Society. 4 (8): 692–4. doi:10.1513/pats.200707-094SD. PMID 18073405. مؤرشف من الأصل في 8 ديسمبر 2011.
- Pirozzi C, Scholand MB (July 2012). "Smoking cessation and environmental hygiene". Med. Clin. North Am. 96 (4): 849–67. doi:10.1016/j.mcna.2012.04.014. PMID 22793948.
- Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM (September 2006). "Global burden of COPD: systematic review and meta-analysis". Eur. Respir. J. 28 (3): 523–32. doi:10.1183/09031936.06.00124605. PMID 16611654.
- Devereux, Graham (2006). "Definition, epidemiology and risk factors". BMJ. 332 (7550): 1142–4. doi:10.1136/bmj.332.7550.1142. PMC . PMID 16690673.
- Laine, Christine (2009). In the Clinic: Practical Information about Common Health Problems. ACP Press. صفحة 226. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Barnes, Peter J.; Drazen, Jeffrey M.; Rennard, Stephen I.; Thomson, Neil C., المحررون (2009). "Relationship between cigarette smoking and occupational exposures". Asthma and COPD: Basic Mechanisms and Clinical Management. Amsterdam: Academic. صفحة 464. .
- Rushton, Lesley (2007). "Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica". Reviews on Environmental Health. 22 (4): 255–72. doi:10.1515/REVEH.2007.22.4.255. PMID 18351226.
- Foreman MG, Campos M, Celedón JC (July 2012). "Genes and chronic obstructive pulmonary disease". Med. Clin. North Am. 96 (4): 699–711. doi:10.1016/j.mcna.2012.02.006. PMC . PMID 22793939.
- Brode SK, Ling SC, Chapman KR (September 2012). "Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease". CMAJ. 184 (12): 1365–71. doi:10.1503/cmaj.111749. PMC . PMID 22761482.
- Vestbo, Jørgen (2013). "Management of Exacerbations" ( كتاب إلكتروني PDF ). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. صفحات 39–45.
- Dhar, Raja (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. صفحة 1056. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Palange, Paolo (2013). ERS Handbook of Respiratory Medicine. European Respiratory Society. صفحة 194. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Lötvall, Jan (2011). Advances in combination therapy for asthma and COPD. Chichester, West Sussex: John Wiley & Sons. صفحة 251. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Barnes, Peter (2009). Asthma and COPD : basic mechanisms and clinical management (الطبعة 2nd). Amsterdam: Academic. صفحة 837. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Hanania, Nicola (2010-12-09). COPD a Guide to Diagnosis and Clinical Management (الطبعة 1st). Totowa, NJ: Springer Science+Business Media, LLC. صفحة 197. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Beasley, V; Joshi, PV; Singanayagam, A; Molyneaux, PL; Johnston, SL; Mallia, P (2012). "Lung microbiology and exacerbations in COPD". International journal of chronic obstructive pulmonary disease. 7: 555–69. doi:10.2147/COPD.S28286. PMC . PMID 22969296.
- Murphy DMF, Fishman AP (2008). "Chapter 53". Fishman's Pulmonary Diseases and Disorders (الطبعة 4th). McGraw-Hill. صفحة 913. .
- Calverley PM, Koulouris NG (2005). "Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology". Eur Respir J. 25 (1): 186–199. doi:10.1183/09031936.04.00113204. PMID 15640341.
- Currie, Graeme P. (2010). ABC of COPD (الطبعة 2nd). Chichester, West Sussex, UK: Wiley-Blackwell, BMJ Books. صفحة 32. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Qaseem A, Wilt TJ, Weinberger SE, Hanania NA, Criner G, van der Molen T, Marciniuk DD, Denberg T, Schünemann H, Wedzicha W, MacDonald R, Shekelle P (August 2011). "Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Ann. Intern. Med. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
- Young, Vincent B. (2010). Blueprints medicine (الطبعة 5th). Philadelphia: Wolters Kluwer Health/Lippincott William & Wilkins. صفحة 69. . مؤرشف من الأصل في 6 أكتوبر 2014.
- "COPD Assessment Test (CAT)". جمعية الصدر الأمريكية. مؤرشف من الأصل في 19 يناير 201529 نوفمبر 2013.
- المعهد الوطني للصحة وتفوق الرعاية. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Torres M, Moayedi S (May 2007). "Evaluation of the acutely dyspneic elderly patient". Clin. Geriatr. Med. 23 (2): 307–25, vi. doi:10.1016/j.cger.2007.01.007. PMID 17462519.
- BTS COPD Consortium (2005). "Spirometry in practice - a practical guide to using spirometry in primary care". صفحات 8–9. مؤرشف من الأصل في 13 أبريل 201525 أغسطس 2014.
- Mackay AJ, Hurst JR (July 2012). "COPD exacerbations: causes, prevention, and treatment". Med. Clin. North Am. 96 (4): 789–809. doi:10.1016/j.mcna.2012.02.008. PMID 22793945.
- Poole PJ, Chacko E, Wood-Baker RW, Cates CJ (2006). Poole, Phillippa (المحرر). "Influenza vaccine for patients with chronic obstructive pulmonary disease". Cochrane Database Syst Rev (1): CD002733. doi:10.1002/14651858.CD002733.pub2. PMID 16437444.
- Vestbo, Jørgen (2013). "Introduction". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease ( كتاب إلكتروني PDF ). Global Initiative for Chronic Obstructive Lung Disease. xiii–xv. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 28 مارس 2016.
- Policy Recommendations for Smoking Cessation and Treatment of Tobacco Dependence. World Health Organization. صفحات 15–40. . مؤرشف من الأصل في 24 سبتمبر 2018.
- Jiménez-Ruiz CA, Fagerström KO (March 2013). "Smoking cessation treatment for COPD smokers: the role of counselling". Monaldi Arch Chest Dis. 79 (1): 33–7. PMID 23741944.
- Kumar P, Clark M (2005). Clinical Medicine (الطبعة 6th). Elsevier Saunders. صفحات 900–1. .
- Tønnesen P (March 2013). "Smoking cessation and COPD". Eur Respir Rev. 22 (127): 37–43. doi:10.1183/09059180.00007212. PMID 23457163.
- "Why is smoking addictive?". NHS Choices. December 29, 2011. مؤرشف من الأصل في 12 يونيو 201829 نوفمبر 2013.
- Smith, Barbara K. Timby, Nancy E. (2005). Essentials of nursing : care of adults and children. Philadelphia: Lippincott Williams & Wilkins. صفحة 338. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Rom, William N.; Markowitz, Steven B., المحررون (2007). Environmental and occupational medicine (الطبعة 4th). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. صفحات 521–2. . مؤرشف من الأصل في 6 أكتوبر 2014.
- "Wet cutting". إدارة الصحة والسلامة. مؤرشف من الأصل في 4 أكتوبر 201829 نوفمبر 2013.
- George, Ronald B. (2005). Chest medicine : essentials of pulmonary and critical care medicine (الطبعة 5th). Philadelphia, PA: Lippincott Williams & Wilkins. صفحة 172. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Vestbo, Jørgen (2013). "Management of Stable COPD". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease ( كتاب إلكتروني PDF ). Global Initiative for Chronic Obstructive Lung Disease. صفحات 31–8. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 28 مارس 2016.
- Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E (November 2008). "Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (20): 2407–16. doi:10.1001/jama.2008.717. PMID 19033591.
- Carlucci A, Guerrieri A, Nava S (December 2012). "Palliative care in COPD patients: is it only an end-of-life issue?". Eur Respir Rev. 21 (126): 347–54. doi:10.1183/09059180.00001512. PMID 23204123.
- "COPD — Treatment". U.S. National Heart Lung and Blood Institute. مؤرشف من الأصل في 27 أبريل 201223 يوليو 2013.
- Puhan MA, Gimeno-Santos E, Scharplatz M, Troosters T, Walters EH, Steurer J (2011). Puhan, Milo A (المحرر). "Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (10): CD005305. doi:10.1002/14651858.CD005305.pub3. PMID 21975749.
- Lacasse Y, Goldstein R, Lasserson TJ, Martin S (2006). Lacasse, Yves (المحرر). "Pulmonary rehabilitation for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD003793. doi:10.1002/14651858.CD003793.pub2. PMID 17054186.
- Ferreira IM, Brooks D, White J, Goldstein R (2012). Ferreira, Ivone M (المحرر). "Nutritional supplementation for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD000998. doi:10.1002/14651858.CD000998.pub3. PMID 23235577.
- van Dijk WD, van den Bemt L, van Weel C (2013). "Megatrials for bronchodilators in chronic obstructive pulmonary disease (COPD) treatment: time to reflect". J Am Board Fam Med. 26 (2): 221–4. doi:10.3122/jabfm.2013.02.110342. PMID 23471939.
- Liesker JJ, Wijkstra PJ, Ten Hacken NH, Koëter GH, Postma DS, Kerstjens HA (February 2002). "A systematic review of the effects of bronchodilators on exercise capacity in patients with COPD". Chest. 121 (2): 597–608. doi:10.1378/chest.121.2.597. PMID 11834677. مؤرشف من الأصل في 23 مارس 2017.
- Chong J, Karner C, Poole P (2012). Chong, Jimmy (المحرر). "Tiotropium versus long-acting beta-agonists for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 9: CD009157. doi:10.1002/14651858.CD009157.pub2. PMID 22972134.
- Karner C, Cates CJ (2012). Karner, Charlotta (المحرر). "Long-acting beta(2)-agonist in addition to tiotropium versus either tiotropium or long-acting beta(2)-agonist alone for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 4: CD008989. doi:10.1002/14651858.CD008989.pub2. PMID 22513969.
- Vestbo, Jørgen (2013). "Therapeutic Options" ( كتاب إلكتروني PDF ). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. صفحات 19–30.
- Cave, AC.; Hurst, MM. (May 2011). "The use of long acting β₂-agonists, alone or in combination with inhaled corticosteroids, in chronic obstructive pulmonary disease (COPD): a risk-benefit analysis". Pharmacol Ther. 130 (2): 114–43. doi:10.1016/j.pharmthera.2010.12.008. PMID 21276815.
- Spencer, S; Karner, C; Cates, CJ; Evans, DJ (Dec 7, 2011). Spencer, Sally (المحرر). "Inhaled corticosteroids versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews (12): CD007033. doi:10.1002/14651858.CD007033.pub3. PMID 22161409.
- Wang, J; Nie, B; Xiong, W; Xu, Y (April 2012). "Effect of long-acting beta-agonists on the frequency of COPD exacerbations: a meta-analysis". Journal of clinical pharmacy and therapeutics. 37 (2): 204–11. doi:10.1111/j.1365-2710.2011.01285.x. PMID 21740451.
- Decramer ML, Hanania NA, Lötvall JO, Yawn BP (2013). "The safety of long-acting β2-agonists in the treatment of stable chronic obstructive pulmonary disease". Int J Chron Obstruct Pulmon Dis. 8: 53–64. doi:10.2147/COPD.S39018. PMC . PMID 23378756.
- Nannini, LJ; Lasserson, TJ; Poole, P (Sep 12, 2012). Nannini, Luis Javier (المحرر). "Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 9: CD006829. doi:10.1002/14651858.CD006829.pub2. PMID 22972099.
- Karner C, Chong J, Poole P (2012). Karner, Charlotta (المحرر). "Tiotropium versus placebo for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- Cheyne L, Irvin-Sellers MJ, White J (Sep 16, 2013). Cheyne, Leanne (المحرر). "Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease". Cochrane Database of Systematic Reviews. 9 (9): CD009552. doi:10.1002/14651858.CD009552.pub2. PMID 24043433.
- Karner, C; Chong, J; Poole, P (Jul 11, 2012). Karner, Charlotta (المحرر). "Tiotropium versus placebo for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- Singh S, Loke YK, Furberg CD (September 2008). "Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (12): 1439–50. doi:10.1001/jama.300.12.1439. PMID 18812535.
- Singh S, Loke YK, Enright P, Furberg CD (January 2013). "Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications". Thorax. 68 (1): 114–6. doi:10.1136/thoraxjnl-2011-201275. PMID 22764216.
- Jones, P (Apr 2013). "Aclidinium bromide twice daily for the treatment of chronic obstructive pulmonary disease: a review". Advances in therapy. 30 (4): 354–68. doi:10.1007/s12325-013-0019-2. PMID 23553509.
- Cazzola, M; Page, CP; Matera, MG (Jun 2013). "Aclidinium bromide for the treatment of chronic obstructive pulmonary disease". Expert opinion on pharmacotherapy. 14 (9): 1205–14. doi:10.1517/14656566.2013.789021. PMID 23566013.
- Gartlehner G, Hansen RA, Carson SS, Lohr KN (2006). "Efficacy and Safety of Inhaled Corticosteroids in Patients With COPD: A Systematic Review and Meta-Analysis of Health Outcomes". Ann Fam Med. 4 (3): 253–62. doi:10.1370/afm.517. PMC . PMID 16735528.
- Shafazand S (June 2013). "ACP Journal Club. Review: inhaled medications vary substantively in their effects on mortality in COPD". Ann. Intern. Med. 158 (12): JC2. doi:10.7326/0003-4819-158-12-201306180-02002. PMID 23778926.
- Mammen MJ, Sethi S (2012). "Macrolide therapy for the prevention of acute exacerbations in chronic obstructive pulmonary disease". Pol. Arch. Med. Wewn. 122 (1–2): 54–9. PMID 22353707.
- Herath, SC; Poole, P (Nov 28, 2013). "Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD)". The Cochrane database of systematic reviews. 11: CD009764. doi:10.1002/14651858.CD009764.pub2. PMID 24288145.
- Simoens, S; Laekeman, G; Decramer, M (May 2013). "Preventing COPD exacerbations with macrolides: a review and budget impact analysis". Respiratory medicine. 107 (5): 637–48. doi:10.1016/j.rmed.2012.12.019. PMID 23352223.
- Barr RG, Rowe BH, Camargo CA (2003). Barr, R Graham (المحرر). "Methylxanthines for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (2): CD002168. doi:10.1002/14651858.CD002168. PMID 12804425.
- COPD Working, Group (2012). "Long-term oxygen therapy for patients with chronic obstructive pulmonary disease (COPD): an evidence-based analysis". Ontario health technology assessment series. 12 (7): 1–64. PMC . PMID 23074435.
- Bradley JM, O'Neill B (2005). Bradley, Judy M (المحرر). "Short-term ambulatory oxygen for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD004356. doi:10.1002/14651858.CD004356.pub3. PMID 16235359.
- Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A (2011). Abernethy, Amy (المحرر). "Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease". Cochrane Database Syst Rev (6): CD006429. doi:10.1002/14651858.CD006429.pub2. PMID 21678356.
- Chapman, Stephen (2009). Oxford handbook of respiratory medicine (الطبعة 2nd). Oxford: Oxford University Press. صفحة 707. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Blackler, Laura (2007). Managing chronic obstructive pulmonary disease. Chichester, England: John Wiley & Sons. صفحة 49. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Jindal, Surinder K (2013). Chronic Obstructive Pulmonary Disease. Jaypee Brothers Medical. صفحة 139. . مؤرشف من الأصل في 6 أكتوبر 2014.
- O'Driscoll, BR; Howard, LS; Davison, AG; British Thoracic, Society (October 2008). "BTS guideline for emergency oxygen use in adult patients". Thorax. 63 (Suppl 6): vi1–68. doi:10.1136/thx.2008.102947. PMID 18838559.
- Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA (2012). Vollenweider, Daniela J (المحرر). "Antibiotics for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD010257. doi:10.1002/14651858.CD010257. PMID 23235687.
- Jeppesen, E; Brurberg, KG; Vist, GE; Wedzicha, JA; Wright, JJ; Greenstone, M; Walters, JA (May 16, 2012). "Hospital at home for acute exacerbations of chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 5: CD003573. doi:10.1002/14651858.CD003573.pub2. PMID 22592692.
- "WHO Disease and injury country estimates". World Health Organization. 2009. مؤرشف من الأصل في 11 فبراير 201411 نوفمبر 2009.
- Murray CJ, Vos T, Lozano R, Naghavi M, Flaxman AD, Michaud C, Ezzati M, Shibuya K, Salomon JA. (December 2012). "Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2197–223. doi:10.1016/S0140-6736(12)61689-4. PMID 23245608.
- Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, Shibuya K, Salomon JA, Abdalla S, Aboyans V (December 2012). "Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2163–96. doi:10.1016/S0140-6736(12)61729-2. PMID 23245607.
- Medicine, prepared by the Department of Medicine, Washington University School of (2009). The Washington manual general internal medicine subspecialty consult (الطبعة 2nd). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. صفحة 96. . مؤرشف من الأصل في 6 أكتوبر 2014.
- "Chronic obstructive pulmonary disease (COPD) Fact sheet N°315". WHO. November 2012. مؤرشف من الأصل في 18 أبريل 2018.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R. (December 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- Rycroft CE, Heyes A, Lanza L, Becker K (2012). "Epidemiology of chronic obstructive pulmonary disease: a literature review". Int J Chron Obstruct Pulmon Dis. 7: 457–94. doi:10.2147/COPD.S32330. PMC . PMID 22927753.
- Simpson CR, Hippisley-Cox J, Sheikh A (2010). "Trends in the epidemiology of chronic obstructive pulmonary disease in England: a national study of 51 804 patients". Brit J Gen Pract. 60 (576): 483–8. doi:10.3399/bjgp10X514729. PMC . PMID 20594429.
- Centers for Disease Control and Prevention (Nov 23, 2012). "Chronic Obstructive Pulmonary Disease Among Adults — United States, 2011". Morbidity and Mortality Weekly Report. 61 (46): 938–43. PMID 23169314. مؤرشف من الأصل في 25 يونيو 2018.
- "Morbidity & Mortality: 2009 Chart Book on Cardiovascular, Lung, and Blood Diseases" ( كتاب إلكتروني PDF ). National Heart, Lung, and Blood Institute. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 19 أكتوبر 2013.
- Torio CM, Andrews RM (2006). "National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011: Statistical Brief #160". Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Agency for Health Care Policy and Research. PMID 24199255. مؤرشف من الأصل في 28 سبتمبر 2019.
- "Emphysema". Dictionary.com. مؤرشف من الأصل في 4 مارس 201621 نوفمبر 2013.
- Ziment, Irwin (1991). "History of the Treatment of Chronic Bronchitis". Respiration. 58 (Suppl 1): 37–42. doi:10.1159/000195969. PMID 1925077.
- Petty TL (2006). "The history of COPD". Int J Chron Obstruct Pulmon Dis. 1 (1): 3–14. doi:10.2147/copd.2006.1.1.3. PMC . PMID 18046898.
- Wright, Joanne L.; Churg, Andrew (2008). "Pathologic Features of Chronic Obstructive Pulmonary Disease: Diagnostic Criteria and Differential Diagnosis" ( كتاب إلكتروني PDF ). In Fishman, Alfred; Elias, Jack; Fishman, Jay; Grippi, Michael; Senior, Robert; Pack, Allan (المحررون). Fishman's Pulmonary Diseases and Disorders (الطبعة 4th). New York: McGraw-Hill. صفحات 693–705. .
- George L. Waldbott (1965). A struggle with Titans. Carlton Press. صفحة 6. مؤرشف من الأصل في 18 مايو 2016.
- Fishman AP (May 2005). "One hundred years of chronic obstructive pulmonary disease". Am. J. Respir. Crit. Care Med. 171 (9): 941–8. doi:10.1164/rccm.200412-1685OE. PMID 15849329.
- Yuh-Chin, T. Huang (2012-10-28). A clinical guide to occupational and environmental lung diseases. [New York]: Humana Press. صفحة 266. . مؤرشف من الأصل في 2 ديسمبر 2013.
- "Pink Puffer - definition of Pink Puffer in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia". Medical-dictionary.thefreedictionary.com. مؤرشف من الأصل في 6 نوفمبر 201823 يوليو 2013.
- Weinberger, Steven E. (2013-05-08). Principles of pulmonary medicine (الطبعة 6th). Philadelphia: Elsevier/Saunders. صفحة 165. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Des Jardins, Terry (2013). Clinical Manifestations & Assessment of Respiratory Disease (الطبعة 6th). Elsevier Health Sciences. صفحة 176. . مؤرشف من الأصل في 6 أكتوبر 2014.
- An outcomes strategy for people with chronic obstructive pulmonary disease (COPD) and asthma in England ( كتاب إلكتروني PDF ). وزارة الصحة والرعاية الاجتماعية. 18 July 2011. صفحة 5. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 23 يونيو 201727 نوفمبر 2013. نسخة محفوظة 23 يونيو 2017 على موقع واي باك مشين.
- Bloom, D (2011). The Global Economic Burden of Noncommunicable Diseases ( كتاب إلكتروني PDF ). World Economic Forum. صفحة 24. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 5 نوفمبر 2019.
- Nici, Linda (2011). Chronic Obstructive Pulmonary Disease: Co-Morbidities and Systemic Consequences. Springer. صفحة 78. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Inamdar, AC; Inamdar, AA (Oct 2013). "Mesenchymal stem cell therapy in lung disorders: pathogenesis of lung diseases and mechanism of action of mesenchymal stem cell". Experimental lung research. 39 (8): 315–27. doi:10.3109/01902148.2013.816803. PMID 23992090.
- Conese, M; Piro, D; Carbone, A; Castellani, S; Di Gioia, S (2014). "Hematopoietic and mesenchymal stem cells for the treatment of chronic respiratory diseases: role of plasticity and heterogeneity". TheScientificWorldJournal. 2014: 859817. doi:10.1155/2014/859817. PMC . PMID 24563632.
- Akers, R. Michael; Denbow, D. Michael (2008). Anatomy and Physiology of Domestic Animals. Arnes, AI: Wiley. صفحة 852. . مؤرشف من الأصل في 6 أكتوبر 2014.
- Wright, JL; Churg, A (December 2002). "Animal models of cigarette smoke-induced COPD". Chest. 122 (6 Suppl): 301S–6S. doi:10.1378/chest.122.6_suppl.301S. PMID 12475805.
- Churg, A; Wright, JL (2007). "Animal models of cigarette smoke-induced chronic obstructive lung disease". Contributions to microbiology. 14: 113–25. doi:10.1159/000107058. . PMID 17684336.
- Marinkovic D, Aleksic-Kovacevic S, Plamenac P (2007). "Cellular basis of chronic obstructive pulmonary disease in horses". Int. Rev. Cytol. 257: 213–47. doi:10.1016/S0074-7696(07)57006-3. . PMID 17280899.
- Miller MS, Tilley LP, Smith FW (January 1989). "Cardiopulmonary disease in the geriatric dog and cat". Vet. Clin. North Am. Small Anim. Pract. 19 (1): 87–102. PMID 2646821.