(maladie de Hansen)
| Causes | Mycobacterium leprae ou Mycobacterium lepromatosis (en) |
|---|---|
| Transmission | Transmission par contact (d) |
| Incubation min | 1 années |
| Incubation max | 20 années |
| Symptômes | Polyneuropathie, hypoesthésie (en), dépigmentation (en), paresthésie, fonte musculaire, contracture, mutilation, lagophtalmie, kératite, perforation septale (en), épistaxis et dystrophie |
| Traitement | Pharmacothérapie et antimicrobien (d) |
|---|---|
| Médicament | Clofazimine, dapsone, DL-ofloxacine, rifampicine, minocycline, azithromycine, clarithromycine et prednisolone |
| Spécialité | Infectiologie |
| CIM-10 | A30 |
|---|---|
| CIM-9 | 030 |
| OMIM | 246300 |
| DiseasesDB | 001347 |
| MedlinePlus | 001347 |
| eMedicine | 220455 |
| MeSH | C01.252.410.040.552.386 |
| Patient UK | Leprosy-pro |
![]() Mise en garde médicale
Mise en garde médicale
La lèpre /lɛpʁ/[2] (ou maladie de Hansen) est une maladie infectieuse chronique due à Mycobacterium leprae, une bactérie proche de l'agent responsable de la tuberculose, identifiée par le Norvégien Gerhard Armauer Hansen en . Celle-ci touche les nerfs périphériques, la peau et les muqueuses, en provoquant des infirmités sévères. Elle est endémique dans certains pays tropicaux (en particulier d'Asie). La lèpre est une maladie peu contagieuse.
La lèpre fut longtemps incurable et très mutilante, entraînant en France en , à la demande de la Société de pathologie exotique, « l'exclusion systématique des lépreux » et leur regroupement dans des léproseries comme mesure essentielle de prophylaxie.
La maladie est aujourd'hui traitable par antibiotiques ; des efforts de santé publique sont faits pour le traitement des malades, l'équipement en prothèses des sujets guéris et la prévention[3].
Causes et mécanismes
Agent causal
La lèpre est une infection chronique par la bactérie Mycobacterium leprae qui, comme les autres mycobactéries, est un bacille acido-alcoolo-résistant (BAAR), mis en évidence par la coloration de Ziehl-Neelsen.
M. leprae est à croissance lente, avec un temps de doublement estimé à 12 ou 13 jours[4]. C'est une bactérie obligatoirement intracellulaire, avec un tropisme particulier pour la peau et les cellules de Schwann des nerfs périphériques[5] ,[6].
La température optimum pour la croissance de M. leprae est de 27 à 33 °C, ce qui expliquerait sa préférence pour les zones les plus fraîches du corps (peau, nerfs périphériques et muqueuse nasale)[4].
M. leprae n'a jamais pu être cultivé in vitro, mais il peut être inoculé dans le coussinet plantaire de la souris ou chez le tatou à neuf bandes[5],[7] dont la température centrale habituelle est 34 °C[4].
En 2008, avec les nouvelles techniques de biologie moléculaire, une nouvelle espèce de mycobactérie a été découverte chez des lépreux du Mexique : Mycobacterium lepromatosis (en) qui donne aussi la lèpre (même maladie, même réaction aux traitements), indiscernable en microbiologie classique mais génétiquement différente pour constituer une deuxième cause de lèpre[8],[9],[7].
M. leprae et M. lepromatosis auraient divergé d'un ancêtre commun, il y a 10 à 14 millions d'années, soit par co-évolution (parasitisme intracellulaire des hominidés), soit par transmission plus récente au genre Homo, ce qui ferait de la lèpre la plus ancienne maladie infectieuse de l'humanité, à partir d'un endosymbiote devenu pathogène[10],[7].
Écoépidémiologie
Bien que des scientifiques (comme Indira Nath, en Inde) aient consacré leur vie à l'étude de cette maladie, « de nombreuses questions subsistent quant à son mode de transmission et à son épidémiologie »[11] ; l'épidémiologie de cette maladie est encore mal comprise. On a longtemps pensé que l'humain était l'hôte unique et obligatoire de cette bactérie, mais elle semble aussi avoir une composante zoonotique.
Premières observations
Les premières observations de lèpre ou pseudo-lèpre animale remontent au début du XXe siècle. Une lèpre du rat Rattus norvegicus a été décrite en 1903, due à Mycobacterium lepraemurium. Des lésions d'allure lépreuse ont été signalées chez le buffle, le chat, ou la grenouille[12]. La plupart de ces observations sont restées sans lendemain ou attribuées à des mycobactéries atypiques, en restant longtemps anecdotiques et de peu d'importance[13],[7].
Jusqu'aux années 1960, toutes les inoculations expérimentales de M. leprae aux animaux de laboratoire n'ont rien donné[12].
Tatous
En 1971, l'inoculation de M. leprae est réussie chez le Tatou à neuf bandes, qui présente alors une lèpre expérimentale ressemblant à la forme lépromateuse humaine. Le choix de cet animal a été motivé par sa longue durée de vie (12 à 15 ans), sa facilité d'élevage en captivité, sa température rectale basse (30 à 35 °C), ses défenses immunitaires naturellement faibles (propice à l'étude de nombreuses affections), et le fait que la femelle donne naissance à une portée de quatre jeunes homozygotes (génétiquement semblables, ce qui est précieux pour la recherche)[14].

D'autres espèces de tatous ont été expérimentées aux États-Unis et en Amérique du Sud, faisant du tatou l'animal de laboratoire de choix pour l'étude de la lèpre par obtention de quantités considérables de bacilles lépreux (qui restent incultivables in vitro)[14].
En 1975, les premiers cas de tatous sauvages atteints de lèpre en milieu naturel sont publiés[7]. Il s'est avéré depuis que 15 % des tatous sauvages de la Louisiane et du Texas ont été retrouvés porteurs de la maladie, laissant penser que cette mycobactérie a des besoins très spécifiques[11].
L'origine de cette lèpre des tatous sauvages a fait l'objet d'une controverse concernant un éventuel accident de laboratoire. Les études tendent à montrer que cette lèpre sauvage du sud des États-Unis a précédé la lèpre expérimentale[7]. Elle daterait d'une immigration norvégienne du XVIIIe et XIXe siècles (où sévissait une épidémie de lèpre), les tatous s'infectant au contact de lépreux[15].
Écureuil roux
À partir de 2014, au Royaume-Uni, des études génomiques, histopathologiques et sérologiques, identifient les deux agents pathogènes de la lèpre, M. leprae et M. lepromatosis, dans des excroissances verruqueuses de la face et des extrémités chez l'écureuil roux (Sciurus vulgaris)[16],[7].

Cette découverte est inattendue, d'abord parce que la lèpre était considérée comme exclusivement humaine (à l'exception du tatou), et ensuite parce qu'on pensait que la lèpre avait disparu du Royaume-Uni[7].
Les souches de M. leprae isolées des écureuils roux sont les mêmes que celles de la lèpre médiévale d'Angleterre et du Danemark, et elles sont très proches de celle des tatous du sud des États-Unis. Le commerce médiéval de la fourrure d'écureuil aurait pu jouer un rôle dans la transmission de la lèpre entre humains et écureuils[7].
L'écureuil roux est une espèce en forte régression en Angleterre face à l'avancée de l'écureuil gris (espèce introduite d'Amérique du Nord et devenue invasive). L'écureuil roux pourrait être l'un des réservoirs animaux du bacille[16]. L'étude de cette maladie chez l'écureuil permettrait de mieux comprendre l'Éco-épidémiologie, la biologie et l'épidémiologie de la lèpre[11].
À la date de 2020, malgré plusieurs études de surveillance, aucune infection à M. leprae n'a été retrouvée chez des écureuils ou autres rongeurs sauvages en dehors du Royaume-Uni (Europe continentale, Sibérie, Mexique)[17],[7].
Primates non-humains

a, gros nodules hypopigmentés sur tout le corps ; défiguration et lésions sur les oreilles, main et des pieds (avec lésions ulcérées et gonflement).
b, Lésions en plaques sur tous les membres + perte de pilosité.
c, Gros nodules hypopigmentés sur la face, défiguration extrême du visage et des oreilles, plaques ulcérées sur les bras et mamelons.
d–g, Signes cliniques chez un chimpanzé mâle adulte :
d, Multiples nodules hypopigmentés sur oreilles, arcades sourcilières, bord des paupières, narines, lèvres et entre la lèvre supérieure et le nez.
e, Hypopigmentation et gonflement des mains avec ulcérations et perte de pilosité sur la face dorsale des articulations.
f, Main : perte d'ongles et croissance anormale d'ongles.
g, rougeur et ulcération du scrotum avec sang frais
En 1977, des lésions à type de lèpre sont signalées chez un chimpanzé (Pan troglodytes) en captivité, il s'avère par la suite qu'il s'agissait bien d'une infection à M. leprae[7].
Des études ultérieures rapportent cette même infection chez d'autres singes en captivité, comme le mangabey fuligineux (Cercocebus atys) et le macaques cynomolgus (Macaca fascicularis)[18],[19]. L'origine exacte de leur contamination est incertaine (acquise en captivité ou avant, en milieu sauvage)[7].
En 2021, la lèpre est décrite directement en milieu sauvage, chez deux groupes géographiquement très éloignés de chimpanzés (Pan troglodytes verus), respectivement dans le parc national de Cantanhez (Guinée-Bissau) et dans le parc national de Taï (Côte d'Ivoire). Ces deux groupes ont été surveillés, mettant en évidence une progression des symptômes évoquant une « lèpre avancée »[20].
Le microbe a été retrouvé dans les excréments de ces animaux, et des autopsies ont confirmé la présence de M. leprae comme cause des symptômes. Une étude phylogénomique a comparé ces souches avec d'autres souches humaines et animales ; montrant qu'elles appartiennent à deux génotypes différents, et rares (4N/O et 2F). On avait donc sous estimé la circulation du bacille de la lèpre chez les animaux sauvages à la suite d'une contamination par l'homme ou par d'autres modes de transmissions mal connus, notamment environnementaux[20].
Présence environnementale
Depuis la fin du XXe siècle, des études indiquent la possibilité pour M. leprae de survivre dans le milieu extérieur (en dehors de son hôte mammifère) dans certaines conditions. M. leprae peut être présent dans le sol ou l'eau, notamment en s'associant avec des amibes libres telles que Acanthamoebae[7].
Des études expérimentales cherchent à établir la possibilité de transmission par insectes vecteurs tels que la punaise Rhodnius prolixus, les moustiques Aedes aegypti et Culex quinquefasciatus, ou la tique Amblyomma sculptum[7].
Transmission
La transmission de Mycobacterium leprae est mal connue, mais la transmission interhumaine est la principale. Elle se fait via les voies aériennes supérieures par inhalation de « postillons » d'un lépreux atteint de lèpre lépromateuse. Les patients non traités, atteints de ce type de lèpre, hébergent un grand nombre de M. leprae dans leur muqueuse nasale, les sécrétions nasales, la salive, les lésions cutanées (d'où le nom de formes multibacillaires)[6].
La transmission se fait également au contact d'ulcérations ou de plaies cutanées, enfin par l'intermédiaire d'objets souillés : linge, natte, oreillers…
Selon ses formes clinique, la lèpre peut être non ou peu contagieuse. C'est le cas de la lèpre tuberculoïde, notamment à lésion unique ou peu nombreuse (formes dites paucibacillaires)[6].
La transmission héréditaire[21] n'existe pas, mais une transmission congénitale semble possible (la transmission congénitale n'a été observée que chez le tatou à neuf bandes (Dasypus novemcinctus)[22].
En 2011, une étude suggère qu'une transmission serait possible du tatou à l'être humain[23], ainsi qu'un cas de patient - ancien chasseur de tatous - ayant développé la maladie en 2019 (rapporté par des médecins dans le British Medical Journal[24]).
Les facteurs de risques facilitant la transmission sont[4] :
- Contacts étroits et durables au cours d'une promiscuité de type familial ;
- exposition au tatou à neuf bandes (chasseur de tatou, consommateur de viande de tatou) ;
- l'âge, la période d'incubation, exceptionnellement longue (plusieurs années), explique que lorsque la maladie se contracte durant la petite enfance, elle apparait chez les grands enfants ou chez les jeunes adultes, puis un deuxième pic survient à partir de l'âge de 30 ans (risque continu avec l'âge) ;
- influence génétique, selon les caractéristiques individuelles de l'immunité innée. Cette influence parait déterminante, quelle que soit la distance et la durée des contacts (par exemple la lèpre conjugale est peu fréquente[13]) ;
- immunodépression, le risque de contracter la lèpre est augmenté après traitement immunosuppresseur, transplantation d'organe, chimiothérapie, infection au VIH.
Pathogénie
La lèpre étant causée par une bactérie intracellulaire, l'immunité humorale par anticorps circulants (immunoglobulines) n'est guère utile pour combattre l'infection. La principale défense contre la lèpre est l'immunité cellulaire faisant appel aux lymphocytes T[25].
Si cette immunité cellulaire est peu développée (enfants de moins de deux ans) ou compromise (femmes enceintes…) le risque de développer une lèpre (à exposition égale) est plus élevé. On connaît mal les facteurs qui déclenchent la survenue des manifestations lépreuses[25].
Globalement, lors d'une exposition à M. leprae, seule une minorité de sujets estimée à 5 % sont susceptibles de développer une lèpre-maladie[26]. La maladie est probablement acquise dans l'enfance, pour apparaître tardivement sous des formes indéterminées, puis elle est le plus souvent diagnostiquée chez l'adulte, selon des formes modulées par la réponse immunitaire (efficacité plus ou moins grande de l'immunité cellulaire, en particulier des lymphocytes T)[6].
Schématiquement, la lèpre se manifeste sous deux formes : la forme tuberculoïde (en cas de bonne immunité) dans 60 % des cas, et la forme lépromateuse (en cas de faible immunité) dans 40 % des cas[5].
- Dans la forme tuberculoïde, la dissémination du germe semble limitée (lèpre paucibacillaire – avec peu de bactéries –) et la biopsie de la peau montre une prédominance de lymphocytes CD4+ et un milieu riche en interleukine 2 et en interféron gamma ;
- dans la forme lépromateuse, la dissémination du bacille est beaucoup plus importante (lèpre multibacillaire – avec bactéries nombreuses – et la biopsie de peau montre une présence prédominante de lymphocytes CD8+ et d'autres cytokines[27].
Cette différence de réponse pourrait être due à une susceptibilité d'ordre génétique chez l'hôte, certaines mutations de type polymorphisme nucléotidique simple étant plus fréquentes sur certains gènes intervenant dans les réactions immunitaires[28].
Endémisme, répartition
Une chute spectaculaire à la fin du XXe siècle
Dans les années 1980, le nombre de lépreux dans le monde était estimé à 11,5 millions, dont 5 millions de cas enregistrés. Plus d'un milliard de personnes vivaient dans une région endémique (prévalence supérieure à 1 lépreux pour mille habitants). Ces régions les plus touchées sont des régions tropicales, surtout l'Asie des moussons (principalement l'Inde avec 4 millions de lépreux), l'Afrique tropicale et le Brésil[29].
En France, selon une estimation, près d'un millier de lépreux étaient suivis en métropole dans les années 1970[30], la moitié étant des immigrants en provenance de pays d'endémie, l'autre moitié des personnes de la France d'Outremer[29].
Avec la mise en place de la multithérapie (association de 3 médicaments) à l'échelle mondiale, la lèpre a été éliminée comme problème de santé publique dans 119 pays où elle était endémique. Le taux de prévalence a chuté de 90 %, passant de 21 cas pour 10 000 habitants en 1985 à moins de 1 en 2000[31],[32].
En quatre décennies (1980-2020), plus de 17 millions de lépreux ont eu accès à la multithérapie[33].
Une phase de plateau depuis le début du XXIe siècle
Depuis 2005, la situation mondiale connait une phase de stagnation, oscillant entre 200 000 et 250 000 nouveaux cas par an[26],[32].

En 2016, l’Organisation mondiale de la santé recensait 216 108 nouveaux cas de lèpre dans le monde[34] (la France compte 250 cas déclarés, tous originaires de l'outre-mer ou des zones d’endémie)[35].
En , 83 % de la prévalence mondiale et 88 % des nouveaux cas se concentraient dans 6 pays : Brésil, Inde, Indonésie, Mozambique, Népal, et République Démocratique du Congo[36].
En 2021, l'Organisation mondiale de la santé (OMS) fait état de 141 pays rapportant 140 594 nouveaux cas, dont 9052 enfants de moins de 15 ans, soit 4,5 nouveaux cas de lèpre par million d'enfants[37]. Ces chiffres officiels sont à corriger du fait de la pandémie de Covid-19 qui perturbe la lutte contre la lèpre et la déclaration des nouveaux cas[37] (la réduction de 37 % en 2020 par rapport à 2019 serait liée une insuffisance de surveillance)[38].
En dépit des efforts de contrôle, la lèpre reste endémique dans de nombreux pays en développement. En 2021, l'Inde, le Brésil et l'Indonésie restent les trois pays qui rapportent le plus de nouveaux cas (74,5 % des nouveaux cas mondiaux)[37].
Le taux d'incidence élevé chez les enfants de moins de 15 ans indique que la population des pays endémiques reste exposée au M. leprae, avec une forte transmission, dans un cadre sanitaire de faible qualité[32].
Classifications
Il existe différents types de lèpre, réalisant un ensemble continu de formes intermédiaires entre deux extrêmes. Plusieurs classifications sont proposées et discutées tout au long des conférences internationales de léprologie qui se succèdent, depuis les années 1930 jusqu'aux années 1950[39].
Classification de Ridley et Jopling
Proposée en 1962, et révisée en 1974, c'est la classification longtemps utilisée. Elle se base sur des critères cliniques, histologiques et de réponses aux traitements. Schématiquement, elle distingue trois formes cliniques, deux formes extrêmes dites polaires : la lèpre tuberculoïde et la lèpre lépromateuse, et un ensemble de formes intermédiaires dites interpolaires, instables et susceptibles de se modifier dans un sens ou dans l'autre[29]. Son inconvénient majeur est dû aux critères histologiques qui rendent son application difficile dans les pays en développement, faute de moyens et de personnel pour réaliser ces examens de laboratoire[29].
Classification de l'OMS
En 1982, l'OMS adopte une nouvelle classification (révisée en 1988)[29] plus opérationnelle, c'est-à-dire plus pragmatique et adaptée aux pays d'endémie et de transmission de la lèpre[6]. Cette classification fait surtout appel à des critères cliniques dans le but de mieux standardiser et réglementer la thérapeutique. Les formes de lèpre sont classées en deux catégories[6] :
- Formes paucibacillaires, ≤ 5 lésions cutanées et/ou ≤ 1 nerf atteint, correspondant aux formes tuberculoïdes ;
- Formes multibacillaires, ≥ 6 lésions cutanées et/ou plusieurs nerfs atteints, correspondant aux formes lépromateuse et intermédiaires.
Formes cliniques
La lèpre est l'une des rares maladies qui présente des lésions dermatologiques avec troubles neurologiques (troubles de la sensibilité cutanée). Elle se distingue aussi par des signes négatifs : absence de prurit, de squames et de vésicules[40].
Début
L'incubation est de 5 ans en moyenne (extrêmes : de quelques mois à plusieurs décennies)[6].
Le stade initial se présente sous la forme d'une lèpre indéterminée. Elle se manifeste par une tache cutanée légèrement décolorée, de quelques cm de diamètre, à limites floues avec de légers troubles de la sensibilité. Cette lésion peut disparaître spontanément ou évoluer vers les autres formes[5].
La lèpre de l'enfant est le plus souvent une lèpre indéterminée[5].
Lèpre tuberculoïde
Cette forme de lèpre est la plus fréquente. Elle associe :
- de grandes taches dépigmentées sur la peau, qui est devenue insensible au toucher, à bords nets, uniques ou en petit nombre, de répartition asymétrique[5] ; quand leur bordure est en relief infiltré, ce sont des léprides[41].
- des troubles nerveux touchant les membres, avec troubles de la sensibilité cutanée (anesthésie). En l'absence de traitement, les anomalies cutanées situées sur le territoire innervé par un nerf atteint peuvent évoluer vers des ulcères, maux perforants, paralysies et mutilations[6].
Ces patients ne sont pas contagieux, la charge en bacilles des lésions est nulle ou faible : on ne trouve pas de bacilles dans le suc dermique du lobule des oreilles, pas ou très peu dans la biopsie de peau. Il existe une réponse d'immunité cellulaire avec des lymphocytes circulants qui reconnaissent Mycobacterium leprae[6].
Avec un traitement précoce, les lésions initiales peuvent disparaître sans cicatrice[5].
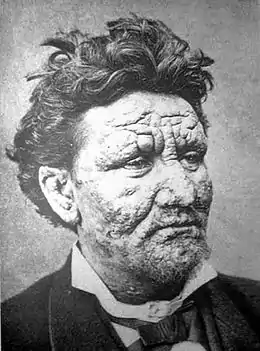
Lèpre lépromateuse
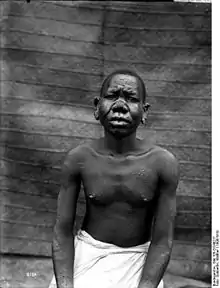
.jpg.webp)
La lèpre lépromateuse est une maladie générale, c'est-à-dire qui touche plusieurs systèmes et organes, mais où les lésions cutanées et muqueuses prédominent.
Atteintes cutanées
L'atteinte cutanée réalise des macules hypochromiques discrètes, à contours flous. En l'absence de traitement, apparaissent des lésions typiques, les lépromes, qui sont des plaques, papules ou nodules infiltrés, à bordure diffuse et mal limitées, de teinte cuivrée luisante, de sensibilité normale (sans anesthésie)[5],[6].
Ces lésions cutanées sont nombreuses (plusieurs dizaines), réparties sur tout le corps de façon plutôt bilatérale et symétrique. L'atteinte des extrémités (doigts, orteils) et du visage est préférentielle. Dans les formes évoluées, les atteintes du visage réalisent une infiltration diffuse du nez et du lobule des oreilles (faciès léonin) avec congestion nasale, épistaxis, et alopécie de la queue des sourcils[5],[6].
Atteintes nerveuses et viscérales
Dans la lèpre lépromateuse, l'atteinte des nerfs périphériques est plus discrète que dans la lèpre tuberculoïde. Elle associe à des degrés divers une hypertrophie des troncs nerveux et des déficits neurologiques sensitifs ou moteurs.
Outre les atteintes des muqueuses oto-rhino-laryngologiques et ophtalmologiques, une atteinte viscérale ou multiviscérale est possible : envahissement ganglionnaire, atteintes rénale, hépatosplénique, endocrinienne, urogénitale avec risque de stérilité[6],[42], etc.
Ces patients sont contagieux (multibacillaires) et dépourvus d'immunité cellulaire vis-à-vis de Mycobacterium leprae.
Lèpre intermédiaire
Entre les deux formes précédentes bien caractérisées, se situe un véritable spectre de formes dites intermédiaires, interpolaires, de transition ou « borderline » pour lesquelles les réactions de défense sont instables et variables, et susceptible d'évoluer vers l'une ou l'autre des extrémités du spectre.
Dans la classification de Ridley et Jopling, trois formes de transition sont distinguées[5] :
- Forme borderline tuberculoïde ou BT : quelques lésions cutanées de grande taille (de 5 à plus de 20 cm) planes ou infiltrées en périphérie, asymétriques avec troubles de la sensibilité et lésions plus petites à proximité ;
- forme borderline borderline ou BB : plusieurs lésions de type annulaire, de 5 à 10 cm de diamètre, mal limitées, pour la plupart anesthésiques en leur centre[43] et non anesthésiques en périphérie ;
- forme borderline lépromateuse ou BL : plus d'une dizaine de lépromes et de lésions annulaires, bilatérales et non anesthésiques.
Par rapport à la classification OMS, la forme BT est une forme paucibacillaire, alors que les formes BB et BL sont multibacillaires[43].
Atteinte neurologique
L'atteinte neurologique est constante dans toutes les formes de lèpre, c'est elle qui détermine le pronostic de la maladie. La lèpre touche principalement les nerfs périphériques réalisant une névrite lépreuse. Le Mycobacterium leprae, à tropisme neurologique, se multiplie dans la cellule de Schwann et s'infiltre dans les tissus. À terme, le territoire innervé par le nerf atteint subit des troubles de la nutrition tissulaire (troubles trophiques, dits neurotrophiques)[5],[44].

La névrite lépreuse touche d'abord les filets nerveux cutanés, avec troubles des sensibilités superficielles au niveau des macules ; puis elle atteint les gros troncs nerveux périphériques. C'est une névrite hypertrophique où le nerf atteint augmente de volume, en devenant visible quand il est superficiel ou palpable lorsqu'il est plus en profondeur[44].
Cette hypertrophie débute dans la première année d’évolution de la maladie. Elle est à rechercher au niveau du cubital, du médian, du sciatique poplité externe (SPE), du tibial postérieur (TP), du plexus cervical superficiel.
Au fil des années, une polynévrite douloureuse déficitaire se constitue. Le déficit touche d’abord la sensibilité thermo-algique, puis la conduction motrice avec déficit moteur (parésie puis paralysie), amyotrophie, et troubles trophiques… L’expression clinique neurologique indique que 30 % des fibres nerveuses sont atteintes par le bacille de Hansen.
En général la chronologie des troubles neurologiques se présente ainsi :
- anesthésie, troubles trophiques ;
- fissures, plaies, brûlures ;
- infection ostéoarticulaire ;
- diminution de la surface d’appui ;
- cicatrices adhérentes ;
- amputation, mutilation, perte de substance…

Les nerfs les plus touchés sont [5] :
- des nerfs crâniens (nerf frontal et nerf facial) : atteintes oculaires jusqu'à la cécité, atteintes oropharyngées entraînant des difficultés pour l’alimentation, l’élocution et donc des difficultés d’ordre psychosocial. Chez les malades anciens non traités, la paralysie faciale devient bilatérale réalisant le faciès antonin (visage figé et inexpressif, yeux fixes restant ouverts pendant le sommeil, bouche inerte et baveuse)[44].
- du membre supérieur : cubital et médian (main en griffe ou « de singe »), radial (main tombante avec impossibilité de la relever).
- du membre inférieur : sciatique poplité externe et tibial postérieur (pied tombant, steppage à la marche, griffe des orteils ou orteils en marteau). Dans un second temps, des rétractions tendineuses peuvent immobiliser le pied dans une mauvaise attitude, réalisant le pied bot lépreux[5],[44].
Il existe des formes neurologiques « pures » (moins de 10 % des cas de lèpre) avec absence de lésions cutanées. Elles doivent être suspectées chez des patients exposés (résidant ou provenant de région endémique de lèpre) présentant une neuropathie asymétrique. La manifestation la plus commune étant la griffe cubitale[6].
États réactionnels
La lèpre est une maladie chronique d'évolution insidieuse, mais qui peut présenter des « états réactionnels » de survenue brutale. Il s'agit de complications inflammatoires aiguës, liées à des modifications immunologiques (hypersensibilité) vis-à-vis de M. leprae. Ces complications peuvent survenir spontanément au cours de l'évolution de la maladie lépreuse, ou lors du traitement, voire au décours de celui-ci[5],[6].
Plusieurs types de réaction ont été décrits au XXe siècle, amenant une situation confuse[45]. Au début du XXIe siècle, deux principaux types de réaction sont distingués : les réactions de type 1 (ou réaction de réversion) et celles de type 2 (ou érythème noueux lépreux)[4],[6].
Réaction de réversion
Il s'agit d'un phénomène d'hypersensibilité retardée où l'immunité cellulaire est renforcée, mais de manière disproportionnée. Cette réaction peut survenir chez les patients atteints de lèpre intermédiaire qu'elle déplace vers le pole tuberculoïde. Elle peut toucher 15 à 45 % de ces patients, principalement dans les premiers mois de traitement, et aussi après des mois ou des années après l'arrêt du traitement[5],[6].
Elle se manifeste par une majoration brutale des lésions déjà connues, avec troubles moteurs et sensitifs rapidement déficitaires. Cette réaction est plus fréquente chez les lépreux co-infectés par le VIH[6].
Érythème noueux lépreux
L'érythème noueux lépreux, ou réaction de type 2, s'observe chez environ la moitié des patients présentant une lèpre lèpromateuse ou une borderline lépromateuse. Cette réaction, dont le mécanisme est mal compris et discuté, serait de l'ordre d'une maladie à complexes immuns avec élévation du TNF-α dans le sérum[4],[5].
Elle peut apparaitre en début de traitement, ou survenir spontanément avant le traitement, facilitant le diagnostic, ou elle peut survenir jusqu'à 10 ans après le traitement. Elle évolue par poussées en relation avec une infection intercurrente, la puberté, la grossesse ou l'allaitement[4],[5].
Elle se manifeste par de la fièvre, des douleurs articulaires et cutanées (nodules chauds violacés évoluant en pustule purulente) et des atteintes viscérales potentiellement létales[4],[6].
Un phénomène analogue, beaucoup plus rare, est le Phénomène de Lucio (en) qui se voit surtout au Mexique et en Amérique Latine, chez les métis indien-espagnol. Il se manifeste comme une vascularite nécrosante survenant brutalement dans une forme particulière de lèpre lèpromateuse inaperçue ou ignorée, dite parfois « lèpre jolie » ou « lepra bonita »[4],[46].
Invalidité
L'invalidité ou handicap lépreux est liée aux complications ultimes et séquelles de toutes formes de lèpre. Outre les atteintes cutanéo-muqueuses et neurologiques, il existe des lésions osseuses destructives (ostéoporose diffuse, ostéolyse latérale ou frontale) prédominant aux doigts et aux orteils et aboutissant à des mutilations[47].
Ces complications peuvent être invisibles (conséquences psychosociales, maladie taboue) et visibles (mutilations, déformations, paralysie). En 1995, le nombre de sujets handicapés par la lèpre était estimé à 2 millions de personnes dans le monde. L’OMS s'est fixé pour but de réduire ce handicap à moins d'une personne par million d'habitants[48].
L’OMS se base surtout sur les atteintes oculaires et neurologiques pour établir un score d’invalidité, avec détection et prévention précoce des lépreux les plus à risque d'être handicapés. Ces personnes sont surtout des hommes, atteints de lèpre multibacillaire, avec états réactionnels évoluant vers la lèpre lépromateuse (avec un risque de handicap 5 à 12 fois supérieur aux autres lépreux)[48].
La différence homme/femme ( 2 hommes pour 1 femme) s'expliquerait par une différence de comportement social. Les hommes négligent ou ignorent les premières manifestations cutanées de lèpre et ne consultent les services de santé qu'à des stades avancés de la maladie, ce qui ne serait pas le cas des femmes, plus attentives à toute modification cutanée[48].
La prévalence du handicap lépreux augmente avec l'âge, et de façon inversement proportionnelle au niveau socio-économique. Les niveaux d'éducation et de revenu sont des facteurs déterminants pour la prévention de cette invalidité[48].
Diagnostic
La variété des formes de lèpre fait que le diagnostic peut concerner le généraliste comme de nombreux spécialistes : dermatologue, neurologue, ophtalmologiste et otorhinolaryngologiste[40].
Comme déjà indiqué, la lèpre se distingue par l'association de lésions dermatologiques et de troubles neurologiques (troubles de la sensibilité cutanée). Elle se distingue aussi par des signes négatifs : absence de prurit, de squames et de vésicules.
Les signes cutanés sont présents dans la plupart des lèpres, mais pas toutes, alors que les atteintes neurologiques sont présentes dans toutes les variétés de lèpre, à des degrés divers (prédominantes ou au second plan). Il existe des formes de lèpre neurologique « pure » où les signes cutanés sont totalement absents[40].
Dans les pays développés, le diagnostic est évoqué sur l'origine du patient, ou son retour de voyage en zone endémique[32].
Dans les formes multibacillaires, le diagnostic est confirmé par la présence de M. leprae, dans les autres formes (où M. leprae n'est pas ou difficilement retrouvé), il faut mettre en évidence l'existence de troubles neuro-cutanés car la lèpre est pratiquement la seule affection qui présente de tels troubles associés[40]. Une anesthésie localisée au niveau d'une lésion cutanée est pathognomonique de la lèpre tuberculoïde[6].
Les experts de l'OMS ont établi trois principaux critères de diagnostic positif[32] :
- Lésion cutanée hypopigmentée ou érythémateuse avec perte définitive de la sensibilité cutanée ;
- une hypertrophie d'un nerf périphérique avec perte de la sensibilité ou faiblesse musculaire de la zone innervée ;
- Présence de bacilles acido-alcoolo-résistants dans la biopsie cutanée ou le frottis nasal.
Lorsque les trois signes sont présents, la précision du diagnostic est de l'ordre de 95 %[32].
Diagnostic différentiel
Le diagnostic différentiel des lésions cutanées est difficile dans les formes débutantes. Il dépend en grande partie de l'expérience du clinicien[32].
À évoquer devant des lésions hypochromiques[5] :
- Eczéma ;
- pityriasis versicolor ;
- dermite séborrhéique ;
- vitiligo (mais il n’y a jamais d’achromie dans la lèpre) ;
- hypomélanose idiopathique du sujet âgé (en gouttes) ;
- dyschromie créole (physiologique chez les métis) ;
- dépigmentation par dermocorticoïdes (y penser chez les Africaines).
À évoquer devant des lésions érythémateuses et infiltrées[5], ou papuleuses :
- Dermatophytose ;
- érythème annulaire ;
- parapsoriasis en plaque ;
- pityriasis rosé de Gibert ;
- syphilis secondaire ;
- lupus érythémateux ;
- sarcoïdose (biopsie) ;
- neurofibromatose ;
- leishmaniose cutanée ;
- pian ;
- sporotrichose ;
- Maladie de Kaposi.
Le diagnostic de lèpre pour des troubles neurologiques peut être difficile en l'absence de lésions cutanées associées. De telles lésions lépreuses peuvent être confondues avec des névrites d'origine diabétique ou alcoolique[6]. La lèpre peut simuler de nombreuses autres affections neurologiques plus rares. Selon Languillon, les principes de base sont[49] :
- Les hypertrophies de nerfs sont généralement dues à la lèpre ;
- les paralysies de la racine des membres ne sont pas dues à la lèpre (qui touche les extrémités) ;
- il n'y a jamais de perte du sens de la position corporelle dans la lèpre ;
- le système nerveux central demeure indemne dans la lèpre.
Diagnostic bactériologique
Il permet la confirmation diagnostique par mise en évidence du Mycobacterium leprae ou bacille de Hansen. Sa négativité n’élimine pas le diagnostic, mais sa recherche est importante pour les formes borderline, pour adapter le traitement (patient pauci- ou multibacillaires), et diagnostiquer les rechutes.
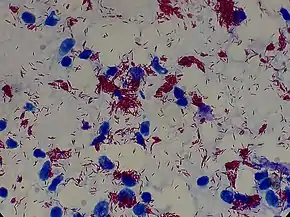
La coloration de Ziehl-Neelsen permet de visualiser le M. leprae à partir de trois prélèvements[6] :
- produits de raclage de la muqueuse du nez ( frottis nasal d'une rhinite lépreuse) obtenus par écouvillonnage nasal.
- suc dermique des lobules des oreilles ;
- cellules de lésions cutanées obtenues par biopsie profonde.
La bacilloscopie évalue le nombre et l'aspect morphologique des bacilles[5] :
- L'indice bactériologiques (IB) est la charge bacillaire ou nombre de bacilles par champ (pour le principe voir hématimètre). Cet indice est coté de 0 à 6, 1+ (1 à 10 bacilles/100 champs) à 6+ (> 1 000 bacilles /champ).
- L'indice morphologique (IM) détermine le pourcentage de bacilles viables (bacilles entiers uniformément colorés), ce qui permet d'évaluer le degré de contagiosité d'un patient, et prendre d'éventuelles mesures de protection de ses contacts[50].
Cette bacilloscopie n'est fiable qu'entre les mains de techniciens expérimentés, devenus de plus en plus rares. Ce manque de fiabilité a conduit l'OMS à abandonner la classification bacilloscopique pour adopter des critères plus simples[6]. Cependant cet examen reste une méthode importante pour un diagnostic précis des formes de lèpre[32].
Autres moyens
L’intradermoréaction (IDR) de Mitsuda (1876-1964) est plus ou moins abandonnée, à cause de son manque de précision. Elle consistait à inoculer, au niveau de l'avant-bras, des antigènes de M. leprae inactivé (lépromine), et à interpréter la réaction cutanée après 1 à 2 jours, puis après 21 jours[5],[32].
La sérologie lépreuse, considérée comme prometteuse dans les années 1980, n'est toujours pas de pratique courante en 2020[6]. Elle se base principalement sur la détection d'anticorps anti-GPL-1 (pour Phenolyc glycolipid 1, antigène spécifique de la paroi de M. leprae)[32].
La PCR est effectuée selon les laboratoires. Elle n'est pas indispensable car cette méthode n'est pas plus sensible que la coloration de Ziehl-Neelsen[6].
D'autres moyens sont utilisés, notamment pour le diagnostic de lèpre neurologique pure (sans lésions cutanées, ni mise en évidence de M. leprae) : biopsie nerveuse (nerf périphérique), électromyographie, échographie (nerf périphérique)[32].
Centres de dépistage à Paris :
- CHU Bichat-Claude Bernard,
- La Pitié-Salpétrière,
- Institut Pasteur,
- Hôpital Saint-Louis
Traitement
Anciens traitements
Un des premiers traitements fut l'huile de chaulmoogra extraite des graines du taraktogenus hydnocarpii. L'isolation de l'acide chaulmoogrique avait été faite par Alice Ball en 1916 et perfectionnée ensuite par Arthur Dean[51]. Cependant cette huile avait l'inconvénient d'être chère et de faire éclater les seringues. Le dermatologue Édouard Jeanselme a préconisé un mélange d’huile de chaulmoogra, de camphre et de guaïacol comme traitement contre la lèpre.
Dans les années 1930, le père Clément Raimbault découvrit les effets de l'huile dolno, produite à partir de graines de takamaka des Hauts (Calophyllum tacamahaca), arbre courant à La Réunion.
Traitements actuels
La lèpre expose à des invalidités sévères et des handicaps permanents si elle n'est pas traitée à temps. Le traitement comporte plusieurs antibiotiques, afin d'éviter de sélectionner des souches résistantes du germe. L’Organisation mondiale de la santé (OMS) recommande depuis 1982 une multithérapie ou polychimiothérapie (PCT), car Mycobacterium leprae développe des résistances en cas de monothérapie (par dapsone seule)[4].
Traitements de référence
Cette PCT associe trois médicaments : la dapsone (DDS), la rifampicine (RMP) et la clofazimine (CLO). Ces trois antibiotiques constituent le traitement de référence de l'OMS (traitement de première ligne ou en première intention). L'administration mensuelle est sous supervision (S) médicalisée[32].
| Forme de lèpre | Traitement de référence chez l'adulte (OMS 2012)[5],[32] |
|---|---|
| Paucibacillaire | RMP 600 mg par mois (S) + DDS 100 mg par jour. Durée 6 mois |
| Multibacillaire | RMP 600 mg/mois (S) + CLO (300 mg/mois (S) et 50 mg/j) + DDS 100 mg/j. Durée 12 mois |
Cette association médicamenteuse détruit l'agent pathogène et guérit le malade. La durée du traitement oscille entre 6 et 24 mois, selon la gravité de la maladie. Cette longue durée de traitement pose des problèmes logistiques et des difficultés d'observance thérapeutique. Son efficacité peut aussi être limité par des effets secondaires non négligeables (mauvaise tolérance et/ou allergie)[32].
Dans les pays industrialisés, ce schéma thérapeutique est préconisé de façon quotidienne, et fondé sur la classification de Ridley avec possibilité d'une durée de traitement plus longue si nécessaire (traitement adapté avec plus de précision, par plus de moyens disponibles)[5],[32]. Avec les traitements bien individualisés, la chimiorésistance est exceptionnelle[6].
En cas d'inefficacité ou de mauvaise tolérance, d'autres produits sont utilisés en seconde intention, principalement : Ofloxacine, Minocycline et Clarithromycine[6],[32].
Traitements des complications et séquelles
Les états réactionnels sont des urgences thérapeutiques, le plus souvent hospitalisées. Les réactions de réversion nécessitent un anti-inflammatoire non stéroïdien, ou une corticothérapie, ou la ciclosporine, selon la gravité des troubles. Les poussées d'érythème noueux lépreux sont traitées par thalidomide (sous couvert d'une contraception) ou par la pentoxifylline. Si les troubles neurologiques (névrite inflammatoire périphérique) ne régressent pas, la décompression des nerfs se fait par neurolyse chirurgicale[5],[32].
Des patients peuvent avoir des lésions chroniques déjà constituées ou séquelles diverses, par retard de diagnostic avec traitements trop tardifs. Des améliorations sont souvent possibles : soit par orthopédie (prothèses, chaussures et semelles orthopédiques…) soit par chirurgie réparatrice ou palliative (drainage de suppuration, amputation d'extrémité mutilée, chirurgie des tendons…)[6].
Chez l'enfant
Outre des posologies adaptées et le plus souvent individualisées en fonction de l'âge, le traitement de la lèpre de l'enfant pose des problèmes particuliers[32] :
- la nécessité d'un diagnostic précoce pour éviter la transmission entre enfants et la survenue de séquelles ;
- le manque de formes médicamenteuses mieux acceptées par l'enfant, comme le sirop ;
- stigmatisation ou discrimination scolaire.
Résultats
Avec une polychimiothérapie appliquée à temps et correctement suivie, la lèpre est généralement vue comme une maladie guérissable, où l'on peut prévenir des lésions handicapantes, ou limiter un handicap déjà constitué. Les rechutes ou le décès sont rares[4].
Toutefois des défis demeurent, concernant le diagnostic précoce, les traitements (surveillance des complications et de l'apparition de résistances), et l'accès aux traitements encore entravés par la stigmatisation sociale, la pauvreté et le manque d'éducation. Les enfants et les femmes des zones rurales endémiques sont particulièrement désavantagés[32],[52].
Au vu de la situation en 2020, même en traitant tous les sujets atteints de lèpre, il faudra plusieurs décennies pour éliminer la lèpre comme problème de santé publique dans les pays endémiques, notamment à cause de la très longue durée d'incubation[53].
Prévention
L'isolement des lépreux est inutile, à cause de la longue durée d'incubation de la lèpre, du fait que les patients atteints de lèpre tuberculoïde (les plus nombreux) ne sont pas contagieux, et de l'efficacité des traitements pour supprimer ou réduire l'infection de la lèpre lépromateuse[5].
La chimioprévention est un sujet de recherches depuis les années 1960, par exemple sur la prophylaxie des cas contacts de lépreux contagieux. En 2018, l'OMS propose une dose de rifampicine comme chimioprévention en région endémique[32].
La prévention des cas contacts (membres de la famille vivant sous le même toit qu'un lépreux contagieux) repose sur le traitement du patient, l'éducation, et un contrôle médical annuel pour au moins 5 ans des cas contacts (informés qu'ils doivent consulter au plus vite en cas d'apparition de signes cutanés ou neurologiques)[4].
Deux vaccins contre la lèpre sont en phase expérimentale : l'un américain basé sur Mycobacterium leprae (vaccin LepVax), l'autre indien basé sur Mycobacterium indicus pranii (en) (vaccin MIP). Le seul vaccin couramment utilisé est le vaccin BCG susceptible d'induire une immunité croisée tuberculose-lèpre. Son efficacité est controversée : protection de 20 à 90 % selon les études, diminuant avec le temps. Dans les régions à très forte prévalence lépreuse, le BCG est administré dès la naissance[4],[32].
Des stratégies préventives combinées (chimioprévention + BCG) sont en cours d'évaluation. L'évaluation des moyens préventifs est difficile, toujours en raison de la longue durée d'incubation de la lèpre[32].
Origine et diffusion historique de la lèpre
La connaissance des origines et de la diffusion historique de la lèpre repose sur des données scientifiques (génomique et paléogénomique, paléopathologie et paléomicrobiologie) et historiques (témoignages, documents…).
M. leprae a suivi les migrations humaines depuis la sortie d'Homo sapiens hors d'Afrique. La lèpre-maladie est présente en Europe dès l'âge du bronze en Europe, mais elle ne prend une ampleur significative que sous l'Empire romain qui réunit par contacts réguliers de grandes populations très éloignées[54].
La lèpre suit les voies commerciales et les armées, comme les pèlerinages. Une deuxième extension européenne se produit au Moyen Âge central en lien avec l'urbanisation croissante et de nouveaux rapports avec le monde musulman (croisades)[55],[56].
À la fin du Moyen Âge, le développement européen provoque une extension mondiale de la lèpre. Celle-ci accompagne les grandes découvertes et les voies de colonisation, avec passage de la lèpre en Afrique de l'Ouest et aux Amériques[54],[55].
Données scientifiques
Génomique
Mycobacterium leprae dérive d'un ancêtre commun avec Mycobacterium tuberculosis, dont il aurait divergé il y a près de 9 millions d'année, en évoluant par réduction du génome. Le génome de M. leprae est particulièrement stable à plus de 99,9 %[57],[58] avec un taux de mutation évalué à 18-30 mutations par millénaire[59].
Le séquençage du génome des souches connues a permis de définir quatre types (divisés en 16 sous-types, de A à P)[56] associés à une zone géographique[55] :
- Inde et Asie du Sud-Est ;
- Afrique de l'Est ;
- Europe et Afrique du Nord ;
- Brésil et Afrique de l'Ouest.
Un cinquième type, numéroté 0, existe en Chine et Nouvelle-Calédonie, très proche d'un sous-type de la souche 3.
Le caractère exceptionnellement stable du génome de M. leprae, son association avec des zones géographiques, en font un marqueur utile pour retracer les grandes migrations humaines[15].
Le M. leprae ancestral serait originaire d'Afrique de l'Est (type 2), plutôt que de l'Inde (type 1), le type 2 actuel étant le plus proche d'un type ancestral. La lèpre aurait accompagné les hommes dans leurs migrations d'Afrique de l'Est vers l'Eurasie, aux alentours de 100 000 ans av. J.C. Lors des migrations vers l'Inde et l'Asie du Sud-Est, M. leprae aurait divergé en type 1, et vers l'Afrique du Nord et l'Europe en type 3[55].
Le type 4 Brésil et Afrique de l'Ouest est plus proche du type 3 que du type 2. Ceci laisse supposer que M. leprae a été introduit aux Amériques par le commerce des esclaves (Caraïbes et Brésil) et les migrations européennes, notamment celle des conquistadors (la péninsule ibérique restant un foyer actif de lèpre) ; de même la lèpre d'Afrique de l'Ouest aurait été apportée par voie commerciale d'Afrique du Nord et d'Europe. Alors qu'à Madagascar, M. leprae est de type 1, indiquant une origine indienne[55].
Dans les cimetières médiévaux des léproseries européennes, on trouve une grande diversité de souches, surtout de type 2 et 3, ce qui donne à penser une double origine de la lèpre européenne, autochtone par les pèlerinages et importée du Moyen-Orient par les croisades[56],[55].
La lèpre s'est introduite en Asie par la route de la soie, dans le sens inverse de l'arrivée en Europe de la peste, par le nord (Proche-Orient, Asie centrale) plutôt que par le sud (Inde et Indonésie)[58], [55].
La situation de l'Océanie est en discussion. L'hypothèse dominante était l'arrivée de la lèpre dans cette région par la colonisation européenne au XIXe siècle, mais des données génomiques sont en en faveur d'introductions plus anciennes via les migrations de peuplement à partir de l'Asie du Sud- Est[54].
Ces données sont à affiner par l'étude d'un plus grand nombre d'échantillons, non seulement humains (génomes anciens de M. leprae) mais aussi animaux (écureuil roux, génomes modernes de M. leprae)[56].
Paléopathologie
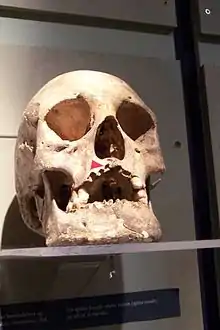
Les données de paléopathologie les plus anciennes sont datées de 2000 ans av. J.C. en Inde, provenant d'un squelette trouvé au Rajasthan[60], mais sur l'aspect des lésions osseuses uniquement[61].
Le diagnostic osseux de lèpre est quasi-certain en cas de forme lépromateuse de la lèpre, s'il existe un syndrome rhinomaxillaire : atrophie et perte de l'épine nasale, atrophie et perte des alvéoles des incisives supérieures, érosions ou perforation du palais. En revanche, la seule atrophie ou la disparition des dernières phalanges des mains ou des pieds n'est qu'un diagnostic possible parmi beaucoup d'autres[62],[63].
Bien que l'on pense que M. leprae s'est établi autour du bassin méditerranéen et en Europe centrale, il y a 40 000 ans environ, les restes humains préhistoriques avec lésions de lèpre osseuse sont très rares. Ce qui pourrait s'expliquer par une durée de vie trop courte pour des complications osseuses, ou un équilibre immunologique des populations à cette époque. Le plus ancien cas européen pourrait être un cas écossais daté 2000-1600 av. J.C.[63].
Les traces ostéoarchéologiques européennes deviennent significatives durant le premier millénaire av. J.C. On retrouve des lésions caractéristiques de lèpre sur des squelettes en Égypte ptolémaïque, en Angleterre (époque romaine). En Europe médiévale, on les trouve surtout dans les cimetières des léproseries, notamment en Angleterre, au Danemark, en France et en Italie, en Croatie et en Hongrie[63].
Depuis les années 1990-2000, le diagnostic osseux peut être confirmé par PCR par prélèvement de la surface osseuse[64]. Les premiers cas publiés l'ont été sur des squelettes de la palestine romaine. Avec les développements de la biologie moléculaire, il est devenu possible de retrouver l'ADN de M. leprae non seulement à partir de l'os, mais aussi à partir des dents (pulpe dentaire et tartre dentaire)[54].
Données historiques
La lèpre est connue depuis l’Antiquité. Les premières descriptions datent de 600 ans av. J.-C. On la retrouve dans les civilisations antiques en Chine, en Égypte et en Inde. On a d'ailleurs longtemps cru à une origine asiatique.
Jusqu’au XIXe siècle, les croisades étaient tenues responsables de l’introduction de la lèpre en Europe. Voltaire écrivait dans son encyclopédie que « tout ce que nous gagnâmes à la fin de nos Croisades, ce fut cette gale; et de tout ce que nous avions pris, elle fut la seule chose qui nous resta ! ». En effet, la lèpre s’était tellement propagée en Europe après les croisades qu’il est difficile de contester le rôle de celles-ci. Baudouin IV de Jérusalem dit « le Lépreux » (1161-1185) est d'ailleurs connu pour avoir souffert de cette maladie et ne pouvant donc avoir ni femme ni enfant[65]. Ainsi, les causes premières de la propagation de la maladie étaient le commerce crétois et phénicien, les conquêtes d’Alexandre le Grand, les légions de Pompée et d’Octave, la diaspora, la présence de Sarrasins en Espagne et en France, les expéditions Vikings, les invasions germaniques et enfin les croisades[66].
Il faut également souligner que le terme « lèpre » était une catégorie de diverses maladies avec des manifestations physiques externes dont la lèpre contagieuse faisait partie[67]. Si ces facteurs avaient favorisé l’expansion de la maladie, pour que celle-ci ait autant sévi et se soit implantée pendant près de 1 500 ans, il a fallu des conditions locales particulièrement favorables à la maladie : tout d’abord une mauvaise hygiène, le déversement des ordures sur la route permettant aux animaux errants de s’en approcher et s’en nourrir, des habitations mal construites ne laissant pas la possibilité d’aérer correctement l’intérieur et de chasser l’humidité. À la campagne, les animaux pouvaient pénétrer dans la maison du paysan qui, le soir, s’allongeait avec toute sa famille ainsi qu’avec un potentiel invité sur un matelas au sol près du feu, laissant ainsi libre cours à la contagion. Les personnes n’utilisaient pas de fourchettes et trempaient les doigts directement dans un plat en commun avec l’ensemble de la famille ; les nobles étaient moins exposés. Un autre facteur qui favorisa l’expansion de la maladie localement fut la coutume de l’hospitalité comme pratique religieuse ; en effet, les croyances indiquaient que l’étranger demandant l’hospitalité pouvait être Dieu ou le Christ étant déguisé et testant la bonté du peuple ; toutes ces personnes (moines, mendiants, pèlerins, etc.) demandant l’hospitalité pouvaient être porteurs de lèpre.
Histoire socio-culturelle
La lèpre, réalité pathologique, était remplie d’un imaginaire morbide qui participait activement à sa représentation et à sa perception, imagination qui illustre ce qu'inspirait cette maladie et inspire encore de nos jours.
Il existe ainsi une lèpre-maladie et un concept lépreux (faute morale ou « syndrome religieux »)[68]. Selon Raoul Follereau :« Un malade atteint de la lèpre a en fait deux maladies : il a la lèpre et il est lépreux »[69].
Pour ces raisons, l'OMS a proposé de ne plus utiliser le terme « lèpre » dans la littérature médicale en le remplaçant par « maladie de Hansen ». Les termes « lèpre » et « lépreux » étant jugés agressifs et discriminants[52]. Au début du XXIe siècle, la lutte contre la lèpre reste entravée par une stigmatisation sociale qui frappe encore les lépreux. Par exemple, en 2021, l'OMS a reçu 124 signalements de discrimination de personnes atteintes de lèpre en pays endémiques (Brésil, Guyana, Kiribati et République Dominicaine)[37].
Toujours en 2021, au moins cinq pays dans le monde ont des lois autorisant la discrimination fondée sur la lèpre : Chine, Macao, Inde, Japon, République islamique d'Iran et Togo. L'OMS et l'ONU souhaitent inclure des personnes atteintes de lèpre dans la mise en œuvre des programmes internationaux de surveillance et de lutte contre la lèpre, afin d'accélérer l'abrogation de ces lois discriminatoires[37].
Lèpre dans la Bible
Concept religieux

Dans le Lévitique, il est question d'un ensemble de manifestations cutanées connues sous le nom de tsara'at (צרעת). Cette affection se présente comme des taches blanches ou dartres susceptibles d'évoluer en ulcères :
« L'Éternel parla à Moïse et à Aaron, et dit : Lorsqu'un homme aura sur la peau de son corps une tumeur, une dartre, ou une tache blanche, qui ressemblera à une plaie de lèpre sur la peau de son corps, on l'amènera au sacrificateur Aaron, ou à l'un de ses fils qui sont sacrificateurs. Le sacrificateur examinera la plaie qui est sur la peau du corps. Si le poil de la plaie est devenu blanc, et que la plaie paraisse plus profonde que la peau du corps, c'est une plaie de lèpre : le sacrificateur qui aura fait l'examen déclarera cet homme impur. S'il y a sur la peau du corps une tache blanche qui ne paraisse pas plus profonde que la peau, et que le poil ne soit pas devenu blanc, le sacrificateur enfermera pendant sept jours celui qui a la plaie »[70].
Il est explicitement question d'une maladie spirituelle, ayant certains stigmates corporels et qui touche la personne s'étant rendue « impure » par ses comportements sociaux (en particuler la calomnie ou la diffamation, "motsi shèm ra'" מוציא שם רע), et qui peut s'étendre à des objets inanimés (vêtements, habitation...).

Les chapitres XIII et XIV du Lévitique sont entièrement consacrés à la tsara'at et regroupent diverses parties faisant référence à l’examen des malades, aux dispositions qu’il faut prendre vis-à-vis d’eux ainsi que du rituel de purification. La personne susceptible d’être impure est alors isolée pendant sept jours afin d’observer l’évolution de la maladie et l’apparition d’autres atteintes comme des brûlures, des plaies ou des cicatrices purulentes[71],[70].
La tsara'at est la marque d'un courroux divin, ce n'est pas un concept médical, c'est pourquoi le diagnostic de tsara'at est confié aux prêtres et non pas aux médecins[72].
Le Deutéronome (Dt 24,8) prescrit d’éviter la lèpre et non le lépreux en écoutant les Écritures et en ne contrevenant pas à la Loi divine pour éviter la colère de Dieu : « Prends garde à la plaie de la lèpre, afin de bien observer et de faire tout ce que vous enseigneront les sacrificateurs, les Lévites ; vous aurez soin d'agir d'après les ordres que je leur ai donnés. »[71].
L'association du lépreux avec la mort concernait son aspect physique dont la peau était dégradée, et qui faisait de lui un être ressemblant à un enfant mort-né[73]. Donc le lépreux apparaissait comme un être vivant, mais qui possédait les caractéristiques physiques d’un mort en état de décomposition. Ainsi sa mort sociale et son exclusion n’étaient que l'expression de son apparence qui évoquait la mort physique[71].
Concept sanitaire
Dans une autre perspective, la tsar'at a été traduite en lèpre, afin qu'un problème de pureté rituelle puisse aider à éviter un problème de santé publique. En effet, les rabbins connaissaient l'existence de la maladie de Hansen, sa gravité et sa contagiosité (Talmud de Babylone, Sanhedrin 98a) mais ils ont volontairement pratiqué l'amalgame entre la tsara'at et la lèpre afin de protéger la communauté en mettant à l'écart toute personne susceptible de la contaminer, tout en s'appuyant sur les ressources de la Torah complétées par celles de la loi orale[71].

Les Évangiles synoptiques relatent la guérison d'un lépreux puis de dix lépreux par Jésus (Mc 1,40–45 ; Mt 8,1–4 ; Lc 5,12–16), interprétée comme un pardon des fautes ou une preuve de foi[74].
Du point de vue d'histoire de la médecine, la tsara'at doit réfléter une réalité d'ordre médical. Pris dans leur totalité, les manifestations de tsara'at ne s'accordent avec aucune entité dermatologique moderne. La plupart des auteurs modernes écartent l'identité pure et simple de la tsara'at avec la lèpre, mais ils acceptent l'idée qu'il s'agit d'un ensemble de manifestations relativement bénignes (psoriasis, vitiligo, favus, certaines formes d'eczémas...) et d'autres plus graves comme différentes formes de lèpre[72].
Après plusieurs siècles d'exégèse historique, les historiens considèrent que la lèpre est la seule maladie chronique de la peau dont la gravité peut justifier les mesures sociales du législateur biblique, car « il est difficile de croire qu'un rejet social aussi radical puisse s'expliquer seulement par des idées religieuses aberrantes sur des affections tout à fait bénignes »[72].
Lèpre dans l'Antiquité
Dès les premiers siècles de l’ère chrétienne, la lèpre sévissait en Europe et en 549, le concile d’Orléans prit des mesures en faveur des lépreux en invitant tous les évêques à se préoccuper des malades résidant dans leur diocèse. En effet, selon les Saintes Écritures, les prêtres avaient un devoir envers tous les indigents et malades, mais ce concile stipulait que les prêtres devaient se préoccuper plus ardemment des lépreux. Ceux-ci devaient aider les lépreux à se vêtir et à se nourrir avec leurs propres moyens afin que « les soins de la charité ne manquent pas à ceux qu’une cruelle maladie réduit à la détresse »[75].
En 583, le concile de Lyon interdit le voyage aux lépreux afin d’éviter que la maladie se propage et stipule que les lépreux doivent être séparés du reste de la communauté et considérés comme étant morts. Ainsi, dès le VIIe siècle, diverses léproseries (établissements pour lépreux) voient le jour en Occident. En 757, en France, à Compiègne, un parlement décide que si dans un couple marié l’un des deux conjoints est lépreux, il est permis à l’autre de se remarier en toute bonne conscience.
Lèpre médiévale
En France, les lépreux pouvaient être appelés caquins ou cacous et devaient habiter à l'écart des villages dans des « caquineries ».
En breton, « valordi » signifie « maladrerie », « léproserie », comme le lieu-dit « Valordi » situé près de la Pointe de la Torche en Plomeur (Finistère).
La léproserie peut ainsi être appelée caquinerie, « ladreries, maladreries, maladières, misellaria, mézelleries, lazarets, etc ». Les historiens en ont souvent exagéré le nombre à cause d'une erreur de traduction latine ou d'interprétation au XVIIIe siècle, reprise par eux par la suite et jusqu'à nos jours[76].
Exclusion du lépreux

Avant d’arriver à l’exclusion pure et simple du lépreux, un certain nombre d’éléments sont requis. En premier lieu, la personne soupçonnée d’avoir contracté la maladie est convoquée pour un examen minutieux. Le malade est examiné par des médecins et est parfois soumis à une épreuve ; on saigne le malade et on jette son sang dans une bassine pleine d’eau ; si le sang garde sa couleur vermeille, la personne est déclarée saine, sinon elle est déclarée lépreuse. Selon les régions, ces épreuves peuvent varier. Le juge ecclésiastique rend la sentence et par la suite les experts rédigent un rapport relatant les examens pratiqués sur le malade et si celui-ci a été confirmé positif ou négatif à la maladie.
Le jour de l’exclusion du lépreux, le curé doit lui envoyer une tunique/manteau, une robe grise, noire ou écarlate dont l’épaule gauche ou la poitrine est ornée d’un morceau de tissu rouge en forme de patte d’oie ou de cœur ; il reçoit également un chapeau ou une capuche noire, un instrument (crécelle, cliquette), qu’il doit agiter de jour tous les dix pas et constamment de nuit (en Allemagne il s’agissait d’une corne), ou des morceaux de bois que le lépreux doit battre l’un contre l’autre pour avertir la population de son approche, ceux-ci fuyant pour éviter la contagion ; il reçoit également un gobelet pour l’aumône ou pour boire, une panetière pour conserver le pain, une cuillère, un baril et un couteau. Une procession s’engage donc pour le lépreux dont la première halte se fait à l’église, où l’on célèbre l’office des morts que le lépreux entend le visage couvert pour symboliser le mort dans son cercueil. Cet usage cruel a été supprimé dans certaines régions et dans d’autres il est remplacé par l'office du jour. Par la suite, la procession emmène le lépreux dans un cimetière ou un rite symbolique est organisé ; le lépreux doit entrer dans une tombe, rester à genoux pendant que le prêtre lui jette trois fois de la terre sur la tête en disant « mon ami, tu es mort au monde ».
La dernière halte se fait dans l’établissement des lépreux, la léproserie, où on lui lit les « défenses », c’est-à-dire le règlement qu’il doit à présent suivre en tant que lépreux, et les interdits qu'il doit jurer sur l’Évangile de respecter. Il devra se promener avec l’habit du lépreux afin que tous le reconnaissent, il ne devra pas toucher les arbres ou autres plantes sans le port de gants, il ne devra plus recevoir d’autre compagnie que les autres lépreux, etc. Il est souligné que l’exclusion du lépreux n’est que corporelle et que son esprit reste toujours parmi eux. Si le lépreux est étranger, il est uniquement chassé sans possibilité de revenir sous peine d’être brûlé vif ; si le malade est originaire du lieu, soit on lui assigne une cabane isolée des habitations, soit, si la ville est riche, une maladrerie est construite pour y accueillir les lépreux et si le malade était un bourgeois, alors sa vie en léproserie était plutôt confortable avec la possibilité de faire venir son mobilier[77].

De plus, l’exclusion du lépreux devait être prononcée officiellement, donc si le malade pouvait cacher les symptômes de sa maladie, alors il pouvait continuer en cachette à vivre normalement avec sa famille, retardant ainsi le plus possible le jour de son exclusion, mais laissant libre cours à la contagion.
L'exclusion des lèpreux s'observait pour la première fois dans la cité de Babylone, où le traitement de ceux-ci était indiqué dans le Code de Hammurabi : « Si un homme présente des nodosités et des taches blanchâtres, celui-ci doit être rejeté par Dieu et par la société ».
Cette exclusion médiévale du lépreux s’organisait dans une période de centralisation de l’État et de l’Église, durant les XIIe et XIIIe siècles, où s’organisaient, entre autres, les luttes contre l’hérésie, la persécution des Juifs et la condamnation de l’homosexualité. Mais la persécution des lépreux ne s'arrêtait pas là ; en effet, en Bretagne, les caqueux avaient été victimes d’exclusions jusqu’au XVIIIe siècle, car ils étaient considérés comme des descendants de lépreux. Ils étaient considérés comme porteurs de la lèpre et donc contagieux, en continuité avec l’exclusion médiévale du lépreux. Au XVe siècle, les caqueux étaient interdits de contacts avec l’Église, ils devaient pratiquer le métier de cordiers sans pouvoir faire commerce, sauf pour acheter du fil et du chanvre pour leur métier. Comme les lépreux médiévaux, ils devaient se promener avec un morceau de tissu rouge sur leur vêtement afin que la population puisse les reconnaître[78].
« Depuis au moins le XVe siècle, le métier de cordier est le monopole des parias, considérés comme les descendants des lépreux : ils vivent dans des hameaux séparés, ont des lieux de culte ainsi que des cimetières qui leur sont réservés. (...) La chapelle de la Madeleine, aujourd'hui en Penmarc'h, leur est manifestement destinée, comme celle de Gestel (Morbihan) et de nombreuses autres un peu partout. En effet, les toponymes La Madeleine sont synonymes de noms de lieux comme La Maladrerie (léproserie) et sainte Madeleine est la patronne des cordiers[79]. »
Symptômes et transmission de la lèpre au Moyen Âge
Dès le haut Moyen Âge, grâce aux textes de l’Antiquité, les symptômes majeurs de la maladie avaient pu être identifiés. La forme de lèpre la plus apparente et la plus simple à identifier était sa forme lépromateuse où l’aspect du visage était très important jusqu’au Ve siècle, car il était le premier élément que l’on voyait de loin et que l’on remarquait. À partir du XIe siècle, hormis l’aspect du visage, l’on parlait à présent d’une « maladie desséchante qui affecte tous les membres du corps[80] » ; ce critère faisait partie des éléments de distinction entre une forme de lèpre bénigne et l’autre grave (selon Constantin l’Africain (1015–1087), moine au Mont-Cassin). Les premiers symptômes de la lèpre étaient identifiés dans les yeux devenant dilatés, les lèvres créant des boursouflures crevassées, le visage tuméfié et la cloison nasale qui se creusait et se détériorait.

Les lésions paléopathologiques rétrospectivement les plus visibles sur les restes osseux sont une érosion de l'arête nasale antérieure, la résorption de l'ouverture nasale piriforme, une atrophie des processus alvéolaires du maxillaire et la perforation du palais[81]. Selon l'archéologue Pia Bennike (responsable de la collection des 700 squelettes de la léproserie de Naestved au Musée d’histoire de la médecine de Copenhague) la lèpre attaquait le nez, les mains et les pieds des malades, dégradant leur aspect physique. La perte osseuse nasale était grave et les dents tombaient toutes.
Les enfants étaient plus atteints que les adultes, et les plus pauvres également. En effet, les enfants pauvres vivaient moins longtemps, donc la maladie était moins avancée sur leurs squelettes que sur ceux des enfants bourgeois qui pouvaient vivre plus longtemps et dont les squelettes étaient donc très détériorés par la maladie. Ceci n’est pas une nouveauté, car les enfants issus de couches sociales basses étaient moins bien nourris et en moins bonne santé que les enfants de couches bourgeoises, qui pouvaient se nourrir convenablement et avoir des conditions de vie plus favorables[82].
Au Moyen Âge, le mécanisme de contagion s’expliquait par le « contact immédiat avec un poison ou par la médiation de l’air corrompu entre un agent malade et un patient sain[83] ». Ce modèle de transmission des maladies n’exclut pas que les médecins du Moyen Âge acceptaient la possibilité d’une transmission d’homme à homme. La lèpre était considérée comme une maladie de l’âme résultant d’une punition de Dieu en conséquence des péchés commis, donc la contagion de la maladie était tout d’abord pensée comme une contagion des péchés par les théologiens.
Au XIIIe siècle, on considérait donc déjà que la maladie était transmissible, un texte de Thomas d'Aquin en 1250 parlait de la lèpre comme d’une maladie contagieuse, donc les théologiens considéraient déjà la lèpre comme une maladie transmissible, mais assimilée à l’hérésie[84].
Remèdes d'alors
Plusieurs pratiques thérapeutiques pour lépreux étaient utilisées, sans réels fondements scientifiques et toujours avec une forte empreinte religieuse. Bernard de Gordon (1250–1320) avait prescrit des saignées pour les malades suivies de purges souvent associées à des cautérisations et à des scarifications ainsi que des bains quotidiens de plantes. Henry de Mondeville (1260–1320) écrivait qu’il fallait recouvrir le visage du malade avec de la graisse de poules rôties, ces dernières nourries avec du froment cuit et des serpents. Une autre pratique consistait à tuer une anguille des mers selon un rituel très précis puis de la cuire avec des plantes. On dessèche la peau avec l'ellébore noire et blanche mais aussi avec la chaux vive[85].
Représentation du lépreux

Selon des illustrations du XIIIe siècle, le lépreux était représenté de façon réaliste, agitant sa cloche, crécelle ou cliquette afin de demander l’aumône, complètement camouflé de la tête au pied, ne faisant entrevoir qu’une mince partie de sa peau déformée et ravagée. Comme les Juifs avec la rouelle, les lépreux devaient porter un signe distinctif permettant de les reconnaître[86]. Tout d’abord, comme dit précédemment, leur vêtement comportait sur l’une des épaules un morceau de drap rouge. Dans le pays chartrain, les lépreux devaient porter un linge blanc sur la tête ainsi que leur instrument pour avertir la population[87].
Le bas-relief qui ornait le portail de Saint-Julien-le-Pauvre à Paris, datant de la première partie du XIIIe siècle, représentait saint Julien, sa femme dans un bateau et le Christ avec la figure d’un lépreux recouverte d’un capuchon et d’une tunique. Un manuscrit latin de la Bibliothèque nationale de Saint-Germain, du XIIIe siècle, représentait un lépreux encapuchonné, bras croisés et tenant sa « cliquette ». Dans un autre manuscrit de la même bibliothèque, l’on voit un lépreux se faire guérir par Jésus et donc laissant tomber son instrument en symbole de sa guérison. Hormis les représentations artistiques et manuscrites, la distinction entre lépreux et non-malades se faisait également après la mort, car dans un cimetière de Dijon l’on avait retrouvé des tombes représentant un lépreux avec sa cliquette à la ceinture[87].
Période moderne
En 1873, le Norvégien Armauer Hansen découvre le bacille responsable de cette maladie.

Si la Société de pathologie exotique de Paris recommande en 1909 « l'exclusion systématique des lépreux », et si le code de l'indigénat prévoit la ségrégation coercitive, celle-ci disparaît à partir de la troisième Conférence internationale sur la lèpre organisée à Strasbourg en 1923, dont le secrétaire général, Émile Marchoux, préconise l'humanisation des léproseries[88].
Au XXe siècle, la lutte contre cette maladie connaît un nouvel élan à la suite de la mort du prêtre et missionnaire belge Jozef de Veuster, mieux connu sous le nom de Père Damien, qui avait consacré sa vie aux lépreux de Molokai (Hawaï). Mort en 1889 à l'âge de 49 ans des suites de la lèpre, son histoire commençait à se répandre et à susciter beaucoup d'intérêt de façon à stimuler la recherche.
Une coordination internationale de la lutte contre la lèpre s'organise en 1930 lors de la réunion à Bangkok de la Société spéciale de la lèpre de la Société des Nations[88].
L'« Institut central de la Lèpre » est inauguré à Bamako en 1935. Il est rebaptisé « Institut Marchoux » en 1945, puis Centre national d'appui à la lutte contre la maladie en 2001[89]. Jusqu'à l'apparition des sulfones au début des années 1950, le traitement reposait sur l'huile de chaulmoogra[90]. Voir ci-dessous « anciens traitements ».
À partir des années 1990, plus de 12 millions d'individus ont été guéris de la lèpre. Sa prévalence a diminué de 90 % et la lèpre a été éradiquée dans 108 des 122 pays touchés.
En 1991, l'OMS se donne comme objectif « l'élimination de la lèpre en tant que problème de santé publique » avec une prévalence mondiale inférieure à 1 cas pour 10 000 habitants, cet objectif a été atteint en 2000[91]. Cependant, elle demeure un problème de santé publique dans 100 pays situés en majeure partie en Afrique, Asie (dont l'Inde) et Amérique du Sud (Brésil). Deux cent dix mille (210 000) nouveaux cas ont été détectés dans le monde en 2010 et 1,5 million de personnes voire plus sont atteintes[92],[93].
Malgré les progrès accomplis, la lèpre reste endémique. Dans les années 2010, l'incidence de la maladie stagne, et la proportion de nouveaux patients invalides reste stable. Cette situation serait lié à une démobilisation dans la lutte contre la lèpre, une relative désaffection de la recherche scientifique et des compétences médicales pratiques dans cette maladie[26].
En novembre 2020, l'Assemblée générale de la Santé adopte une nouvelle stratégie 2021-2030 avec l'objectif « Vers zéro lèpre »[94].
L'ordre souverain de Malte et la Fondation Raoul Follereau consacrent des fonds importants à cette maladie (léproserie et recherche médicale). D'autres associations religieuses ou laïques agissent aussi en ce sens[35]. De moins en moins de médecins connaissent cette maladie de la misère et des guerres, ce qui tend à augmenter la gravité des séquelles des personnes atteintes.
Déclin de la lèpre en Europe
« Le génie de l'homme n'y est certainement pour rien. L'étude de l'histoire de la lèpre est une grande leçon d'humilité »[95].
« La lèpre a disparu de la plupart des pays d'Europe, sur la pointe des pieds, lentement, sans que personne ou presque ne s'en avise (…) La fin de la lèpre ne doit rien de plus à la médecine qu'à l'administration »[96].
La lèpre atteint son apogée au XIIIe siècle et commence à décliner en Occident à partir du XIVe siècle. Les causes de ce déclin font l'objet de nombreuses hypothèses formant un ensemble complexe de facteurs socio-politiques, sanitaires et biomédicaux[97].
Ségrégation et hygiène

La première explication est celle d'Hansen (1841-1912) lui-même. Le système défensif médiéval serait la cause principale du retrait de la lèpre, auquel il ajoute l'hygiène corporelle avec l'utilisation du savon. Hansen se basait sur son expérience norvégienne de lutte contre la lèpre au XIXe siècle. Il expliquait aussi que les immigrés norvégiens lépreux aux États-Unis n'y ont pas propagé la lèpre en adoptant les habitudes corporelles des anglo-saxons[98].
Selon Obregon, ceci doit se comprendre dans un contexte fin XIXe siècle - début XXe siècle où des médecins, pour défendre la théorie microbienne et contagieuse de la lèpre, cherchaient à démontrer l'efficacité des mesures de ségrégation[99].
Pour les historiens modernes, la ségrégation médiévale était loin d'être parfaite : l’exclusion des lépreux dans les léproseries était toute relative, car certains lépreux fuyaient la léproserie où ils étaient maltraités, d'autres pour retarder au plus tard leur exclusion, essayaient de cacher leurs symptômes le plus longtemps possible en restant chez eux[76]. Ailleurs des lépreux étaient autorisés à mendier dans les villes, et la cohabitation entre lépreux et non-lépreux était fréquente[100]. « À la peur de la lèpre, qui s'étale dans tant de textes, correspondaient finalement des pratiques assez laxistes, avec de temps en temps une velléité de rigueur. »[101].
Pour l'hygiène, on constate aussi qu’après la huitième croisade (1270 à Tunis), la lèpre commençait son déclin, sans que les conditions d'hygiène ne s'améliorent réellement[95], il en est de même pour la Renaissance qui n'a pas connu un développement particulier de l'hygiène[102].
Niveau de vie
La lèpre moderne est une maladie de la pauvreté en milieu rural, et l'amélioration du niveau de vie des populations aurait joué un rôle dans son déclin historique. Les facteurs exacts sont mal connus et ne suffisent pas à expliquer les variations historiques et géographiques de la maladie[13].
Par exemple, en ce qui concerne les facteurs nutritionnels, de multiples hypothèses parfois contradictoires sont proposées : le rôle du fer (un déficit modéré serait protecteur et une carence sévère un facteur aggravant)[103], celui de micronutriments essentiels (vitamines, magnésium, zinc... en prévention des complications neurologiques)[104], voire du cholestérol (un régime riche en graisses aurait favorisé la lèpre médiévale des nobles)[105].
Parmi les anciennes hypothèses, celle d'une intoxication alimentaire par sapotoxines, liée à la nielle des blés contaminant des farines de céréales et favorisant la lèpre, laquelle aurait reculé avec l'utilisation de farines de meilleure qualité. Cette hypothèse a été finalement abandonnée[95]. Une autre explication, datant de la fin du Moyen Âge, attribuait la persistance de foyers lépreux dans des îles ou des régions côtières à un régime exclusif à base de poisson cru, hypothèse également discréditée[25].
Selon William McNeil, l'augmentation de la production de laine en Europe occidentale, entre le XIVe et XVIIe siècles, aurait permis aux plus pauvres de s'habiller plus chaudement l'hiver, en se serrant moins la nuit les uns contre les autres, ce qui aurait limité la transmission de la lèpre. Les foyers lépreux persistant en Scandinavie s'expliqueraient alors par une promiscuité plus grande avec hivers plus froids et manque de laine[102].
Facteurs socio-politiques

Un courant historique des années 1960-1980, principalement inspiré par les travaux de Michel Foucault sur le biopouvoir, aborde la lèpre médiévale d'abord comme un concept sociologique avant d'en faire une maladie biomédicale. L'exclusion des lépreux (et leur réintégration spirituelle) fait partie d'une persécution de groupes particuliers (hérétiques, juifs, prostituées, sodomites...), pour renforcer la cohésion et l'unité des autres sous un régime féodal. La lèpre médiévale était moins une réalité biologique qu'une détermination politique et sociale (le « diagnostic » de lèpre serait du même ordre que l'accusation de sorcellerie)[106].
La diminution des léproseries ne serait pas liée à celle du nombre de lépreux (atteints de lèpre au sens moderne), mais à un « essoufflement institutionnel » par érosion du système féodal[106]. Par exemple, le diagnostic de lèpre serait devenu plus rare avec le remplacement progressif des jurys de lépreux ou de religieux, par des jurys de médecins plus prudents et plus circonspects, le déclin de la lèpre européenne coïncidant avec le début des universités[107],[25].
Ce type d'interprétation est en partie contredit par des études paléogénétiques du XXIe siècle qui montrent que les restes humains des cimetières médiévaux de lépreux étaient bien infectés par Mycobacterium leprae[108].
Sélection naturelle
D’autres facteurs, génétiques, épidémiologiques et immunologiques, entrent également en ligne de compte[109].
Les lépreux, en état de moindre résistance et groupés en collectivités, auraient été les premières victimes des grandes pandémies, notamment celle de la peste noire du XIVe siècle. Les lépreux étant le quasi-unique réservoir de la lèpre, la lèpre aurait disparu en étant remplacée par d'autres maladies plus contagieuses[95],[52]. Georges Girard (1888-1985) était d'un avis opposé, en observant qu'à Madagascar, les lépreux étaient préservés de la peste, et selon lui la lèpre était plutôt un facteur de résistance à la peste[100].
Au début du XXIe siècle, des études suggèrent que les endémies historiques de lèpre ont pu favoriser la sélection de populations réfractaires ou résistantes à la lèpre, notamment en fonction du système HLA[110],[10].
Lèpre, tuberculose et urbanisation
L'hypothèse la plus discutée au début du XXIe siècle est celle qui traite des rapports entre la lèpre (due à Mycobacterium leprae) et la tuberculose (due à Mycobacterium tuberculosis), deux maladies infectieuses dues à des mycobactéries pathogènes. Déjà des études de la première moitié du XXe siècle suggèrent qu'il pourrait exister une certaine immunité croisée entre la tuberculose et la lèpre[97].
Roland Chaussinand (1896-?)[111] est le premier à observer une relation inverse entre les prévalences de la lèpre et la tuberculose. Il propose donc un « antagonisme » entre la lèpre et la tuberculose : une primo-infection tuberculeuse apporterait une protection relative contre la lèpre. La disparition de la lèpre en Europe à partir du XIVe siècle serait dû en grande partie à l'expansion de la tuberculose[97],[95].
Deux arguments vont dans ce sens : le BCG (vaccin contre la tuberculose) apporte une certaine protection contre la lèpre, la biologie moléculaire confirme une étroite parenté antigénique entre M. leprae et M. tuberculosis. Cependant il ne s'agit pas d'une réelle immunité croisée, car elle ne semble fonctionner que dans un sens : si la tuberculose protège de la lèpre, l'évidence clinique montre aussi que la lèpre ne protège pas de la tuberculose, facteur important de mortalité chez les lépreux[97],[103].
La notion d'un « antagonisme simple » est remise en question, et les relations immunologiques entre lèpre et tuberculose restent obscures. Les co-infections lèpre-tuberculose sont possibles, qu'elles soient observées cliniquement ou, plus récemment, démontrées par ADN prélevé sur squelettes médiévaux par des chercheurs de l'Université Hébraïque de Jérusalem[97],[103].
Dès lors, la disparition de la lèpre serait bien liée à l'expansion de la tuberculose, mais d'une autre façon : les lépreux affaiblis par leur maladie, vivant en communauté auraient été victimes d'une tuberculose favorisée par une urbanisation croissante : « Les scientifiques supposent que les lépreux mouraient de la tuberculose plus vite que la lèpre ne se propageait »[103],[93].
Toutefois, la connaissance d'une endémie tuberculeuse médiévale est très lacunaire[96]. La problématique du déclin de la lèpre médiévale reste ouverte, nécessitant une confrontation multidisciplinaire entre biologistes, épidémiologistes, archéologues et historiens[97],[52].
Notes et références
- ↑ « Henri Leloir (1855-1896) », sur data.bnf.fr (consulté le )
- ↑ « Lèpre - traduction - Dictionnaire Français-Anglais », WordReference.com (consulté le ).
- ↑ B. Flageul, « Lèpre (maladie de Hansen) », sur Thérapeutique Dermatologique, .
- 1 2 3 4 5 6 7 8 9 10 11 12 13 Jenish Bhandari, Mashal Awais, Blake A. Robbins et Vikas Gupta, « Leprosy », dans StatPearls, StatPearls Publishing, (PMID 32644733, lire en ligne)
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Patrice Bourée et Georges-Yves de Carsalade, « Aspects actuels de la lèpre », La Revue du Praticien, vol. 62, , p. 751-755.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 J.F. Faucher, CMIT, Lèpre, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-68-3), p. 406-408.dans E. PILLY 2020, 27e édition.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Thomas Ploemacher, William R. Faber, Henk Menke et Victor Rutten, « Reservoirs and transmission routes of leprosy; A systematic review », PLoS neglected tropical diseases, vol. 14, no 4, , e0008276 (ISSN 1935-2735, PMID 32339201, PMCID 7205316, DOI 10.1371/journal.pntd.0008276, lire en ligne, consulté le )
- ↑ Xiang Y. Han, Yiel-Hea Seo, Kurt C. Sizer et Taylor Schoberle, « A NewMycobacteriumSpecies Causing Diffuse Lepromatous Leprosy », American Journal of Clinical Pathology, vol. 130, no 6, , p. 856–864 (ISSN 0002-9173 et 1943-7722, DOI 10.1309/ajcpp72fjzzrrvmm, lire en ligne, consulté le )
- ↑ Xiang Y. Han, Kurt C. Sizer, Erika J. Thompson et Juma Kabanja, « Comparative Sequence Analysis of Mycobacterium leprae and the New Leprosy-Causing Mycobacterium lepromatosis », Journal of Bacteriology, vol. 191, no 19, , p. 6067–6074 (ISSN 0021-9193 et 1098-5530, DOI 10.1128/jb.00762-09, lire en ligne, consulté le )
- 1 2 Xiang Y. Han et Francisco J. Silva, « On the age of leprosy », PLoS neglected tropical diseases, vol. 8, no 2, , e2544 (ISSN 1935-2735, PMID 24551248, PMCID 3923669, DOI 10.1371/journal.pntd.0002544, lire en ligne, consulté le )
- 1 2 3 (en) Timothy P. Stinear et Roland Brosch, « Perspective Epidemiology Leprosy in red squirrels », Science, vol. 354, no 6313, , p. 702-703 (DOI 10.1126/science.aal0145, résumé)
- 1 2 Languillon 1986, p. 18-19.
- 1 2 3 Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, , 527 p. (ISBN 2-228-55030-2), chap. VIII (« Relations biologiques entre la lèpre et la tuberculose »), p. 295-297.
- 1 2 Languillon 1986, p. 21-23.
- 1 2 (en) Monot et al. « On the origin of leprosy » Science, 13 mai 2005, 308(5724):1040-2.
- 1 2 (en) Charlotte Avanzi et al., « Red squirrels in the British Isles are infected with leprosy bacilli », Science, vol. 354, no 6313, , p. 744-747 (DOI 10.1126/science.aah3783, résumé)
- ↑ Anna-Katarina Schilling, Charlotte Avanzi, Rainer G. Ulrich et Philippe Busso, « British Red Squirrels Remain the Only Known Wild Rodent Host for Leprosy Bacilli », Frontiers in Veterinary Science, vol. 6, , p. 8 (ISSN 2297-1769, PMID 30775369, PMCID 6367869, DOI 10.3389/fvets.2019.00008, lire en ligne, consulté le )
- ↑ Koichi Suzuki, Kazunari Tanigawa, Akira Kawashima et Tatsuo Miyamura, « Chimpanzees used for medical research shed light on the pathoetiology of leprosy », Future Microbiology, vol. 6, no 10, , p. 1151–1157 (ISSN 1746-0913 et 1746-0921, DOI 10.2217/fmb.11.97, lire en ligne, consulté le )
- ↑ « Remerciements », International Journal of Leprosy and Other Mycobacterial Diseases, vol. 73, no 1, , p. 87 (ISSN 0148-916X et 1544-581X, DOI 10.1489/1544-581x(2005)73[87a:a]2.0.co;2, lire en ligne, consulté le )
- 1 2 (en) Kimberley J. Hockings, Benjamin Mubemba, Charlotte Avanzi et Kamilla Pleh, « Leprosy in wild chimpanzees », Nature, (ISSN 0028-0836 et 1476-4687, DOI 10.1038/s41586-021-03968-4, lire en ligne, consulté le )
- ↑ Démétrius Alexandre (1832-1913) Auteur du texte Zambaco Pacha, L'Hérédité de la lèpre, par le Dr Zambaco Pacha,..., (lire en ligne)
- ↑ (en) Job CK, Sanchez RM et Hastings RC, « Lepromatous placentitis and intrauterine fetal infection in lepromatous nine-banded armadillos (Dasypus novemcinctus). », Lab. Invest., vol. 56, no 1, , p. 44-48 (PMID 3795871, résumé)
- ↑ (en) Richard W. Truman et al., « Probable Zoonotic Leprosy in the Southern United States », N. Engl. J. Med., vol. 364, , p. 1626-1633 (DOI 10.1056/NEJMoa1010536, lire en ligne).
- ↑ (en) Christopher Michael Logas (dermatologue), « Cutaneous leprosy in Central Florida man with significant armadillo exposure », sur BMJ (British Medical Journal), BMJ, (consulté le )
- 1 2 3 4 (en) Kenneth F. Kiple (dir.) et Ann G. Carmichael, The Cambridge World History of Human Disease, Cambridge University Press, (ISBN 0-521-33286-9), partie VIII, chap. 115 (« Leprosy »), p. 834-839.
- 1 2 3 Antoine Mahé, « La lèpre n’est pas une maladie du passé », médecine/sciences, vol. 31, nos 8-9, , p. 764–769 (ISSN 0767-0974 et 1958-5381, DOI 10.1051/medsci/20153108015, lire en ligne, consulté le )
- ↑ (en) RL Modlin « Th1-Th2 paradigm: insights from leprosy » J. Invest. Dermatol. 1994;102:828-32. .
- ↑ (en) Fu-Ren Zhang, Wei Huang et Shu-Min Chen et al., « Genomewide association study of leprosy », N. Engl. J. Med., vol. 361, , p. 2609-2618 (DOI 10.1056/NEJMoa0903753, lire en ligne).
- 1 2 3 4 5 M. Gentilini, Médecine tropicale, Paris, Flammarion, , 928 p. (ISBN 2-257-14394-9), p. 289-293.
- ↑ A. Basset, « La lèpre en France en 1976 », Le Concours Médical, vol. 98, no 40, , p. 5855-5863.
- ↑ « Aide-mémoire sur la lèpre (révisé en février 2010) », Relevé Épidémiologique Hebdomadaire, no 6, , p. 46-48.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Kou-Huang Chen, Cheng-Yao Lin, Shih-Bin Su et Kow-Tong Chen, « Leprosy: A Review of Epidemiology, Clinical Diagnosis, and Management », Journal of Tropical Medicine, vol. 2022, , p. 8652062 (ISSN 1687-9686, PMID 35832335, PMCID 9273393, DOI 10.1155/2022/8652062, lire en ligne, consulté le )
- ↑ (en) « Leprosy (Hansen's disease) Data », sur www.who.int (consulté le )
- ↑ (en) OMS – Lèpre : faits et chiffres.
- 1 2 Dans le monde, il y a de nombreux hôpitaux pour l'asile et le traitement des lépreux. Des groupes liés à l'Église catholique en supportent financièrement et en gèrent 547 (2013) selon les plus récentes données de l'Annuaire Statistique de l’Église. De suite, leur distribution par continent : en Afrique 198, en Amérique (au total) 56, en Asie 285, en Europe 5 et en Océanie 3. Les nations avec le plus grand nombre d'hôpitaux sont : en Afrique, la République démocratique du Congo (32), Madagascar (29) l'Afrique du Sud (23) ; en Amérique : le Mexique (8), dans l'Amérique Centrale - Antilles : la République dominicaine (3), en Amérique du Sud : le Brésil (17), l'Équateur et la Colombie (4), en Asie : l'Inde (200), la Corée (15), en Océanie : la Papouasie-Nouvelle-Guinée (3) --- (Agence Fides, congrégation pour l'évangélisation des peuples, 26 janvier 2013).
- ↑ Camille Gaubert, « La lèpre ne reviendra jamais chez nous, mais 3 millions de personnes en souffrent encore », sur sciences et avenir, (consulté le )
- 1 2 3 4 5 (en) Organisation mondiale de la Santé, « Situation de la lèpre (maladie de Hansen) dans le monde, 2021 », Relevé épidémiologique hebdomadaire, vol. 97, no 36, , p. 429–450 (lire en ligne, consulté le )
- ↑ (en) « Leprosy », sur www.who.int (consulté le )
- ↑ Languillon 1988, p. 48-51.
- 1 2 3 4 A. Basset, « Quand penser à une lèpre ? », La Revue du Praticien, vol. 28, no 47, , p. 3625-3640.
- ↑ Languillon 1986, p. 66-70.
- ↑ Languillon 1986, p. 184-186.
- 1 2 Jenish Bhandari, Mashal Awais, Blake A. Robbins et Vikas Gupta, « Leprosy », dans StatPearls, StatPearls Publishing, (PMID 32644733, lire en ligne)
- 1 2 3 4 Languillon 1986, p. 121-131.
- ↑ Languillon 1986, p. 193.
- ↑ Languillon 1986, p. 216-219.
- ↑ Languillon 1986, p. 149-154
- 1 2 3 4 Hidyanara L. de Paula, Carlos D. F. de Souza, Sara R. Silva et Paulo R. S. Martins-Filho, « Risk Factors for Physical Disability in Patients With Leprosy: A Systematic Review and Meta-analysis », JAMA dermatology, vol. 155, no 10, , p. 1120–1128 (ISSN 2168-6084, PMID 31389998, PMCID 6686771, DOI 10.1001/jamadermatol.2019.1768, lire en ligne, consulté le )
- ↑ Languillon 1986, p. 251.
- ↑ Languillon 1986, p. 31.
- ↑ (en) Miles Jackson, « Ball, Alice Augusta », Black Past (consulté le )
- 1 2 3 4 Luigi Santacroce, Raffaele Del Prete, Ioannis Alexandros Charitos et Lucrezia Bottalico, « Mycobacterium leprae: A historical study on the origins of leprosy and its social stigma », Le Infezioni in Medicina, vol. 29, no 4, , p. 623–632 (ISSN 2532-8689, PMID 35146374, PMCID 8805473, DOI 10.53854/liim-2904-18, lire en ligne, consulté le )
- ↑ Vitaux 2020, p. 79.
- 1 2 3 4 Alexandra B. Malyarchuk, Tatiana V. Andreeva, Irina L. Kuznetsova et Svetlana S. Kunizheva, « Genomics of Ancient Pathogens: First Advances and Prospects », Biochemistry. Biokhimiia, vol. 87, no 3, , p. 242–258 (ISSN 1608-3040, PMID 35526849, PMCID 8916790, DOI 10.1134/S0006297922030051, lire en ligne, consulté le )
- 1 2 3 4 5 6 7 Vitaux 2020, p. 59-61.
- 1 2 3 4 Saskia Pfrengle, Judith Neukamm, Meriam Guellil et Marcel Keller, « Mycobacterium leprae diversity and population dynamics in medieval Europe from novel ancient genomes », BMC biology, vol. 19, no 1, , p. 220 (ISSN 1741-7007, PMID 34610848, PMCID 8493730, DOI 10.1186/s12915-021-01120-2, lire en ligne, consulté le )
- ↑ Vitaux 2020, p. 5.
- 1 2 Pushpendra Singh et Stewart T. Cole, « Mycobacterium leprae: genes, pseudogenes and genetic diversity », Future Microbiology, vol. 6, no 1, , p. 57–71 (ISSN 1746-0921, PMID 21162636, PMCID 3076554, DOI 10.2217/fmb.10.153, lire en ligne, consulté le )
- ↑ Verena J. Schuenemann, Charlotte Avanzi, Ben Krause-Kyora et Alexander Seitz, « Ancient genomes reveal a high diversity of Mycobacterium leprae in medieval Europe », PLoS pathogens, vol. 14, no 5, , e1006997 (ISSN 1553-7374, PMID 29746563, PMCID 5944922, DOI 10.1371/journal.ppat.1006997, lire en ligne, consulté le )
- ↑ Aux origines de la lèpre, nouvelobs.com, 28 mai 2009
- ↑ Vitaux 2020, p. 64.
- ↑ (en) A.C Aufderheide., The Cambridge Encyclopedia of Human Paleopathology, Cambridge, Cambridge University Press, (ISBN 0-521-55203-6), p. 150-152
- 1 2 3 Spigelman 2016, p. 133-135.
- ↑ Tom A. Mendum, Verena J. Schuenemann, Simon Roffey et G. Michael Taylor, « Mycobacterium leprae genomes from a British medieval leprosy hospital: towards understanding an ancient epidemic », BMC genomics, vol. 15, , p. 270 (ISSN 1471-2164, PMID 24708363, PMCID 4234520, DOI 10.1186/1471-2164-15-270, lire en ligne, consulté le )
- ↑ « leprosy », sur priory.com (consulté le )
- ↑ Malet, Christian, Histoire de la lèpre et de son influence sur la littérature et les arts, Paris, Faculté de médecine de Paris, , p.72
- ↑ Calvez, Marcel, « Les Accusations De Contagion Comme Argument D'exclusion: L'exemple Des Caqueux De Bretagne », Ethnologie française, no t. 22, no 1, , p. 56-60 (lire en ligne)
- ↑ Languillon 1986, p. 2.
- ↑ Vitaux 2020, p. 80 et 117.
- 1 2 « Sainte Bible », sur http://saintebible.com/, (consulté le ).
- 1 2 3 4 J.-P. Messali, op. cit., pp. 335-339. Lire en ligne
- 1 2 3 Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, , 527 p. (ISBN 2-228-55030-2), chap. VI (« L'expansion lente d'un mal endémique : la lèpre »), p. 238-240.
- ↑ Alfred Marx, « L'impureté Selon P. Une Lecture Théologique », Biblica, no Vol. 82, no 3, , p. 363-384 (lire en ligne).
- ↑ (en) Berard L. Marthaler, 2007, The creed: the apostolic faith in contemporary theology (ISBN 0-89622-537-2) p. 220
- ↑ Malet, Christian, Histoire de la lèpre et de son influence sur la littérature et les arts, Paris, Faculté de médecine de Paris, , p. 68
- 1 2 Bruno Tabuteau, « Vingt mille léproseries au Moyen Âge ? Tradition française d’un poncif historiographique », Memini. Travaux et documents, no 15, , p. 115–124 (ISSN 1484-2254, DOI 10.4000/memini.417, lire en ligne, consulté le )
- ↑ Malet, Christian, Histoire de la lèpre et de son influence sur la littérature et les arts, Paris, Faculté de Médecine de Paris, , p.77–80.
- ↑ Calvez, Marcel, « Les Accusations De Contagion Comme Argument D'exclusion: L'exemple Des Caqueux De Bretagne », Ethnologie française, no 1, t.22, , p. 56–60 (lire en ligne).
- ↑ Robert Gouzien, Le pays bigouden, un pays de cocagne ?, éditions Kendero, 2012, [ (ISBN 978-2-9541745-0-1)]
- ↑ Touati, François-Olivier, Maladie et société au Moyen Âge. La lèpre, les lépreux et les léproseries dans la province ecclésiastique de Sens jusqu’au milieu du XIVe siècle, Paris, Bruxelles: De Boeck Université, , p.128.
- ↑ Lé Micheline (2009) Paléoépidémiologie de la lèpre en Europe Occidentale Thèse de doctorat en Anthropologie biologique soutenue l'université d'Aix-Marseille 2|résumé
- ↑ Tabuteau, Bruno, « Histoire et archéologie de la lèpre et des lépreux en Europe et en Méditerranée du Moyen Âge aux Temps Modernes », Annales de Normandie, no 5, vol. 49, , p. 567–600 (lire en ligne).
- ↑ Robert, Aurélien, « Contagion morale et transmission des maladies : histoire d’un chiasme (XIIIe – XIXe siècles) », Tracés. Revue de Sciences humaines, no 21, , p. 41-60 (lire en ligne).
- ↑ Fossier, Arnaud, « La contagion des péchés (XIe – XIIIe siècle). Aux origines canoniques du biopouvoir », Tracés. Revue de Sciences humaines, no 21, , p. 23-39 (lire en ligne).
- ↑ S. MARTINET, « Les traitements de la lèpre dans les manuscrits médicaux de Laon », pp. 17-22 (Histoire Aisne, Mémoires numérisées, PDF) Lire en ligne
- ↑ U. Robert, op. cit., [lire en ligne]
- 1 2 Robert, Ulysse, Les signes d'infamie au Moyen Âge : Juifs, Sarrasins, hérétiques, lépreux, cagots et filles publiques, Paris, H. Champion, (lire en ligne), p. 157.
- 1 2 « La Lèpre »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), dans « L'Œuvre humanitaire du corps de santé colonial français (1890-1968) », Association Amicale Santé Navale et d'Outre Mer, site consulté le 20 décembre 2010.
- ↑ Bréhima Doumbia, « Centre national d'appui à la lutte contre la maladie : de la lèpre aux vaccins », dans L'Essor, 21 octobre 2010.
- ↑ « L'Institut Marchoux de Bamako »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), dans « L'Œuvre humanitaire du corps de santé colonial français (1890-1968) », Association Amicale Santé Navale et d'Outre Mer, site consulté le 20 décembre 2010.
- ↑ Dickson Shey Nsagha, Elijah Afolabi Bamgboye, Jules Clement Nguedia Assob et Anna Longdoh Njunda, « Elimination of leprosy as a public health problem by 2000 AD: an epidemiological perspective », The Pan African Medical Journal, vol. 9, , p. 4 (ISSN 1937-8688, PMID 22145052, PMCID 3215526, DOI 10.4314/pamj.v9i1.71176, lire en ligne, consulté le )
- ↑ « La lèpre éradiquée par la tuberculose - Actualité médicale- Actualité médicale - information santé - depeches - InformationHospitaliere », sur www.informationhospitaliere.com (consulté le )
- 1 2 Joël Ignasse, « Comment la tuberculose a éliminé la lèpre », sur Sciences et Avenir, (consulté le )
- ↑ (en) « Leprosy », sur www.who.int (consulté le )
- 1 2 3 4 5 Roland Chaussinand, « L'expansion de la lèpre de l'antiquité à nos jours », Acta Tropica, vol. VI, no 2, , p. 105-119. (lire en ligne)
- 1 2 Bériac 1988, p. 268-270
- 1 2 3 4 5 6 Spigelman 2016, p. 135-138.
- ↑ Édouard Jeanselme, « Lèpre » (fascicule 8071), Encyclopédie Médico-Chirurgicale, maladies infectieuses, , p. 2.
- ↑ Obregon 2004, p. 677.
- 1 2 Languillon 1986, p. 3-4.
- ↑ Bériac 1988, p. 204.
- 1 2 Henri H. Mollaret (trad. de l'italien), Les grands fléaux, Paris, Seuil, , 376 p. (ISBN 978-2-02-115707-9), p. 257-258dans Histoire de la pensée médicale en Occident, vol.2, De la Renaissance aux Lumières, M.D. Grmek (dir.)
- 1 2 3 4 Helen D. Donoghue, Antónia Marcsik, Carney Matheson et Kim Vernon, « Co-infection of Mycobacterium tuberculosis and Mycobacterium leprae in human archaeological samples: a possible explanation for the historical decline of leprosy », Proceedings. Biological Sciences, vol. 272, no 1561, , p. 389–394 (ISSN 0962-8452, PMID 15734693, PMCID 1634979, DOI 10.1098/rspb.2004.2966, lire en ligne, consulté le )
- ↑ Michael Klowak et Andrea K. Boggild, « A review of nutrition in neuropathic pain of leprosy », Therapeutic Advances in Infectious Disease, vol. 9, , p. 20499361221102663 (ISSN 2049-9361, PMID 35677111, PMCID 9168857, DOI 10.1177/20499361221102663, lire en ligne, consulté le )
- ↑ S. R. Ell, « Diet and leprosy in the medieval west: the noble leper », Janus; Revue Internationale De L'histoire Des Sciences, De La Medecine, De La Pharmacie, Et De La Technique, vol. 72, nos 1-3, , p. 113–129 (ISSN 0021-4264, PMID 11620952, lire en ligne, consulté le )
- 1 2 Obregon 2004, p. 674.
- ↑ Bériac 1988, p. 57-58.
- ↑ Tom A. Mendum, Verena J. Schuenemann, Simon Roffey et G. Michael Taylor, « Mycobacterium leprae genomes from a British medieval leprosy hospital: towards understanding an ancient epidemic », BMC genomics, vol. 15, , p. 270 (ISSN 1471-2164, PMID 24708363, PMCID 4234520, DOI 10.1186/1471-2164-15-270, lire en ligne, consulté le )
- ↑ Malet, Christian, Histoire de la lèpre et de son influence sur la littérature et les arts, Paris, Faculté de médecine de Paris, , p.155-157, 165-172..
- ↑ (en) Ben Krause-Kyora, Marcel Nutsua, Lisa Boehme, Federica Pierini, Dorthe Dangvard Pedersen, Sabin-Christin Kornell, Ancient DNA study reveals HLA susceptibility locus for leprosy in medieval Europeans, nature.com, 1er mai 2018
- ↑ « Roland Chaussinand (1896-19..) », sur data.bnf.fr (consulté le )
Voir aussi
Bibliographie
Ouvrages
- Françoise Bériac, Histoire des lépreux au Moyen Âge : une société d'exclus, Paris, Imago, (ISBN 2-902702-41-8)
- Jean Languillon, Précis de léprologie, Paris, Masson, (ISBN 2-225-80528-8)
- Christian Malet, Histoire de la lèpre et de son influence sur la littérature et les arts, Paris, Faculté de médecine de Paris, 1967
- Jean-Pierre Messali, « La ”lèpre” dans les écrits bibliques et rabbiniques : aspects historiques, textuels et rituels », Religions, Université Sorbonne-Paris-Cité, 2016. NNT 2016USPCA037 (en ligne)
- Diana Obregon, « Lèpre », dans Dominique Lecourt (dir.), Dictionnaire de la pensée médicale, Paris, Quadrige/PUF, 2004, (ISBN 2-13-053960-2), p. 673-677.
- Ulysse Robert, Les Signes d'infamie au Moyen Âge : Juifs, Sarrasins, hérétiques, lépreux, cagots et filles, Paris, H. Champion, 1891, p. 146-158
- (en) Mark Spigelman et Mauro Rubin, « Paleomicrobiology of Leprosy », dans Michel Drancourt (dir.) et Didier Raoult (dir), Paleomicrobiology of Humans, Washington DC, ASM Press, 2016, (ISBN 978-1-55581-916-3), p. 131-142.
- François-Olivier Touati, Maladie et société au Moyen Âge. La lèpre, les lépreux et les léproseries dans la province ecclésiastique de Sens jusqu’au milieu du XIVe siècle, Paris, Bruxelles, De Boeck Université, 1998.
- Jean Vitaux, Histoire de la lèpre, Paris, PUF, coll. « Que sais-je ? » (no 4187), (ISBN 978-2-7154-0181-5).
Articles
- Marcel Calvez, « Les accusations de contagion comme argument d'exclusion : l'exemple des caqueux de Bretagne », in Ethnologie française, tome 22, no 1, 1992, p. 56-60 (en ligne)
- Arnaud Fossier, « La contagion des péchés (XIe – XIIIe siècle). Aux origines canoniques du biopouvoir », in Tracés. Revue de Sciences humaines, no 21, 2011 (en ligne)
- L. Grillon, « Les rites ecclésiastiques de la séparation des lépreux en Périgord à la fin du XVe siècle », dans Bulletin de la Société historique et archéologique du Périgord, 1960, tome 87, 3e livraison, p. 187-190 (en ligne)
- Alfred Marx, « L'impureté selon P. Une lecture théologique », in Biblica, vol. 82, no 3, 2001, p. 363-384 (en ligne)
- Aurélien Robert, « Contagion morale et transmission des maladies : histoire d’un chiasme (XIIIe – XIXe siècle) », in Tracés. Revue de Sciences humaines, no 21, 2001, p. 41-60 (en ligne)
- Bruno Tabuteau, « Histoire et archéologie de la lèpre et des lépreux en Europe et en Méditerranée du Moyen Âge aux Temps modernes », in Annales de Normandie, no 5, vol. 49, 1999, p. 567-600 (en ligne)
- Étienne Thévenin, « La lèpre au XXe siècle », Sociétés & Représentations, no 6 « Violences », , p. 255-271 (lire en ligne)
Articles connexes
- Cagots. La réputation des cagots est associée à la peur de la lèpre.
- Défiguration
- Hospitalisation forcée au Honmyō-ji
- Maladrerie Saint-Lazare de Beauvais
- Prieuré Saint-Lazare
- L'Île des oubliés, roman, 2005 ; — L'Île des oubliés, bande dessinée, 2021.
- Film l'Ordre de Jean-Daniel Pollet
Liens externes
- « Vers zéro lèpre. Stratégie mondiale de Lutte contre la lèpre (Maladie de Hansen) 2021–2030 », sur www.who.int (consulté le )
- (en) « Leprosy (Hansen's disease) Data », sur www.who.int (consulté le )
- « Lèpre », Dictionnaire de l’Académie française, 1re édition (1694), lire ligne sur atilf.fr
- « Lèpre », Le Trésor de la langue française informatisé, lire en ligne sur atilf.fr
- « Un lépreux à Ganges en 1570 » sur le site de l'université Fordham
- Moulages, au musée des moulages de l'hôpital Saint-Louis
- La lèpre dans les écrits bibliques et rabbiniques
- Ressources relatives à la santé :
- Orphanet
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (en) PatientLikeMe
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :
.jpg.webp)