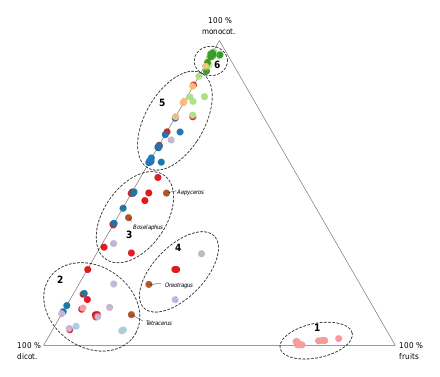Bovidés

Addax (Addax nasomaculatus)
Bœuf domestique (Bos taurus)
Mouflon corse (Ovis aries musimon)
Gazelle de montagne (Gazella gazella)
Gnou bleu (Connochaetes taurinus)
Impala (Aepyceros melampus).
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Placentalia |
| Clade | Boreoeutheria |
| Super-ordre | Laurasiatheria |
| Ordre | Artiodactyla |
| Sous-ordre | Ruminantia |
| Infra-ordre | Pecora |
Sous-familles de rang inférieur
- Antilopinae Gray, 1821 (sensu lato)
- Neotragini
- Aepycerotini
- Oreotragini
- Cephalophini
- Antilopini
- Reduncini
- Alcelaphini
- Hippotragini
- Caprini
- Bovinae Gray, 1821
- Boselaphini
- Tragelaphini
- Bovini
Les Bovidés (Bovidae) sont une famille de mammifères artiodactyles du sous-ordre des Ruminants, qui regroupe notamment les bovins, les caprins, les ovins et les antilopes. Ils présentent la caractéristique principale de posséder de vraies cornes permanentes et non ramifiées. La famille comprend plusieurs espèces domestiquées par l'Homme depuis la préhistoire (bœufs, chèvres, moutons).
Étymologie et dénominations

Le terme « Bovidae » a été construit en 1821 par John Edward Gray pour nommer une famille de ruminants sur la base du genre Bos (génitif bovis)[1]. Bien avant son application scientifique, ce mot désignait en latin classique le bœuf mâle (opposé à vache). Aux côtés des Bovidae, parmi lesquels il ne classe que les bovins, le zoologiste anglais crée les familles des Capridae et des Antilopidae. Ces trois groupes de mammifères à cornes sont réunis quelques années plus tard dans un même ensemble, et même si la classification interne de ce taxon reste débattue jusqu'au XXIe siècle (voir infra), son contenu reste quasiment inchangé[2]. La francisation en « Bovidés » est attestée depuis le milieu du XIXe siècle[réf 1] et, si les espèces portent individuellement des noms vernaculaires d'origines variées, elles sont collectivement nommées en français selon trois grands groupes qui font miroir aux trois familles initialement décrites par Gray :
- les bovins, qui regroupent le bœuf domestique et les autres espèces domestiquées (zébu, yack, etc.), ainsi que leurs proches parents sauvages (aurochs, bisons, buffles, etc.) ;
- les caprins (et ovins), qui rassemblent les chèvres, les moutons et les espèces sauvages apparentées (bouquetins, chamois, mouflons, etc.) ;
- les antilopes, qui sont un groupe « fourre-tout » dans lequel ont été classés tous les bovidés n'appartenant pas aux deux autres ensembles et qui contient un grand nombre d'espèces sauvages principalement africaines (gazelles, gnous, cobes, dik-diks, etc.).
Caractéristiques
Les Bovidés sont des mammifères placentaires (chez qui la gestation s'effectue dans l'utérus, par l'intermédiaire du placenta), onguligrades (marchant sur des ongles transformés en sabots) et paraxoniques (dont le poids du corps est supporté à parts égales par les troisième et quatrième doigts). Ce sont des herbivores qui possèdent un estomac spécialisé permettant la rumination, ainsi qu'une morphologie dentaire adaptée à la préhension et au broyage de la matière végétale fibreuse. Leur caractéristique déterminante reste cependant la présence de cornes permanentes et non ramifiées, au moins chez les mâles adultes.
Morphologie générale
Les Bovidés présentent un éventail de tailles extrêmement large, de la minuscule antilope royale et des dik-diks, qui ne pèsent que 2 kg et mesurent de 25 à 35 cm au garrot, jusqu'au buffle d'eau, qui peut peser jusqu'à 1 200 kg, et au gaur, qui atteint 220 cm. La forme du corps varie entre des espèces relativement petites, aux membres élancés et au cou fin, comme les gazelles, et des animaux massifs et trapus comme les bovins sauvages. Les membres antérieurs peuvent être plus grands que les postérieurs, ou l'inverse, comme chez les céphalophes vivant dans les forêts tropicales denses. Les couleurs du pelage sont également très variées, bien que la plupart des espèces présentent une certaine nuance de brun. Les antilopes, qui comptent sur la dissimulation pour éviter les prédateurs, ont souvent une coloration cryptique. Les rayures et les taches des guibs, des bongos ou des koudous font également office de camouflage en contribuant à perturber la silhouette des animaux[3].
- Silhouettes de quelques bovidés
.jpg.webp) Dik-dik de Kirk (Madoqua kirkii).
Dik-dik de Kirk (Madoqua kirkii). Bouquetin des Alpes (Capra ibex).
Bouquetin des Alpes (Capra ibex). Gnou bleu (Connochaetes taurinus).
Gnou bleu (Connochaetes taurinus)..jpg.webp) Springbok (Antidorcas marsupialis).
Springbok (Antidorcas marsupialis). Bison d'Amérique (Bison bison).
Bison d'Amérique (Bison bison). Saïga (Saiga tatarica).
Saïga (Saiga tatarica).
La plupart des Bovidés sont sexuellement dimorphiques, en raison de la compétition reproductive. Les mâles et les femelles adultes d'une espèce peuvent différer par la taille, la couleur, la forme et surtout par le développement des cornes. Les espèces ayant un système de reproduction polygyne, un comportement diurne ou vivant dans des habitats ouverts ont tendance à présenter un dimorphisme sexuel plus important. Les différences entre sexes sont en revanche bien plus modérées pour les espèces monogames, et chez certaines antilopes naines, la femelle est parfois légèrement plus grande que le mâle[4].
Cornes
L'une des caractéristiques principales de la famille, qui la distingue de tous les autres ruminants, est la présence de cornes permanentes et non ramifiées. Elles sont attachées aux os frontaux du crâne, et sont composées d'un noyau osseux recouvert d'une gaine de kératine qui ne se détache jamais, avec un espace vide séparant ces deux couches. La taille et la forme des cornes sont très variables, et elles ont souvent un profil spiralé, torsadé ou cannelé. Parmi les bovidés sauvages, seule l'antilope tétracère présente quatre cornes chez les mâles : toutes les autres espèces ne possèdent qu'une seule paire, à l'exception de certaines chèvres et moutons domestiques. La croissance des cornes se poursuit tout au long de la vie de l'animal, ce qui fait que leur taille et le nombre d'anneaux peuvent être utilisés pour déterminer l'âge. Les cornes des juvéniles sont souvent très différentes du stade final atteint chez l'adulte, et peuvent parfois ressembler à celles d'une autre espèce non apparentée[3].
- Diversité des cornes de bovidés dans la série The great and small game de Richard Lydekker (1900-1908)
_(14597153188).jpg.webp) Bovins asiatiques.
Bovins asiatiques..jpg.webp)
_(7971642314).jpg.webp) Bison d'Europe et caprins eurasiatiques.
Bison d'Europe et caprins eurasiatiques._(6684223763).jpg.webp) Élands et hippotragues.
Élands et hippotragues._(6684221859).jpg.webp) Impalas et damalisques.
Impalas et damalisques._(6684223193).jpg.webp) Gazelles et beira.
Gazelles et beira.
Les cornes sont les armes avec lesquelles les mâles de toutes les espèces rivalisent pour la domination et le succès reproductif (voir infra). Les cornes sont présentes chez les femelles de certains genres, mais elles sont généralement plus petites et invariablement plus fines et plus faibles, ce qui reflète une mise à l'épreuve beaucoup moins rigoureuse au combat. Les preuves fossiles indiquent que ces appendices ont d'abord évolué chez les mâles, et seulement plus tard chez les femelles de différentes lignées, à différentes époques. Chez ces dernières, elles sont utilisées comme armes d'autodéfense ou, imitant les cornes des juvéniles, permettent de réduire le harcèlement des adolescents par les mâles matures. Lorsque les cornes sont présentes chez les deux sexes, elles cessent en effet d'être un signe de masculinité et les jeunes mâles sont moins susceptibles d'être distingués jusqu'à ce qu'ils cessent de ressembler aux femelles. Chez certaines antilopes migratrices comme les oryx ou les gnous, la ressemblance se poursuit à l'âge adulte et facilite la formation de troupeaux mixtes[5].
Les cornes des Bovidés se distinguent des bois, caractéristiques de la famille des cervidés, qui sont constitués d'os sans kératine et ne sont pas permanents. L'antilope d'Amérique, unique représentant vivant de la famille des Antilocapridae, possède quant à elle des appendices semblables aux cornes, mais qui sont ramifiés chez le mâle et tombent chaque année. Les girafes montrent des processus osseux permanents et recouverts de peau et de poils, appelés ossicônes, qui sont situés sur les sutures entre les os frontaux et pariétaux. Les « cornes » des rhinocéros n'ont pas de noyau ou de gaine, mais sont au contraire constituées d'une multitude de cellules épidermiques formant des fibres cornées semblables à des poils épais. Enfin, les défenses des phacochères et d'autres porcins sont en réalité des canines allongées, à croissance continue[6].
Sabots
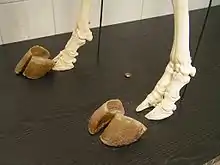
Les sabots sont des ongles modifiés, c'est-à-dire des structures kératiniques gainant l'os terminal de chaque orteil. Contrairement aux griffes et aux ongles, ils constituent le principal point de contact entre les pattes et le sol, et permettent la locomotion onguligrade. Comme tous les Artiodactyles, les Bovidés ont des membres paraxoniques, pour lesquels deux doigts bien développés, les troisième et quatrième, supportent tout le poids du corps. Les deuxième et cinquième doigts sont soit absents, soit réduits et forment les sabots latéraux ou ergots[7].
Parmi les autres Artiodactyles, les Suidae, les Hippopotamidae et les Tragulidae ont quatre doigts complets et fonctionnels. Les Tayassuidae ont quatre doigts aux membres antérieurs, et seulement deux aux membres postérieurs. Les Antilocapridae, les Camelidae et les Giraffidae n'ont jamais de doigts latéraux ou d'ergots, alors que les Cervidae en ont systématiquement. Le poids du corps des Périssodactyles est quant à lui entièrement supporté par le troisième doigt (membres mésaxoniques). Ces ongulés ont un nombre impair de sabots ou d'ongles aux membres postérieurs : trois chez les Rhinocerotidae et les Tapiridae, et un seul chez les Equidae[réf 2].
Squelette et denture
Au niveau du crâne, les prémaxillaires existent en tant qu'éléments séparés et se suturent souvent avec les os nasaux ainsi qu'avec les maxillaires. Les orbites sont entièrement cerclées d'os, qui sont généralement tubulaires. Un seul canal lacrymal est généralement présent. Il n'y a pas de crête sagittale sur le crâne. Les cornes émergent au-dessus et en arrière des orbites, sur les os frontaux. La suture interfrontale est évidente. Un os interpariétal est présent. La colonne des Bovidés est composée de 7 vertèbres cervicales, 13 thoraciques, 6 à 7 lombaires, 4 à 5 sacrées et 16 à 20 caudales. Les clavicules sont absentes et les omoplates sont longues, de forme oblongue, avec des bords dorsaux cartilagineux proéminents. L'ulna est soudé au radius et le fibula au tibia. Dans le tarse, l'os naviculaire est soudé à l'os cuboïde. Les métapodes III et IV sont soudés le long de la ligne médiane, et II et V sont rudimentaires. Les phalanges III et IV sont raccourcies et entourées de sabots[7].
- Squelettes complets de quelques bovidés

 Mouflon canadien.
Mouflon canadien.
 Gnou bleu.
Gnou bleu.
La formule dentaire est la même pour la plupart des espèces (voir tableau), même si certaines antilopes comme le springbok ou les gnous ont perdu la seconde prémolaire inférieure[8]. Les incisives supérieures sont absentes et sont remplacées par une zone de tissu épais et résistant, appelée bourrelet gingival, qui constitue une surface de préhension pour les matières végétales. Les canines supérieures sont réduites ou absentes. Les incisives inférieures font saillie vers l'avant et sont rejointes par des canines modifiées qui imitent les incisives. Elles sont suivies d'un long espace édenté appelé diastème[7].
| Formule dentaire | |||||||
|---|---|---|---|---|---|---|---|
| mâchoire supérieure | |||||||
| 3 | 3 | 0 | 0 | 0 | 0 | 3 | 3 |
| 3 | 3 | 1 | 3 | 3 | 1 | 3 | 3 |
| mâchoire inférieure | |||||||
| Total : 32 | |||||||
| Denture typique des Bovidés | |||||||
Les préférences alimentaires (voir infra) ont une influence sur l'anatomie des muscles masticateurs, sur la morphologie crânio-mandibulaire et sur les caractéristiques dentaires. Les adaptations au broutage modifient généralement la mâchoire antérieure et sont principalement associées à la préhension de matériel végétal. Comme les feuilles comestibles ont tendance à se présenter sous forme de grappes variables dans l'espace, les brouteurs ont un museau adapté à la préhension sélective pendant le fourrageage, comme un prémaxillaire haut et étroit sur le crâne. La mandibule antérieure se caractérise quant à elle par une symphyse relativement étroite, une arcade incisive relativement ronde et des incisives centrales plus grandes que les incisives latérales. Les adaptations au pâturage sont en contraste associées à la transformation des aliments. Les graminées sont en effet plus denses que les feuilles et les fruits et peuvent être consommées en plus grande quantité par bouchée. Les pâtureurs ont donc généralement des museaux plus larges et plus plats, avec des incisives plus larges et plus saillantes. La mastication d'aliments plus résistants nécessite une plus grande résistance à l'usure des dents et une plus grande pression occlusale appliquée sur la matière végétale. Les ruminants pâtureurs ont généralement des prémolaires plus courtes que les molaires, un diastème plus allongé et des muscles masséters plus grands que ceux des brouteurs[9].
Système digestif
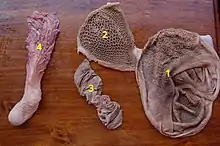
Les Bovidés se nourrissent de matière végétale obtenue par broutage ou par pâturage. Les herbes sont amenées dans la bouche par les lèvres et la langue, où elles sont coupées par les incisives inférieures qui appuient sur le bourrelet gingival, puis envoyées vers le pharynx par un mouvement rapide de la tête vers le haut. Les plantes plus dures comme les pousses d'arbustes sont sectionnées par les prémolaires et les molaires. Selon le régime alimentaire, les incisives peuvent être larges (spatulées) et de taille relativement uniforme, comme chez les pâtureurs, ou plus étroites et souvent de tailles différentes, comme chez les brouteurs. Le système digestif des ruminants est caractérisé par des adaptations fonctionnelles et anatomiques qui leur permettent de libérer l'énergie alimentaire autrement indisponible dans les matières végétales fibreuses, principalement dans la cellulose. Sa caractéristique importante est la présence d'une fermentation microbienne avant l'activité de digestion gastrique et intestinale. Elle se produit principalement dans la panse (ou rumen), le premier des quatre compartiments de l'estomac, qui comprend également le réseau et le feuillet (qui servent de filtres), ainsi que la caillette (le véritable estomac enzymatique)[10].
Glandes odoriférantes

Les glandes odoriférantes sont des amas denses de cellules, généralement en forme de gourde, provenant des follicules pileux. Leurs sécrétions chimiquement complexes transmettent des informations sur l'identité, le sexe, l'âge et le statut social et reproductif de l'individu. Les plus courantes et les plus importantes sont les glandes du sabot, ou glandes interdigitales, et les glandes pré-orbitales. Les sécrétions des premières, qui sortent de la fente entre les sabots, laissent une trace odorante qui aide les antilopes à se suivre. Les secondes sont situées à l'avant des cavités orbitaires et servent principalement à marquer les objets. Les bovidés femelles possèdent en outre une ou deux paires de glandes mammaires fonctionnelles[10].
Écologie et comportement
L'extraordinaire processus de spéciation des Bovidés (voir infra) représente principalement une radiation hors de la forêt, d'où les ruminants sont originaires, vers les espaces ouverts et plus ou moins arides. Cette sortie a nécessité toute une série de changements évolutifs, souvent à l'opposé des adaptations à la vie en forêt. Les différences entre les espèces qui ont franchi cette étape et celles qui ne l'ont pas fait ont créé une dichotomie fondamentale chez les bovidés actuels[11]. Son analyse indique que l'habitat, la morphologie, la coloration, le degré de dimorphisme sexuel, le régime alimentaire, le mode de locomotion, la stratégie anti-prédateur, le système d'accouplement et l'organisation sociale sont tous coadaptés. L'importance de ces différences est illustrée en comparant les céphalophes, des antilopes solitaires adaptées à des habitats fermés, et les oryx, des antilopes qui vivent en troupeaux dans les milieux ouverts[12].
| Espèces des forêts | Espèces des plaines | |
|---|---|---|
| Genre | Cephalophus | Oryx |
| Image | _female_eating_some_fruit_..._(51930624187).jpg.webp) |
 |
| Habitat | Forêts de plaine et de montagne | Zones arides |
| Taille | Petite à moyenne (4,5-64 kg), femelles légèrement plus grandes que les mâles | Grande (105-205 kg), mâles considérablement plus grands que les femelles |
| Cornes | Courtes (5-25 cm), en pointes | Longues (jusqu'à 120 cm), droites ou courbes |
| Glandes pré-orbitales | Présentes et développées chez les deux sexes | Vestigiales ou absentes |
| Conformation | Membres postérieurs plus élevés que les membres antérieurs, dos arrondi, pattes relativement courtes, sabots présentant une grande fente interdigitale et un large écartement | Membres postérieurs et antérieurs également développés, dos plat, pattes relativement longues, sabots présentant une fente interdigitale réduite et un faible écartement |
| Régime alimentaire | Broutage (frugivorie) | Pâturage |
| Allures | Marche croisée (en diagonale) | Marche à l'amble (en parallèle) |
| Trot rarement observé | Trot long et progressif | |
| Course d'esquive, entrecoupée de sauts à plat, tête et cou bas | Galop rapide de cheval, tête haute ou au niveau des épaules | |
| Organisation sociale | Solitaire ou monogame, sédentaire, petit territoire | Grégaire, polygyne, nomade, grand territoire |
| Reproduction | Tout au long de l'année, maturité sexuelle à 1 ou 2 ans chez les deux sexes | Saisonnière, femelle mature à 3 ans, mâle à 4 ou 5 ans |
| Réaction au danger | Se met à l'abri et se cache | Fuit à découvert |
Régime alimentaire
Les Bovidés et les autres herbivores ont été traditionnellement classifiés soit comme brouteurs, soit comme pâtureurs. Les premiers se nourrissent par sélection des feuilles, des jeunes pousses ou des fruits de plantes dicotylédones généralement ligneuses, comme les arbustes. Les seconds sont des mangeurs de monocotylédones, c'est-à-dire des herbes et des fibres qui sont généralement plus abrasives. À ces deux régimes s'ajoute une catégorie intermédiaire dont les membres ont une alimentation mixte basée sur un mélange de matériaux dicotylédones et monocotylédones à travers l'espace et les saisons[9]. Les préférences alimentaires ont une influence directe sur la morphologie crânienne et la denture (voir supra), ainsi que sur la taille des différentes espèces : les plus grands bovidés sont des pâtureurs, alors que les plus petits sont des brouteurs. Cette corrélation s'explique par le fait que les animaux plus petits ont des besoins énergétiques proportionnellement plus élevés par rapport à leur masse corporelle, alors que les animaux de plus grande taille conservent les aliments dans leur tube digestif pendant de plus longues périodes et sont donc capables de digérer des aliments plus fibreux. Dans la plupart des écosystèmes, les aliments de qualité supérieure (jeunes feuilles et fruits) sont relativement rares, alors que les plantes riches en fibres et de faible qualité (tiges, feuilles matures, herbes) sont abondantes. Ces facteurs limitent ainsi les petits bovidés à des régimes alimentaires composés d'aliments de haute qualité nutritionnelle et facilement digestibles, alors que les grands bovidés peuvent subsister avec de grandes quantités d'aliments de qualité inférieure[14].
- Exemples d'alimentation de bovidés
.jpg.webp) Bison d'Amérique (pâturage).
Bison d'Amérique (pâturage). Oryx algazelle (pâturage).
Oryx algazelle (pâturage). Chèvre domestique (broutage).
Chèvre domestique (broutage)..jpg.webp) Gérénuk (broutage).
Gérénuk (broutage).
Plusieurs classifications plus détaillées des régimes alimentaires des Bovidés ont été proposées. La plus récente et la plus précise est basée sur les parts respectives de monocotylédones (c'est-à-dire toutes les formes de graminées, de roseaux et de carex), de dicotylédones (comprenant les feuilles, les bourgeons, les pousses, les ramilles, les fleurs et boutons floraux des arbres, des arbustes, des plantes semi-aquatiques et des plantes non herbacées) et de fruits (incluant les fruits à proprement parler, mais aussi les tubercules, les bulbes, les organes de réserve, les plantes succulentes, les gousses et les graines) dans l'alimentation de chaque espèce[15]. D'abord restreinte aux bovidés africains, puis étendue aux espèces des autres continents[16], l'étude a permis d'établir six catégories de régimes alimentaires (voir graphique). Cette classification comprend un véritable régime « généraliste », reconnaît la frugivorie comme une stratégie alimentaire distincte du broutage, et distingue deux types de pâtureurs sur la base des proportions relatives de monocotylédones et du degré de variabilité saisonnière et géographique[14].
| Catégorie | # | Stratégie alimentaire | Fruits | Dicot. | Monocot. |
|---|---|---|---|---|---|
| Broutage | 1 | Frugivores | > 70 % | < 3 % | |
| 2 | Brouteurs | > 70 % | |||
| Alimentation mixte | 3 | Brouteurs-pâtureurs | < 20 % | < 70 % | < 60 % |
| 4 | Généralistes | > 20 % | > 20 % | > 20 % | |
| Pâturage | 5 | Pâtureurs variables[N 1] | 60-90 % | ||
| 6 | Pâtureurs stricts | > 90 % |
Certaines tribus de Bovidés ont des régimes alimentaires spécialisés, alors que d'autres montrent une variété de stratégies d'alimentation. Les Cephalophini sont ainsi les seules espèces véritablement frugivores (à l'exception du genre Sylvicapra)[14], certaines dépendant directement des habitudes de gaspillage alimentaire des primates, des calaos ou des chauves-souris[18]. L'alimentation des Reduncini, des Alcelaphini et des Hippotragini repose au contraire exclusivement sur le pâturage[14] : les premiers se sont spécialisés dans l'exploitation des formations herbeuses des vallées fluviales tropicales, les seconds sont des pâtureurs écotones de grande taille des habitats ouverts et ont tendance à vivre à des densités relativement élevées, alors que les derniers se sont adaptés aux habitats arides ou aux zones appauvries et vivent, pour la plupart, à de faibles densités. À l'autre extrémité du spectre, les Neotragini sont des brouteurs minuscules et solitaires qui se nourrissent de feuillage au niveau du sol dans les forêts ou à la lisière de celles-ci[18]. Bien que moins spécialisés, les Tragelaphini tendent dans l'ensemble à préférer les dicotylédones. Il est intéressant de noter que le Sitatunga, seul pâtureur de la tribu, a une morphologie mandibulaire très différente de celles des autres espèces et qui montre de nombreuses convergences avec celle de Reduncini. Le même phénomène est observable chez le buffle d'Afrique, qui s'est différencié des autres Bovini pour adopter un régime exclusivement basé sur le pâturage[19]. En revanche, et bien qu'ils soient principalement associés aux habitats herbeux, les Antilopini affichent une grande variété de stratégies alimentaires. Ce manque de correspondance s'explique par le fait que les dicotylédones et les fruits sont également présents en quantités suffisantes dans ces habitats pour nourrir des espèces non pâturantes, comme le gérénuk (Litocranius walleri)[20]. Les Caprini sont également peu spécialisés, même s'ils comptent un nombre important de pâtureurs variables. Ayant évolué en Eurasie en compétition directe avec les cervidés, beaucoup ont colonisé les habitats de montagne entre deux glaciations et se sont adaptés à des variations saisonnières extrêmes de leur régime alimentaire[18].
Locomotion et postures

La marche des Bovidés peut être divisée en deux types : la marche croisée et la marche à l'amble. Dans la première, les pattes avant et arrière d'un côté du corps se rapprochent et les pattes de l'autre côté du corps s'éloignent l'une de l'autre, tandis que dans la seconde, les pattes avant et arrière d'un même côté du corps avancent de façon synchrone[réf 3]. Les céphalophes, les antilopes naines, les tragélaphes, les caprins, les ovins et les bovins pratiquent la marche croisée, alors que les gazelles, les gnous, les bubales, les cobes et les oryx marchent à l'amble[21].
Tous les membres de la famille savent probablement trotter, mais à l'exception de certaines antilopes qui la favorisent, comme les oryx, les gérénuks ou les élands, il s'agit de la démarche la moins utilisée. Un nombre relativement restreint d'espèces, tels les gnous, les damalisques, les oryx, l'hippotrague noir ou la gazelle dorcade, effectuent un trot stylisé et exagéré, dans lequel les pattes avant sont levées haut. Cette démarche intervient généralement lorsqu'elles sont légèrement excitées ou alarmées, comme alternative ou en addition du trot classique. Les antilopes de plaine, notamment les gazelles, les damalisques, les bubales, les dik-diks et les ourébis, pratiquent également une démarche bondissante appelée stotting. Elle exprime l'excitation et fonctionne comme un signal d'alerte ou d'avertissement, dont la visibilité est augmentée par la tache blanche que possèdent la plupart de ces espèces sur la croupe[21].
Organisation sociale

Les schémas d'organisation sociale des Bovidés peuvent être classés en quatre catégories en fonction de deux critères : comportement grégaire ou solitaire et comportement territorial ou non-territorial[22]. Les espèces grégaires et territoriales sont les plus nombreuses et ce type d'organisation est particulièrement commun parmi les Antilopinae africaines de grande taille. Les femelles et les juvéniles s'associent dans des troupeaux qui contiennent généralement un seul mâle adulte, à savoir le « propriétaire » du territoire. Les mâles sans territoire s'associent dans des troupeaux de célibataires, qui sont généralement tenus à l'écart des femelles et des juvéniles. Les femelles sont libres de rester indéfiniment dans leur troupeau natal et sur leur territoire initial, tandis que les mâles sont contraints de se disperser lorsqu'ils acquièrent leurs caractères sexuels secondaires. La dispersion et la compétition entre adultes sont associés à des taux de mortalité plus élevés chez les mâles, qui conduit à un rapport des sexes déséquilibré en faveur des femelles, ce qui favorise la polygynie[23].
La catégorie des espèces grégaires non-territoriales comprend surtout les Bovinae, ainsi que la plupart des caprins. Dans ces sociétés, le succès reproductif des mâles est basé sur la domination absolue sur les autres mâles plutôt que sur la domination d'un site particulier. Cette forme plus directe de compétition privilégie la taille et la puissance, ce qui fait que la croissance des mâles dure plus longtemps que chez la plupart des espèces territoriales et conduit à un dimorphisme sexuel très marqué. Chez les bovins, les mâles peuvent continuer à grandir pendant la majeure partie de leur vie, faisant de la domination une fonction d'ancienneté. Chez les moutons et les chèvres, comme chez les koudous et les nyalas, les cornes poursuivent leur croissance après la maturité, de sorte que leur longueur et leur forme sont des indicateurs fiables de l'âge et du potentiel de combat. La ségrégation des sexes, sauf pour la reproduction, est la règle générale, même si certaines espèces comme le buffle d'Afrique vivent en troupeaux mixtes[21].
_couple_(17971839508).jpg.webp)
Les dik-diks, les raphicères, les oréotragues, les ourébis et d'autres antilopes naines, ainsi qu'au moins certains céphalophes, vivent au contraire en couples monogames et entretiennent ensemble un petit territoire qu'ils quittent rarement ou jamais. Chaque membre de la paire exclut les étrangers de son propre sexe, en marquant le territoire avec des sécrétions de la glande pré-orbitale et des tas d'excréments, et maintient le lien avec son partenaire par de fréquentes interactions tactiles et olfactives. Les jeunes des deux sexes se dispersent pendant l'adolescence et le sex-ratio à l'âge adulte est équilibré. Les mâles doivent gagner un territoire et les femelles doivent trouver un mâle non accouplé avant de pouvoir se reproduire[23]. Enfin, le guib harnaché est la seule espèce qui soit véritablement solitaire et non-territoriale : chaque adulte possède une petite zone centrale exclusive où il se repose et se cache, mais les territoires se chevauchent largement et bien que les individus d'une même localité soient vaguement associés, ils ne forment pas de troupeaux. Le sitatunga montre une organisation sociale assez proche, mais dans laquelle un couple de femelles et leurs petits peuvent former des troupeaux lâches. L'espèce représente une transition entre les versions solitaires et grégaires du système non-territorial[21].
Combats entre mâles
Les cornes des Bovidés ont principalement évolué dans le contexte de la sélection sexuelle comme armes de compétition intraspécifique. Les mâles qui gagnent les combats obtiennent un territoire ou la dominance dans un troupeau mixte et accèdent ainsi aux femelles en œstrus. La capacité de combat est donc positivement corrélée au succès reproductif au cours de la vie[24].




La morphologie des cornes (voir supra) reflète des différences dans le comportement de combat, lequel peut être grossièrement subdivisé en trois catégories. La première est représentée par les espèces dont les cornes sont petites et en forme de pointe. Les combattants se tiennent parallèlement ou antiparallèlement l'un à l'autre et les coups perçants sont dirigés vers le flanc ou le ventre de l'adversaire. La deuxième est occupée par les espèces dotées de cornes plus grandes et plus complexes. Les coups sont toujours dirigés vers le flanc ou le ventre de l'adversaire, mais comme les cornes sont utilisées de manière à la fois offensive et défensive, l'orientation se fait généralement tête à tête. La troisième catégorie comprend les espèces aux cornes massives pour lesquelles la tête elle-même est généralement la cible principale, que ce soit pour heurter le front de l'adversaire ou pour bloquer ses cornes et tenter de le déséquilibrer[25]. Un certain nombre de techniques de combat, dont l'emploi varie en fonction des espèces, ont en outre été décrites[26] :
- Boxing (« boxe ») : combat de faible intensité au cours duquel le menton est rentré jusqu'à ce que les cornes de deux adversaires entrent en contact, par un mouvement appelé « hochement de tête ». Exemples : gazelles, damalisques, bubales ;
- Clash-fighting (« combat de choc ») : les adversaires échangent des coups violents à courte distance, en sautant en arrière entre les frappes. Exemples : style prédominant des petites gazelles (genre Gazella), ainsi que des damalisques et du cobe à croissant ;
- Fencing (« escrime ») : variante du précédent observable chez les oryx, dans laquelle les adversaires échangent des coups courts mais puissants vers l'avant et sur le côté avec leurs cornes longues et droites tout en s'affrontant la tête baissée, généralement en restant au même endroit. Les bouquetins et d'autres caprins se dressent sur leurs pattes arrière en prélude au choc des cornes, intensifiant ainsi leurs coups d'avant en arrière ;
- Front-pressing (« pression frontale ») : les combattants s'efforcent de se pousser l'un l'autre vers l'arrière avec les cornes croisées et fermement verrouillées près de leur base, et la tête abaissée parallèlement au sol de manière que les cornes pointent vers l'avant. Ils utilisent pour cela toute la gamme des mouvements de combat (en avant, sur le côté, vers le haut, en torsion et même en arrière). Exemples : style plus développé chez les espèces à longues cornes, particulièrement chez la gazelle de Grant, les impalas, les cobes, les oryx, les koudous et les élands ;
- Push-fighting (« combat de poussée ») : les combattants se poussent vers l'avant au lieu de se désengager, mais sans verrouiller les cornes. Il s'agit d'une forme de transition entre le clash-fighting et le front-pressing ;
- Ramming (« éperonnage ») : forme de clash-fighting pratiquée par les espèces dont les cornes et le crâne sont spécialement adaptés pour absorber les chocs, comme le mouflon canadien ou le buffle d'Afrique. Les combattants font un saut en courant et se frappent la tête avec une force colossale ;
- Fight-circling (« combat en cercle ») : les adversaires qui se battent avec les cornes fermement verrouillées pivotent la tête, tout en tirant et en secouant violemment pour tenter de se désengager ;
- Horn-pressing (« pression des cornes ») : les combattants engagent les surfaces avant de leurs cornes et essaient de repousser celles de l'adversaire sur son cou. Cette technique se prolonge par le front-pressing lorsque les cornes s'emboîtent. Elle est assez répandue, mais surtout développée chez les espèces à longues cornes, comme la gazelle de Grant, et les antilopes à cornes spiralées, comme les koudous ;
- Parallel fighting (« combat parallèle ») : les combattants se tiennent côte à côte avec les cornes entrecroisées et luttent avec le cou ou latéralement avec les cornes, en tentant de crocheter par-dessus ou sous la garde de l'adversaire. Cette forme de combat est commune entre mâles immatures chez les oryx et les hippotragues, et parfois pratiquée avec les cornes intérieures imbriquées par le mouflon à manchettes et d'autres bovidés aux cornes crochues qui s'étendent latéralement ;
- Air-cushion fighting (« combat sur coussin d'air ») : les combattants effectuent les différentes manœuvres d'attaque et de parade utilisées dans les combats réels, mais sans entrer en contact, comme si un coussin invisible avait été placé entre leurs cornes.
Reproduction
_mating_ritual_composite.jpg.webp)
Les Bovidés se reproduisent généralement une fois par an, souvent deux fois chez les petites espèces. Ils donnent naissance à un seul petit, après des périodes de gestation allant de 6 mois chez les gazelles et les antilopes naines, à 8 ou 9 mois chez les espèces moyennes et grandes. La progéniture maximale observée est de 14 petits au cours de la vie d'une femelle. En Afrique, la plupart des espèces se reproduisent pendant la saison des pluies, et dans les régions équatoriales à deux saisons humides, beaucoup montrent un pic de mise-bas secondaire. Chez les espèces non-saisonnières, les femelles recommencent à avoir des chaleurs (œstrus post-partum) un mois ou deux après la mise-bas. L'œstrus ne dure généralement pas plus de 24 heures chez les espèces territoriales, alors qu'il s'étend sur plusieurs jours chez les espèces non-territoriales, chez lesquelles les mâles tentent de créer des liens exclusifs avec les femelles en chaleur. Celles-ci signalent généralement leur réceptivité en permettant la montée et en écartant la queue. La copulation ne dure que quelques secondes et consiste en une seule éjaculation après l'intromission[27].
.jpg.webp)
Chez la plupart des espèces, la progéniture se cache au début de sa vie (entre une semaine et deux mois selon les espèces). Les nouveau-nés restent immobiles, sauf en cas de danger imminent, et ne sortent que lorsque leur mère les appelle pour les nourrir, puis cherchent eux-mêmes une nouvelle cachette. Leurs glandes odoriférantes restent inactives pendant la phase de dissimulation, et les déchets corporels sont retenus jusqu'à ce que leur évacuation soit stimulée par le léchage de la mère. Celle-ci reste généralement sur ses gardes mais à bonne distance de la cachette, et ne récupère pas sa progéniture plus de deux à quatre fois par période de 24 heures. Après la période de dissimulation où il rejoint le troupeau, le veau passe relativement peu de temps en compagnie de sa mère. Il ne se déplace jamais à côté d'elle, mais court devant et traîne derrière elle en alternance. Chez les espèces les plus sociables, les juvéniles forment généralement des sous-groupes entre eux (crèches) et ne recherchent leur mère que pour l'allaitement et lorsque le troupeau entreprend des mouvements généraux. Les mâles monogames peuvent prendre la défense de leur progéniture, mais chez les espèces polygynes, ils ne fournissent généralement aucun soin parental et seule la mère se bat activement contre les prédateurs. Les bovins déploient quant à eux une défense collective, alors que les chèvres et les moutons utilisent les falaises comme refuges pour les adultes et les jeunes[27].
Communication
Défense contre les prédateurs
Distribution et habitat
Les Bovidés sont principalement des mammifères de l'Ancien Monde, même si un petit nombre d'espèces ont franchi le détroit de Béring et colonisé l'Amérique du Nord. Ils se sont particulièrement diversifiés en Afrique subsaharienne, qui abrite plus de la moitié des taxons sauvages et dont sont endémiques la plupart des « antilopes ». L'aire de répartition des bovins est très étendue, de l'anoa des plaines à Célèbes au bison d'Amérique qui évoluait historiquement jusqu'au Salvador, et qui constitue le plus gros mammifère vivant des Amériques. La tribu ne compte cependant qu'une seule espèce africaine : le buffle d'Afrique. Les caprins ont eux aussi une large distribution jusqu'en Arctique, mais cantonnée à l'hémisphère Nord, et sont très peu présents en Afrique.
L'habitat naturel des Bovidés est très varié et s'étend depuis les régions arctiques jusqu'aux zones tropicales, et en particulier dans les régions de prairies et de savane.
Taxinomie et systématique
Selon les termes du systématicien américain George Gaylord Simpson, la famille des Bovidae constitue l'un des groupes de mammifères les plus difficiles à classifier. Dans l'esprit populaire, ainsi que dans de nombreuses classifications historiques, le taxon est pourtant assez clairement défini comme comprenant trois groupes d'animaux : les « bœufs », les « moutons et les chèvres », et les « antilopes » — ce dernier terme étant utilisé pour inclure toutes les espèces n'appartenant pas manifestement à l'un des deux autres ensembles[28]. L'origine, le développement et les relations au sein de la famille, longtemps mal connus, ont cependant nourri de nombreux débats. La classification des Bovidés, en particulier en ce qui concerne la reconnaissance des sous-familles et des tribus, est ainsi remarquable pour son manque de consensus[29].
Historique
Dans la dixième édition de son Systema naturae, qui signe le début de la classification scientifique des espèces animales, Carl von Linné propose trois « genres » : Bos pour les bovins, Ovis pour les moutons et Capra pour les chèvres, les chamois, les bouquetins et les antilopes. Aux côtés de Cervus (cervidés et girafes), Camelus (camélidés) et Moschus (chevrotains porte-musc), ces animaux forment l'ordre des Pecora (« les troupeaux »), l'un des rares regroupements linnéens resté valide jusqu'au XXIe siècle[30]. Cet arrangement est adapté en 1821 au concept de famille par le zoologiste britannique John Edward Gray : Cervidae, Camelidae, Giraffidae, Moschidae, Antilopidae, Capridae (pour Capra et Ovis) et Bovidae (pour le seul genre Bos)[31]. Le même auteur décide trois ans plus tard d'étendre la famille des Bovidae à l'ensemble des ruminants et décrit au sein de ce groupe une « tribu » des Bovina qui correspond déjà aux Bovidés dans leur acception moderne[32].
Ce consensus précoce vole cependant en éclats lorsque devient évident l'artifice de l'assemblage des « antilopes », dont les membres n'ont pas plus en commun entre eux qu'avec les moutons ou les bœufs. Gray n'a de cesse pendant toute sa carrière de réviser sa classification initiale, et ses découpages successifs atteignent leur paroxysme en 1872 lorsqu'il propose un système à 15 familles. Les auteurs ultérieurs s'accordent presque universellement pour placer toutes ces formes dans l'unique famille des Bovidae, mais ils utilisent des sous-familles là où Gray utilisait des familles, et l'arrangement reste fondamentalement le même : 9 sous-familles chez Flower et Lydekker 1891, 7 sous-familles pour les seules antilopes chez Sclater et Thomas 1894-1900, ou encore 16 sous-familles chez Pocock 1910. Ces classifications sont jugées très insatisfaisantes et rendent impossible une vue d'ensemble de la famille, car les faits ne suggèrent pas vraiment que 10 ou 15 groupes de bovidés soient coordonnés sans qu'il n'y ait de relation particulière entre deux ou plusieurs d'entre eux[28].
Un effort important pour surmonter ces difficultés est effectué en 1904 par le paléontologue allemand Max Schlosser, en séparant la famille en deux grands groupes et en réduisant les 12 sous-familles considérées par lui comme valides aux rangs de tribus[33]. La subdivision de Schlosser repose principalement sur des caractères dentaires : les Aegodontia (comprenant entre autres les ovins, les caprins, les antilopes naines et les gazelles) montrent en effet des dents hypsodontes avec des molaires supérieures plus longues que larges, alors que les Boodontia (couvrant les bovins et le reste des antilopes) présentent des dents brachyodontes avec des molaires supérieures quadrangulaires. À cette distinction morphologique, d'autres auteurs ajoutent une dimension paléontologique, en affirmant par exemple que les Aegodontia auraient eu leur centre d'origine au nord de l'Himalaya et les Boodontia au sud[34]. L'hypothèse de Schlosser reste discutée pendant tout le XXe siècle, mais se trouve peu à peu contredite par des analyses chromosomiques, immunologiques et mitochondriales qui suggèrent plutôt une dichotomie marquée entre les Bovinae et tous les autres groupes[35]. La controverse se poursuit néanmoins chez les taxinomistes, qui présentent des versions très différentes de la classification des Bovidae, montrant notamment un désaccord considérable dans l'attribution des genres aux tribus et aux sous-familles et dans la définition de celles-ci : 5 sous-familles et 13 tribus chez Simpson 1945, 10 sous-familles et 28 tribus chez Haltenorth 1963, 5 sous-familles et 12 tribus chez Gentry 1992, ou encore 9 sous-familles et 17 tribus chez Grubb 2001. Ces dissensions sont particulièrement vives autour du placement de quatre genres monotypiques dont les affinités morphologiques et biogéographiques avec les autres taxons sont complexes : Aepyceros (impala), Pantholops (antilope du Tibet), Saiga (saïga) et Pelea (péléa)[36]. Dans la troisième édition de Mammal Species of the World parue en 2005, Peter Grubb conserve un système à huit sous-familles, tout en admettant la monophylie probable du clade réunissant tous les Bovidés hors Bovinae, et en soupçonnant que certaines des sous-familles conventionnelles sont paraphylétiques, voire polyphylétiques[37].
Apports de la recherche moléculaire
| Arbre phylogénétique des Bovidés[38] | |
|
Débutées dans les années 1990, les études de phylogénétique moléculaire ont peu à peu permis de résoudre les principales controverses suscitées par la classification des Bovidés. Elles ont commencé par confirmer la monophylie du taxon et sa division en deux clades bien distincts : la sous-famille conventionnelle des Bovinae et l'ensemble des autres groupes précédemment décrits, rassemblés dans une sous-famille des Antilopinae à l'étendue révisée[39]. L'analyse du premier a soutenu le découpage en trois tribus établi par Simpson en 1945 : les Boselaphini (antilopes nilgaut et tétracère) sont en position basale d'un clade formé par les Tragelaphini (antilopes à cornes spiralées dont la division en un ou plusieurs genres fait débat) et les Bovini[40]. Parmi ces derniers, les genres Bos et Bison se sont avérés paraphylétiques, et leur étroite relation phylogénétique a conduit à l'intégration du second dans le premier[41]. La tribu comprend également le genre monotypique Pseudoryx (le saola), découvert au Viêt Nam en 1992 seulement, et que certains auteurs classaient plutôt parmi les caprins sur la base de critères morphologiques[réf 4].
Deux noms ont été initialement proposés pour le clade réunissant tous les Bovidés hors Bovinae : Aegodontia et Antilopinae (lato sensu). Le premier consiste en une redéfinition de la diagnose initialement conduite par Schlosser (voir supra), jugée problématique en ce qu'elle inclut des animaux ne présentant la morphologie dentaire à l'origine du terme (« à dents de chèvre »). Le second a été considéré comme un « nom disponible (en) » en regard du Code international de nomenclature zoologique car les définitions historiques du taxon se sont avérées non-monophylétiques, et il s'est désormais imposé en taxinomie[42]. Les Antilopinae comprenaient historiquement la tribu des Neotragini, un taxon poubelle réunissant plusieurs genres d'antilopes naines. Cet assemblage a été invalidé par la position très distante du genre Neotragus lui-même, qui a montré des affinités insoupçonnées avec Aepyceros et qui forme avec lui la branche basale du clade des non-Bovinae[41]. Les analyses mitochondriales ont montré qu'un autre genre de l'ancienne tribu, Oreotragus, formait le groupe frère des Cephalophini[43]. Les genres restants sont pleinement imbriqués dans la phylogénie des Antilopini, la plus diversifiée des tribus d'antilopes, et l'organisation interne de cette dernière a été revue pour former quatre sous-tribus : Procarpina, Raphicerina, Ourebina et Antilopina[44]. Cette dernière inclut Saiga, un genre qui était à l'origine considéré comme un proche parent de Pantholops et placé avec lui dans leur propre tribu (Saigini) parmi les caprins[41].
La monophylie des Caprinae a été confirmée par toutes les études phylogénétiques moléculaires et elle inclut le genre Pantholops en position basale. Le nom a en revanche été abandonné en faveur de Caprini, pour refléter le nouveau découpage des Bovidés en deux sous-familles seulement[39]. La division historique en tribus s'est quant à elle révélée inexacte : les Ovibovini sont polyphylétiques, avec d'une part le bœuf musqué (Ovibos) allié aux saros (Capricornis) et aux gorals (Naemorhedus), impliquant la paraphylie des Rupicaprini, et d'autre part, le takin (Budorcas) allié aux ovins (Ovis), ce qui signifie également la paraphylie des Caprini sensu stricto[réf 5]. Le groupe frère des caprins est un clade réunissant les Hippotragini et les Alcelaphini, deux tribus de grandes antilopes africaines, et partagent donc un ancêtre commun qui pourrait être proche des fossiles Protoryx et Pachytragus, dont la classification faisait précédemment débat[45]. Cet ensemble est à son tour allié à la tribu des Reduncini, laquelle inclut le genre monotypique Pelea, qu'on pensait isolé au point de le placer dans sa propre sous-famille (Peleinae)[41].
La plupart de ces découvertes ont été intégrées à la révision taxinomique des Ongulés effectuée en 2011 par Colin Groves et Peter Grubb[46] et, bien que des controverses demeurent quant à la résolution des liens phylogénétiques entre certains groupes, la classification des Bovidés en deux sous-familles et douze tribus consolidée par ces auteurs est désormais suivie par la majorité des chercheurs et des ouvrages spécialisés[47],[48],[49],[50].
Liste des sous-familles et tribus
Selon la Mammal Diversity Database (28 avril 2022)[51], d'après Groves et Grubb 2011 :
- Antilopinae Gray, 1821 (sensu lato)
- Neotragini
- Aepycerotini
- Oreotragini
- Cephalophini
- Antilopini
- Reduncini
- Alcelaphini
- Hippotragini
- Caprini
- Bovinae Gray, 1821
- Boselaphini
- Tragelaphini
- Bovini
Selon l'ITIS (28 avril 2022)[52], d'après Mammal Species of the World (version 3, 2005) (28 avril 2022)[53] :
- Aepycerotinae Gray, 1872
- Alcelaphinae Brooke, 1876
- Antilopinae Gray, 1821 (sensu stricto)
- Bovinae Gray, 1821
- Caprinae Gray, 1821
- Cephalophinae Blyth, 1863
- Hippotraginae Sundevall, 1845
- Reduncinae Knottnerus-Meyer, 1907
Tableau synoptique
| Linné 1758 | Gray 1821 | Gray 1852 | Gray 1872 | Simpson 1945 | Grubb 2005 | Groves et Grubb 2011 | Genres (nombre d'espèces)[50] | |||
|---|---|---|---|---|---|---|---|---|---|---|
| Antilopidae (partie de) | Strepsicereae | Strepsicerotidae | Bovinae | Strepsicerotini | Bovinae | Tragelaphini | Bovinae | Tragelaphini | Tragelaphus (10) | |
| Boselaphini | Boselaphini | Boselaphini |
| |||||||
| Bos | Bovidae | Boveae | Bovidae | Bovini | Bovini | Bovini |
| |||
| Ovibovidae | Caprinae | Ovibovini | Caprinae | Ovibovini | Antilopinae (l. s.) | Caprini |
| |||
| Ovis | Capridae | Oveae | Ovidae | Caprini | Caprini |
| ||||
| Capra | Capreae | Capridae |
| |||||||
| Antilopidae (partie de) | Antilopeae | Antilopidae (partie de) | Rupicaprini |
| ||||||
| Naemorhedini |
| |||||||||
| Pantholopidae | Saigini | Pantholopini | Pantholops (1) | |||||||
| Saigadae | Antilopinae | Antilopini | Antilopini | Saiga (1) | ||||||
| Antilopidae (partie de) | Antilopinae | Antilopini (partie de) |
| |||||||
| Neotragini | Neotragini |
| ||||||||
| Nesotragidae | Neotragini |
| ||||||||
| Heleotragidae | Oreotragini | Oreotragus (1) | ||||||||
| Aepycerotidae | Antilopini (partie de) | Aepycerotinae | Aepycerotini | Aepyceros (1) | ||||||
| Cephalophidae | Cephalophinae | Cephalophini | Cephalophinae | Cephalophini |
| |||||
| Antilopidae (partie de) | Hippotraginae | Hippotragini | Hippotraginae | Hippotragini |
| |||||
| Heleotragidae | Reduncini | Reduncinae | Reduncini |
| ||||||
| Peleadae | Pelea (1) | |||||||||
| Damalidae | Alcelaphini | Alcelaphinae | Alcelaphini |
| ||||||
| Connochetidae | Connochaetes (2) | |||||||||
Phylogénie au sein de l'ordre
Phylogénie des familles des Cétartiodactyles actuels (Cétacés non développés)[54] - [55] - [56] :
| Cetartiodactyla |
| |||||||||||||||||||||||||||||||||
Concept d'espèce
Liste des genres
Selon l'IRMNG (28 avril 2022)[57] (les genres fossiles sont signalés par une obèle †) :
- Addax Laurillard, 1841
- Adjiderebos Dubrovo & Burchak-Abramovich, 1984 †
- Aepyceros Sundevall, 1847
- Alcelaphus de Blainville, 1816
- Alephis Gromolard, 1980 †
- Ammodorcas Thomas, 1891
- Ammotragus Blyth, 1840
- Antidorcas Sundevall, 1847
- Antilope Pallas, 1766
- Antilospira Teilhard de Chardin & Young, 1931 †
- Arabitragus Ropiquet & Hassanin, 2017
- Aragoral Alcala & Morales, 1997 †
- Asoletragus Palombo, Valli, Arca & Tuveri, 2006 †
- Awashia Vrba, 1997 †
- Beatragus Heller, 1912
- Benicerus Heintz, 1973 †
- Bison Smith, 1827
- Bootherium Leidy, 1852 †
- Bos Linnaeus, 1758
- Boselaphus de Blainville, 1816
- Bouria Vrba, 1997 †
- Brabovus Gentry, 1987 †
- Bubalus Smith, 1827
- Bucapra Rütimeyer, 1877 †
- Budorcas Hodgson, 1850
- Cambayella Pilgrim, 1939 †
- Capra Linnaeus, 1758
- Capraoryx Alekseeva, 1977 †
- Capricornis Ogilby, 1837
- Caprotragoides Thenius, 1979 †
- Cephalophus Smith, 1827
- Connochaetes Lichtenstein, 1814
- Criotherium Major in Lydekker, 1890 †
- Damalacra Gentry, 1980 †
- Damalavus Arambourg, 1959 †
- Damalborea Gentry, 2010 †
- Damaliscus Sclater & Thomas, 1894
- Damalops Pilgrim, 1939 †
- Demecquenemia Kostopoulos & Bernor, 2011 †
- Dorcadoryx Teilhard de Chardin & Trassaert, 1938 †
- Dorcadoxa Pilgrim, 1939 †
- Dorcatragus Noack, 1894
- Duboisia Stremme, 1911 †
- Dytikodorcas Bouvrain & de Bonis, 2007 †
- Ebusia Moyà-Solà, Quintana Cardona & Köhler, 2021 †
- Elachistoceras Thomas, 1977 †
- Eosyncerus Vekua, 1972 †
- Eotragus Pilgrim, 1939 †
- Epileptobos Hooijer, 1956 †
- Etruria Abbazzi, Delfino, Gallai, Trebini & Rook, 2008 †
- Euceratherium Furlong & Sinclair, 1904 †
- Eudorcas Fitzinger, 1869
- Euthyceros Athanassiou, 2002 †
- Fenhoryx Pei, 1958 †
- Gallogoral Guérin, 1965 †
- Gangicobus Pilgrim, 1939 †
- Gangraia Kostopoulos, Sevim Erol, Yavuz & Mayda, 2021 †
- Gazella de Blainville, 1816
- Gazellospira Pilgrim & Schaub, 1938 †
- Gentrytragus Azanza & Morales, 1994 †
- Gona Deraniyagala, 1958 †
- Graecoryx Pilgrim & Hopwood, 1928 †
- Hanhaicerus Huang, 1985 †
- Helladorcas Bouvrain, 1997 †
- Hemibos Rütimeyer, 1865 †
- Hemitragus Hodgson, 1841
- Hesperoceras Villalta & Crusafont Pairó, 1956 †
- Hezhengia Qiu, Wang & Xie, 2000 †
- Hippotragus Sundevall, 1845
- Hispanodorcas Thomas, Morales & Heintz, 1982 †
- Homoiodorcas Thomas, 1981 †
- Huabeitragus Chen & Zhang, 2007 †
- Hydaspicobus Pilgrim, 1939 †
- Hypsodontus Sokolov, 1949 †
- Insulotragus Bover & Alcover, 2005 †
- Ioribos Vekua, 1968 †
- Jamous Geraads, Blondel, Mackaye, Likius, Vignaud & Brunet, 2009 †
- Kabulicornis Heintz & Thomas, 1981 †
- Kipsigicerus Thomas, 1984 †
- Kobikeryx Pilgrim, 1939 †
- Kobus Smith, 1840
- Koufotragus de Bonis & Bouvrain, 1996 †
- Kubanotragus Gabuniya, 1973 †
- Lantiantragus Chen & Zhang, 2004 †
- Leptobos Rütimeyer, 1877 †
- Linxiatragus Wang et al., 2022 †
- Litocranius Kohl, 1886
- Lyrocerus Teilhard de Chardin & Trassaert, 1938 †
- Macrotragus Chen & Zhang, 2007 †
- Madoqua Ogilby, 1837
- Majoreas Kostopoulos, 2004 †
- Makapania Wells & Cooke, 1957 †
- Maremmia Hürzeler, 1983 †
- Megalotragus van Hoepen, 1932 †
- Megalovis Schaub, 1924 †
- Megapecoripeda Kordos, 1985 †
- Menelikia Arambourg, 1941 †
- Mesembriacerus Bouvrain, 1975 †
- Mesembriportax Gentry, 1974 †
- Miotragocerus Stromer, 1928 †
- Myotragus Bate, 1909
- Naemorhedus Smith, 1827
- Namacerus Morales, Soria, Pickford & Nieto, 2003 †
- Namibiomeryx Morales, Soria & Pickford, 1995 †
- Nanger Lataste, 1885
- Neotragocerus Matthew & Cook, 1909 †
- Neotragus Smith, 1827
- Nesogoral Gliozzi & Malatesta, 1981 †
- Nilgiritragus Ropiquet & Hassanin, 2017
- Nisidorcas Bouvrain, 1979 †
- Nitidarcus Vrba, 1997 †
- Norbertia Köhler, Moya-Sola & Morales, 1995 †
- Numidocapra Arambourg, 1949 †
- Oioceros Gaillard, 1902 †
- Olonbulukia Bohlin, 1937 †
- Oreamnos Rafinesque, 1817
- Oreonagor Pomel, 1895 †
- Oreotragus Smith, 1834
- Oryx Blainville, 1816
- Ourebia Laurillard, 1841
- Ouzocerus Bouvrain & de Bonis, 1986 †
- Ovibos Blainville, 1816
- Ovis Linnaeus, 1758
- Pachygazella Teilhard de Chardin & Young, 1931 †
- Pachyportax Pilgrim, 1937 †
- Pachytragus Schlosser, 1904 †
- Palaeoreas Gaudry, 1861 †
- Palaeoryx Gaudry, 1861 †
- Palaeotragiscus Broom, 1934 †
- Pantholops Hodgson, 1834
- Parabos Arambourg & Piveteau, 1929 †
- Parabubalis Gromova, 1932 †
- Paraprotoryx Bohlin, 1935 †
- Parapseudotragus Sokolov, 1961 †
- Parastrepsiceros Vekua in Gabunia & Vekua, 1968 †
- Parestigorgon Dietrich, 1950 †
- Parmularius Hopwood, 1934 †
- Parurmiatherium Sickenburg, 1932 †
- Pelea Gray, 1851
- Pelorovis Reck, 1928 †
- Perimia Pilgrim, 1939 †
- Pheraios Kostopoulos & Koufos, 2006 †
- Philantomba Blyth in Cuvier, 1840
- Phronetragus Gabuniya, 1955 †
- Platybos Pilgrim, 1939 †
- Platycerabos Barbour & Schultz, 1942 †
- Pliodorcas Kretzoi, 1977 †
- Plioportax Korotkevich, 1975 †
- Pontoceros Vereshchagin, Alekseeva, David & Baigusheva, 1971 †
- Praedamalis Dietrich, 1950 †
- Praeovibos Staudinger, 1908 †
- Preptoceras Furlong, 1905 †
- Proamphibos Pilgrim, 1939 †
- Probison Sahni & Khan, 1968 †
- Proboselaphus Matsumoto, 1915 †
- Procamptoceras Schaub, 1924 †
- Procapra Hodgson, 1846
- Procobus Chomenko, 1913 †
- Prodamaliscus Schlosser, 1904 †
- Proleptobos Pilgrim, 1913 †
- Prosinotragus Bohlin, 1935 †
- Prostrepsiceros Major, 1891 †
- Protobison Burchak-Abramovich, Gadzhiev & Vekua, 1980 †
- Protoryx Major, 1891 †
- Protragelaphus Dames, 1883 †
- Protragocerus Depéret, 1887 †
- Pseudoeotragus van der Made, 1989 †
- Pseudois Hodgson, 1846
- Pseudoryx Dung, Giao, Chinh, Tuoc, Arctander & MacKinnon, 1993
- Pseudotragus Schlosser, 1904 †
- Qurliqnoria Bohlin, 1937 †
- Rabaticeras Ennouchi, 1953 †
- Raphicerus Smith, 1827
- Redunca Smith, 1827
- Rupicapra Blainville, 1816
- Rusingoryx Pickford & Thomas, 1984 †
- Ruticeros Pilgrim, 1939 †
- Saheloryx Geraads, Blondel, Likius, Mackaye, Vignaud & Brunet, 2008 †
- Saiga Gray, 1843
- Samodorcas Bouvrain & de Bonis, 1985 †
- Samokeros Solounias, 1981 †
- Samotragus Sickenberg, 1936 †
- Selenoportax Pilgrim, 1937 †
- Shaanxispira Liu, Li & Zhai, 1978 †
- Simatherium Dietrich, 1941 †
- Sinapocerus Tekkaya, 1974 †
- Sinapodorcas Bouvrain, Sen & Thomas, 1994 †
- Sinocapra Chen, 1991 †
- Sinomioceros Chen, 1988 †
- Sinopalaeoceros Chen, 1988 †
- Sinoreas Teilhard de Chardin & Trassaert, 1938 †
- Sinotragus Bohlin, 1935 †
- Sivacapra Pilgrim, 1939 †
- Sivacobus Pilgrim, 1939 †
- Sivadenota Pilgrim, 1939 †
- Sivaportax Pilgrim, 1939 †
- Sivoreas Pilgrim, 1939 †
- Skoufotragus Kostopoulos, 2009 †
- Skouraia Geraads, El Boughabi & Zouhri, 2012 †
- Soergelia Schaub, 1952 †
- Spirocerus Boule & Chardin, 1928 †
- Sporadotragus Kretzoi, 1968 †
- Strogulognathus Filhol, 1890 †
- Sylvicapra Ogilby, 1837
- Syncerus Hodgson, 1847
- Taurotragus Wagner, 1855
- Tchadotragus Geraads, Blondel, Likius, Mackaye, Vignaud & Brunet, 2008 †
- Tchaltacerus Bouvrain, 1998 †
- Tethytragus Azanza & Morales, 1994 †
- Tetracerus Leach, 1825
- Thaleroceros Reck, 1937 †
- Torticornis Dmitrieva, 1977 †
- Tossunnoria Bohlin, 1937 †
- Tragelaphus Blainville, 1816
- Tragoportax Pilgrim, 1937 †
- Tragoreas Schlosser, 1908 †
- Tragospira Kretzoi, 1954 †
- Turcocerus Köhler, 1988 †
- Turritragus Abbazzi, Delfino, Gallai, Trebini & Rook, 2008 †
- Tyrrhenotragus Hürzeler & Engesser, 1976 †
- Udabnocerus Burchak-Abramovich & Gabashvili, 1968 †
- Ugandax Cooke & Coryndon, 1970 †
- Urmiabos Burtchak-Abramovitch, 1950 †
- Urmiatherium Rodler, 1888 †
- Vishnucobus Pilgrim, 1939 †
- Vishnumeryx Pilgrim, 1939 †
- Wellsiana Vrba, 1987 †
- Yakopsis Kretzoi, 1954 †
- Zephyreduncinus Vrba & Haile-Selassie, 2006 †
Histoire évolutive
.jpg.webp)
L'évolution des Bovidés est caractérisée par des radiations adaptatives, des migrations sur de grandes distances et des extinctions massives. Le registre fossile est particulièrement riche, ayant révélé plus de 300 espèces éteintes ou ancêtres d'espèces modernes, mais l'état des connaissances sur les premiers bovidés reste singulièrement limité[58]. Eotragus noyei, découvert au Pakistan et daté de 18,3 Ma, ressemblait à une gazelle avec des cornes simples et droites[59]. Il est généralement considéré comme le plus ancien vrai bovidé connu, même si la famille aurait divergé beaucoup plus tôt des cervidés et des giraffidés. Cette séparation, survenue en Eurasie à la limite entre l'Oligocène et le Miocène (vers 23 Ma), s'est produite grâce au développement d'un système digestif ruminant plus avancé permettant aux espèces d'exploiter des bases végétales différentes. Les cervidés ont ainsi évolué à partir du Miocène inférieur, s'installant dans les régions fraîches des latitudes plus élevées, alors que les Bovidés se sont mieux adaptés aux températures chaudes, ce qui a facilité leur migration ultérieure vers le continent africain lorsque le climat mondial s'est réchauffé. Vivant dans les savanes boisées, ils étaient modérément diversifiés, avec seulement quelques genres[58].
La séparation entre les Antilopinae et les Bovinae semble s'être produite au Miocène inférieur et les fossiles Pseudoeotragus seegrabensis (it) (Autriche, 17-18 Ma) et Eotragus sansaniensis (France, 15,2 Ma) ont été proposés comme les premiers représentants respectifs des deux sous-familles[60]. La divergence semble en toute évidence avoir été la conséquence d'une longue séparation continentale, les Antilopinae s'étant initialement développés en Afrique, alors que les Bovinae sont restés en Eurasie. Une radiation explosive s'est ensuite produite simultanément dans les deux sous-familles, donnant naissance à la majorité des tribus actuelles[61]. Ce phénomène coïncide avec l'optimum climatique du Miocène moyen survenu entre 17 et 15 Ma, qui a été le dernier d'une série d'événements de réchauffement global qui ont ponctué le Cénozoïque. Les conditions plus chaudes et plus humides qui ont alors prévalu ont favorisé l'expansion de forêts sempervirentes en Europe centrale et du Sud, en Afrique du Nord, dans le Nord-Ouest de l'Inde et en Asie, où elles se sont étendues vers le nord jusqu'en Corée et au Japon. Cette période a été directement suivie d'un refroidissement global drastique, de 15 à 13 Ma[62].
Évolution des Bovinae

La tribu des Bovini étant particulièrement diversifiée en Asie du Sud-Est, il est vraisemblable qu'elle en soit originaire. Elle se serait rapidement séparée en trois lignées (Bovina, Bubalina et Pseudorygina) au Miocène supérieur, avant de se disperser en Afrique d'abord, puis en Europe[62]. Le plus ancien fossile connu est Seleportax de la chaîne des Siwaliks, dans le Nord de l'Inde, vers 9 Ma[60]. Les connexions fauniques entre l'Asie du Sud et l'Afrique étaient assez fortes au Miocène, puis se sont progressivement affaiblies au fil du temps. La rupture du flux génétique entre les buffles d'Asie (Bubalus) et d'Afrique (Syncerus) vers 7 Ma est corroborée par les preuves de l'évolution des premiers à partir de Proamphibos et Hemibos en Asie du Sud, et des seconds à partir d'Ugandax en Afrique. Cette divergence profonde pourrait refléter le renforcement des barrières de dispersion entre des zones fauniques afrotropicales et indomalaises auparavant relativement perméables[63]. Les origines des bœufs et des bisons (genre Bos), ainsi que leurs relations avec les nombreuses espèces fossiles qui semblent leur correspondre restent problématiques[64]. Un lien a été proposé avec les formes africaines du Pliocène supérieur et du Pléistocène inférieur du genre Pelorovis, mais cette hypothèse nécessite des preuves supplémentaires[réf 6].
Bien qu'elle ne compte plus aujourd'hui que deux genres monotypiques répartis sur le sous-continent indien, la tribu des Boselaphini regroupe un grand nombre de fossiles couvrant une aire de distribution bien plus large. Les deux genres dominants sont Miotragocerus (en) et Tragoportax (en), dont les espèces s'étendent sur tout le Miocène supérieur en Eurasie, de la Chine à l'Espagne, dans les Siwaliks et jusqu'à l'extrême sud de l'Afrique. Il est cependant probable que l'attribution aux Boselaphini est inexacte, et certains auteurs proposent de rassembler ces fossiles dans leur propre tribu, les Tragoportacini[64].
L'histoire évolutive des Tragelaphini (antilopes à cornes spiralées) est entièrement africaine depuis le Miocène supérieur. Le plus ancien représentant du groupe actuel est connu de la formation de Lukeino (Kenya) et daté de 6,56-5,72 Ma[64]. La question de savoir si la tribu a migré vers l'Afrique depuis l'Eurasie ou si elle s'est séparée d'un précurseur africain n'est cependant pas résolue. Un fossile découvert en Grèce, Pheraios, présente une relation phylogénétique étroite avec le clade africain et pourrait indiquer une ascendance commune eurasienne[réf 7].
Évolution des Antilopinae
Le dernier ancêtre commun des Antilopinae était probablement d'origine africaine, descendant d'une branche de bovidés venue d'Eurasie au Miocène inférieur. En Afrique, l'optimum climatique du Miocène moyen a entraîné des bouleversements de la végétation, avec une expansion des habitats ouverts et une aridification accrue à l'est et au sud-ouest. Ces changements rapides ont créé une mosaïque d'écosystèmes qui a pu favoriser l'émergence de tribus aux préférences écologiques différentes, comme les Antilopini dans les habitats ouverts, ou les Cephalophini et les Neotragini dans les habitats forestiers[62].
Les Reduncini on divergé à cette époque, et bien qu'ils soient aujourd'hui limités à l'Afrique subsaharienne, des fossiles ont été enregistrés en Afrique du Nord, au Levant et dans le sous-continent indien, particulièrement dans la chaîne des Siwaliks. L'espèce Kobus porrecticornis a ainsi été décrite dans des dépôts de ces montagnes datés entre 9,3 et 8,0 Ma, puis dans des sites en Éthiopie, au Kenya et en Afrique du Sud, datés entre 6,5 et 5,0 Ma. Bien que située sur la route entre le sous-continent indien et l'Afrique de l'Est, la péninsule arabique ne compte aucun Reduncini fossile. En supposant qu'elles avaient les mêmes préférences écologiques que leurs homologues modernes, ces antilopes auraient eu besoin de zones humides et d'habitats inondés en permanence, et n'auraient réussi qu'à traverser la péninsule par intermittence, sans y persister à long terme. Le Nil constitue un analogue moderne de cette hypothèse : il abrite plusieurs espèces de Reduncini le long de son cours supérieur en Ouganda et au Soudan, mais aucune lorsqu'il traverse le Sahara égyptien[65].
Même si leur origine demeure obscure, les Aepycerotini (impalas) se distinguent des bovidés africains par leur succès évolutif à long terme : leur flexibilité écologique leur a en effet permis de persister avec relativement peu de changements morphologiques au cours des 7 derniers millions d'années[réf 8].
Les Hippotragini, les Alcelaphini et les Caprini forment ensemble un clade monophylétique dont l'ancêtre commun est apparu vers 13,4 Ma. Il est connecté avec trois genres fossiles, chacun originaire d'un continent différent : Caprotragoides en Asie (Inde et Pakistan), Tethytragus en Europe (Espagne et Turquie) et Gentrytragus en Afrique (Kenya et Arabie saoudite). Deux scénarios biogéographiques différents sont ainsi avancés : soit l'ancêtre commun aux trois tribus s'est dispersé hors d'Afrique pendant le Miocène moyen, soit l'événement de dispersion s'est produit plus tard, au Miocène supérieur, avec les ancêtres des caprins. Selon cette seconde hypothèse, ces derniers auraient acquis leur adaptation à l'escalade pendant leur isolement insulaire dans l’archipel montagneux séparant la Méditerranée et la Paratéthys. Les caprins auraient ensuite pu envahir l'Afrique, l'Europe et l'Asie, probablement juste après la crise de salinité du Tortonien, entre 7,8 et 7,6 Ma, ou après celle du Messinien, entre 6,0 et 5,3 Ma, qui ont provoqué de fortes baisses du niveau des eaux méditerranéennes et permis d'intenses migrations faunistiques. Ces dispersions pourraient expliquer la grande distribution des caprins au cours du Pliocène et du Pléistocène, ainsi que leur intense diversification dans les régions montagneuses d'Asie[réf 5]. Les Alcelaphini et les Hippotragini ont en revanche été limités pendant toute leur histoire à l'Afrique et à l'Arabie, à l'exception de dispersions de courte durée vers le sous-continent indien entre 3,0 et 2,5 Ma[66].
L'histoire évolutive des Antilopini est quant à elle marquée par trois phases de diversification rapide au cours du Néogène tardif. La première a commencé à la limite entre le Miocène moyen et le Miocène supérieur (12-11 Ma) et donné naissance à quatre lignées, dont une sous-tribu asiatique (Procaprina) et trois sous-tribus africaines (Antilopina, Raphicerina et Ourebina). Cette période coïncide avec la divergence entre les trois tribus Alcelaphini, Caprini et Hippotragini. Toutes les espèces de bovidés adaptées aux environnements désertiques proviennent des tribus Antilopini (par exemple, la Gazelle leptocère), Caprini (par exemple, le Mouflon à manchettes) et Hippotragini (par exemple, l'Addax), et leur diversification a donc été favorisée par le développement d'habitats plus ouverts à la fin du Néogène. Les plantes fossiles indiquent en effet que les premières prairies et savanes sont apparues en Afrique de l'Est au milieu du Miocène et, au Tortonien, les arbustes xérophiles tropicaux étaient le biome dominant en Afrique du Nord, en Afrique de l'Est et dans la péninsule arabique. La deuxième radiation des Antilopini s'est produite entre 8,5 et 8 Ma, lorsque la sous-tribu Antilopina s'est diversifiée en trois lignées, correspondant au genre asiatique Saiga, aux gazelles vraies, et à un clade africain contenant Antidorcas, Litocranius et Ammodorcas. Cette époque peut être liée à l'expansion mondiale des formations herbeuses en C4 entre 8,5 et 6,5 Ma, qui a favorisé la diversification de la plupart des tribus de bovidés au cours du Miocène supérieur. La troisième radiation a eu lieu au début du Pliocène (4,5-4,2 Ma), lorsque les quatre genres de gazelles vraies (Gazella, Eudorcas, Nanger et le genre indien Antilope) ont divergé les uns des autres. Pendant cette période, l'Afrique du Nord et l'Afrique de l'Est semblent avoir connu un climat plus sec qui a conduit à des conditions plus proches de celles observées aujourd'hui. Le fait qu'une lignée asiatique ait émergé de chacune des trois radiations successives d'Antilopini implique que toutes ces phases de diversification ont probablement été accompagnées d'une migration faunique de l'Afrique vers l'Eurasie[67].
Relations avec l'Homme
Chasse
Domestication
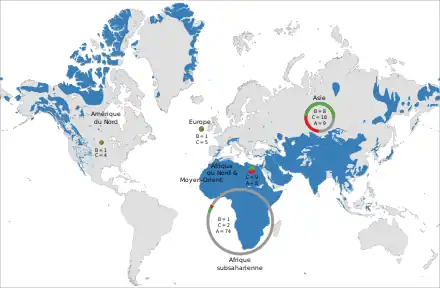
La domestication est un processus évolutif par lequel des organismes sont sélectionnés artificiellement et subissent d'importantes modifications phénotypiques comportementales et physiologiques. La domestication des animaux a modifié la biosphère, façonné l'évolution humaine et influencé la taille de la population humaine. Il existe une quarantaine environ d'espèces animales domestiquées par l'Homme à différentes époques et dans différentes zones géographiques[réf 9]. Parmi celles-ci, dix-neuf espèces de mammifères sont considérées comme ayant suffisamment divergé de leurs ancêtres sauvages pour être reconnues comme des taxons distincts. Les Bovidés regroupent huit de ces espèces, ce qui en fait la famille ayant produit le plus grand nombre de mammifères domestiques, loin devant les camélidés (chameau, dromadaire, lama et alpaga), les équidés (cheval et âne), les suidés (porc), ou les familles de carnivores (chien, chat, furet) et de rongeurs (cochon d'Inde)[réf 10],[50].
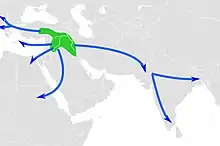
À l'exception du chien, qui aurait été domestiqué par les chasseurs-cueilleurs eurasiatiques durant la dernière période glaciaire, les premières domestications détectées sont originaires du Proche-Orient. Elles concernent les moutons, les chèvres et les taurins, ainsi que les porcs et les chats, et datent approximativement du milieu du 11e millénaire AP. Cela coïncide avec le commencement du Néolithique précéramique B, une époque caractérisée par les débuts de la culture de céréales et de légumineuses domestiques et par une nouvelle technique de production d'armes de chasse en silex. Les chèvres sont à nouveau domestiquées plusieurs siècles plus tard dans les monts Zagros à partir de lignées locales distinctes. La domestication des bovins connaît également une seconde vague aux alentours de 8 500 AP dans la basse vallée de l'Indus, qui a donné naissance aux zébus. L'existence d'un troisième berceau indépendant de domestication du bétail dans la haute vallée du Nil fait en revanche l'objet de débats. Ces épisodes précèdent dans tous les cas la domestication du lama et de l'alpaga au Pérou (7e millénaire AP) et celle du cheval, de l'âne, du chameau et du dromadaire dans l'Ancien Monde (entre le 6e et le 4e millénaire AP)[réf 11].
La domestication animale s'est vraisemblablement produite selon trois modes :
- l'approche commensale pour les espèces attirées par les établissements humains, qui étaient ensuite capturées et élevées ;
- la voie de la proie pour les animaux à viande, initialement utilisés comme source de nourriture ;
- la voie dirigée, un processus délibéré pour les espèces capables d'accomplir des tâches spécifiques, comme les animaux de trait.
Tous les bovidés domestiqués l'auraient été par la voie de la proie : ces espèces étaient probablement chassées en premier lieu, puis, avec la sédentarisation des populations humaines liée au développement de l'agriculture, des stratégies pour maximiser la disponibilité des proies auraient été nécessaires pour atténuer les effets de la chasse excessive. Ce faisant, la pression de sélection pour des traits tels que la docilité a dû être significative à mesure que l'homme passait de la gestion du gibier à la gestion des troupeaux[réf 12].
Bovins domestiques
Six espèces bovines ont été domestiquées, dont quatre sont maintenues dans de grandes populations et ont fait l'objet d'une forte sélection dirigée par l'Homme. Au XXIe siècle, environ 750 millions de taurins (Bos taurus) sont élevés dans le monde. Ils ont été introduits partout sauf dans les déserts et les régions polaires, aux altitudes inférieures à 1 500 m. Environ le même nombre de zébus (Bos indicus) vit dans les régions tropicales, principalement en Inde, en Asie du Sud-Est, le Sud de la Chine, en Afrique de l'Est, au Brésil, aux États-Unis et en Australie. Les deux espèces descendent de l'aurochs (Bos primigenius), dont le dernier représentant européen s'est éteint en 1627, alors que la sous-espèce ayant mené au zébu aurait disparu en Inde environ 2 000 ans avant l'ère commune [68]. La domestication a été suivie par des migrations majeures (voir tableau), qui ont atteint tous les continents habités, créant une immense diversité de races et d'adaptations à des environnements variés, souvent extrêmes.
| Époque | Taurins (Bos taurus) | Zébus (Bos indicus) |
|---|---|---|
| 6 000 – 4 000 AEC | Colonisation de l'Europe néolithique et introduction du bétail depuis le Croissant fertile. Hybridation partielle avec l'aurochs local. | |
| Après 4 800 AEC | Migration en Afrique. Hybridation partielle avec l'aurochs local. | |
| Après 3 200 AEC | Migration de la vallée de l'Indus vers le Croissant fertile à la faveur d'un changement climatique. Remplacement du bétail local. | |
| 3 000 – 2 000 AEC | Migration vers l'Asie de l'Est et la Sibérie. | |
| Après 2 000 AEC | Migration en Afrique et hybridation partielle avec les populations taurines. Phénomène stimulé ensuite par la conquête arabe du VIIe siècle EC. | |
| Après 1 000 AEC | Migration en Chine et en Indochine et hybridation partielle avec les populations taurines. | |
| Après 500 EC | Migration en Indonésie et hybridation partielle avec les bantengs. | |
| Après 1492 EC | Introduction en Amérique du Nord et du Sud depuis l'Europe et l'Afrique. | Introduction depuis l'Inde au Brésil, puis de là aux États-Unis. |
| XIXe et XXe siècles EC | Production et diffusion globale de races cosmopolites depuis l'Europe : holstein, jersiaise (laitières), hereford, angus, charolaise, limousine (bouchères). | Diffusion depuis les États-Unis de la race brahmane, devenue dominante en Australie. |
Les buffles domestiques (Bubalus bubalis) sont quant à eux issus du buffle d'eau sauvage (Bubalus arnee) et auraient été domestiqués dans la vallée de l'Indus vers le 5e millénaire AP. Deux types sont distingués : les buffles des rivières sont élevés à basse altitude dans les régions tropicales et subtropicales, principalement pour la production laitière. Ils seraient 135 millions dans le monde, surtout en Asie (94 %), mais aussi dans les Balkans, en Italie, en Égypte et au Brésil. Les buffles des marais sont plutôt utilisés comme animaux de trait en Chine et en Asie du Sud-Est, où ils sont plus de 35 millions[70].
La plupart des quelque 14 millions de yacks domestiques (Bos grunniens) sont élevés sur le plateau tibétain. Leur ancêtre sauvage (Bos mutus) conserve une population d'environ 15 000 individus dans la partie nord-ouest de leur aire de répartition. La domestication de l'espèce est considérée comme ayant été essentielle pour l'habitation humaine du plateau. L'existence de yacks domestiques est documentée à partir 4 500 AP, et même si les données issues du séquençage du génome montrent une première expansion vers 7 300 AP, aucune preuve fossile d'une domestication antérieure n'existe. Ces mêmes données indiquent également une augmentation de la population de yacks d'un facteur 6 aux alentours de 3 600 AP. Ce phénomène coïncide avec l'introduction de l'orge sur le plateau, qui aurait permis l'accroissement des populations humaines, augmentant par là les besoins en protéines, en peaux, en énergie et en moyens de transport, lesquels pouvaient tous être fournis par les yacks[71].
- Les six espèces de bovins domestiques
 Vaches (Bos taurus) dans le Caucase russe.
Vaches (Bos taurus) dans le Caucase russe..jpg.webp) Zébus (Bos indicus) dans la vallée de l'Omo en Éthiopie.
Zébus (Bos indicus) dans la vallée de l'Omo en Éthiopie. Buffles (Bubalus bubalis) dans une rizière indonésienne.
Buffles (Bubalus bubalis) dans une rizière indonésienne. Yack (Bos grunniens) au bord du Yamdrok-Tso, au Tibet.
Yack (Bos grunniens) au bord du Yamdrok-Tso, au Tibet. Bantengs domestiques (Bos domesticus) nourris à Bali.
Bantengs domestiques (Bos domesticus) nourris à Bali. Gayals (Bos frontalis) dans l'Arunachal Pradesh, en Inde.
Gayals (Bos frontalis) dans l'Arunachal Pradesh, en Inde.
En comparaison, les bœufs de Bali (Bos domesticus) et les gayals (Bos frontalis) ont des aires de répartition restreintes en Asie du Sud et du Sud-Est, proches des aires d'origine de leurs ancêtres sauvages. Bien que tous deux soient adaptés à l'environnement humain, ils n'ont pas fait l'objet d'une sélection intense. Une population de plus de 2 millions de bœufs de Bali est élevée comme bétail de trait et de boucherie à Bali, sur d'autres îles de l'Est de l'Indonésie et ailleurs dans des troupeaux isolés. Ils ont été introduits pour l'agriculture sur la péninsule de Cobourg dans le Nord de l'Australie et, après avoir été abandonnés, ont établi une grande population férale. Les bœufs de Bali ressemblent encore fortement aux bantengs sauvages (Bos javanicus), lesquels sont fortement menacés d'extinction. Il y a quelque 300 000 gayals semi-sauvages dans l'Est de l'Inde, au Bangladesh, en Birmanie et dans le sud de la Chine. Ils ne sont pas détenus dans un environnement d'élevage et sont seulement utilisés pour l'abattage rituel (en). Le gayal est souvent considéré comme la forme domestique du gaur (Bos gaurus), bien qu'ils aient des cornes clairement distinctes. Les deux espèces ont aussi des caryotypes différents et il a été proposé que le gayal descende d'une autre espèce ou sous-espèce différente. La divergence pourrait également avoir été accrue par hybridation du gayal avec le zébu, à partir de populations du Yunnan[70].
Chèvres et moutons
Exploitation et production
Alors qu'ils avaient été domestiqués initialement comme sources de viande, les bovidés ont subi une diversification ultérieure pour des utilisations supplémentaires, comme la production de fibres textiles et de produits laitiers, ou la traction et le bât. Chacune de ces adaptations s'est produite dans le cadre de processus post-domestication souvent associés à la spécialisation économique dans le contexte de sociétés complexes émergentes. Cette phase critique de changements au IVe millénaire av. J.-C. a été documentée sous le nom de « révolution des produits secondaires »[réf 13].
| Viande | Peaux | Lait | Laine | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Bœufs | 293 196 735 têtes | 67 883 097 t | 20 % | 8 518 810 t | 68 % | 268 111 524 têtes | 718 038 443 t | 81 % | N/A | 0 % |
| Buffles | 27 483 633 têtes | 4 187 212 t | 1 % | 809 317 t | 6 % | 70 198 944 têtes | 134 425 197 t | 15 % | N/A | 0 % |
| Moutons | 590 507 650 têtes | 9 885 475 t | 3 % | 1 919 556 t | 15 % | 257 237 831 têtes | 10 618 551 t | 1 % | 1 784 925 t | 100 % |
| Chèvres | 495 108 884 têtes | 6 142 140 t | 3 % | 1 232 880 t | 10 % | 220 921 370 têtes | 20 629 610 t | 2 % | N/A | 0 % |
| Non-bovidés | N/A | 249 063 902 t | 74 % | négligeable | 0 % | N/A | 3 149 997 t | 0 % | négligeable | 0 % |
Produits primaires

Les produits primaires, également appelés produits d'abattage, sont par définition ceux qui ne peuvent être extraits de l'animal qu'une seule fois au cours de sa vie. Ils comprennent bien entendu la viande (de bœuf, de veau, de mouton, d'agneau, de chèvre), découpée à partir de la carcasse, laquelle représente rarement plus de la moitié du poids de l'animal vivant. Ils incluent également les coproduits et sous-produits de l'équarrissage, dont beaucoup ont une importance économique non négligeable.
Les peaux, qui représentent entre 4 et 11 % du poids de l'animal vivant, sont considérées comme les coproduits les plus précieux provenant des animaux de boucherie. Elles sont utilisées depuis la Préhistoire pour fabriquer des vêtements, des abris et des récipients. Pour éviter la décomposition bactérienne ou enzymatique, on utilise du sel pour le séchage, puis les peaux sont tannées pour former le cuir. Le collagène est utilisé pour produire des boyaux synthétiques pour les saucisses, plus stables à la conservation que les boyaux naturels. Les poils du corps et des oreilles des bovins servent à la fabrication de filtres à air, de pinceaux d'artistes, de tapis, de rembourrage pour les meubles, de feutre, ainsi que dans l'industrie textile[réf 15].
Les os sont historiquement broyés en farine, notamment utilisée comme fertilisant et pour l'alimentation du bétail. Ils servent aussi, comme les peaux, à produire la gélatine, dont les usages sont multiples : préparation de gelées culinaires, stabilisation des desserts surgelés et de la crème glacée, colloïde protecteur pour les tartes à la crème ou les yaourts, fabrication de capsules et agent liant pour les comprimés médicamenteux, ingrédient des produits cosmétiques et des réactifs de sérigraphie, etc.[réf 15].

Le sang de bovidés est parfois utilisé en alimentation pour la confection du boudin noir. Industriellement, il est utilisé dans les adhésifs, les insecticides, les fongicides et les cosmétiques, dans la fabrication du papier, du contreplaqué, de certaines matières plastiques et de colle, ainsi que comme agent moussant dans les extincteurs[réf 15].
Les viscères, c'est-à-dire les organes et les glandes des animaux, forment les abats, dont l'utilisation en alimentation humaine dépend beaucoup des traditions, de la culture et de la religion. Le foie est le plus largement consommé, entier ou transformé en pâté. On préfère généralement ceux de jeunes bovidés (agneau, veau), car ils ont une saveur douce et une texture plus fine. Le cœur est vendu comme viande de table ou dans les produits de viande hachée. La langue et la queue de bœuf, ainsi que le ris de veau (thymus) sont vendus en tant que produits frais. Les deux premiers compartiments de l'estomac ruminant (voir supra) sont consommés après lavage et blanchiment sous le nom de tripes. Les intestins sont nettoyés et emballés dans une saumure pour fabriquer les boyaux des saucisses, dont la taille et la forme déterminent souvent l'appellation. Les pis de bovins sont parfois coupés en tranches, lavés de leur lait et cuits par friture ou ébullition. Les rates sont hachées et utilisées comme aromates. Enfin, la cervelle, la moelle épinière ou les poumons restent consommés traditionnellement, même s'ils sont souvent considérés comme non comestibles pour des raisons sanitaires, surtout depuis l'épizootie d'encéphalopathie spongiforme bovine de la fin du XXe siècle. Les hormones des glandes et des organes sont utilisées par l'industrie pharmaceutique pour la production de médicaments : adrénaline, stéroïdes, héparine, insuline, etc. Les intestins des agneaux et des veaux de moins de 9 mois servent à produire le catgut des fils résorbables des sutures chirurgicales. Les viscères entrent également, avec les os et les tendons, dans la composition de la plupart des aliments pour animaux domestiques[réf 15].
Enfin, les graisses des animaux connaissent de nombreuses utilisations. Le suif obtenu des bovins et des moutons, plus dur que le saindoux des porcs, servait de combustible dans les chandelles et reste largement utilisé pour la fabrication des savons. En alimentation, on lui préfère traditionnellement le suet obtenu de la graisse autour des reins, même s'il était largement utilisé pour la friture avant d'être remplacé par les huiles végétales. L'industrie extrait du suif l'acide oléique pour faire des lubrifiants, des textiles et des shampooings, et la glycérine pour produire des encres, des colles, des solvants et des explosifs[réf 15].
Produits secondaires
Notes et références
Notes
- ↑ Les pâtureurs variables se distinguent non seulement par un régime alimentaire comprenant moins de monocotylédones, mais aussi par une variabilité significative de leur alimentation en fonction de l'espace et des saisons.
Références à la bibliographie
- ↑ Gray 1821, p. 308.
- ↑ Grubb 2001, p. 375-376.
- 1 2 Castelló 2016, p. 8.
- ↑ Castelló 2016, p. 16.
- ↑ Estes 1991, p. 8.
- ↑ Castelló 2016, p. 10-11.
- 1 2 3 Castelló 2016, p. 11.
- ↑ Kingdon et Hoffmann 2013, p. 120.
- 1 2 Wang, Zelditch et Badgley 2021, p. 2.
- 1 2 Castelló 2016, p. 13.
- ↑ Estes 1974, p. 170.
- ↑ Estes 1991, p. 10.
- ↑ Estes 1974, p. 170-171.
- 1 2 3 4 Gagnon et Chew 2000, p. 506.
- ↑ Gagnon et Chew 2000, p. 493.
- 1 2 Wang, Zelditch et Badgley 2021, données supplémentaires.
- ↑ Wang, Zelditch et Badgley 2021, p. 4.
- 1 2 3 Kingdon et Hoffmann 2013, p. 204.
- ↑ Wang, Zelditch et Badgley 2021, p. 6.
- ↑ Gagnon et Chew 2000, p. 507.
- 1 2 3 4 Estes 1991, p. 13.
- ↑ Estes 1974, p. 166.
- 1 2 Estes 1991, p. 12.
- ↑ Lundrigan 1996, p. 462-463.
- ↑ Lundrigan 1996, p. 463.
- ↑ Estes 1991, p. 15-16.
- 1 2 Estes 1991, p. 16-17.
- 1 2 Simpson 1945, p. 270.
- ↑ Yang et al. 2013, p. 137.
- ↑ Linné 1758, p. 65-72.
- ↑ Gray 1821, p. 307-308.
- ↑ Grubb 2001, p. 375.
- ↑ Schlosser 1904.
- ↑ Thomas 1984, p. 263-234.
- ↑ Hassanin et Douzery 1999, p. 237-239.
- ↑ Gentry 1992, p. 2.
- ↑ Grubb 2005.
- ↑ Calamari 2021, p. 8.
- 1 2 Hassanin et Douzery 1999, p. 235.
- ↑ Calamari 2021, p. 18-19.
- 1 2 3 4 Yang et al. 2013, p. 141.
- ↑ Bibi et al. 2009, p. 4-5.
- ↑ Calamari 2021, p. 10.
- ↑ Hassanin et al. 2012, p. 38.
- ↑ Bibi et al. 2009, p. 5.
- ↑ Groves et Grubb 2011.
- ↑ Groves et al. 2011.
- ↑ Castelló 2016.
- ↑ Calamari 2021.
- 1 2 3 ASM 2022.
- ↑ ASM Mammal Diversity Database, consulté le 28 avril 2022
- ↑ Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 28 avril 2022
- ↑ Mammal Species of the World (version 3, 2005), consulté le 28 avril 2022
- ↑ (en) Samantha A Price, Olaf R P Bininda-Emonds et John L Gittleman, « A complete phylogeny of the whales, dolphins and even-toed hoofed mammals (Cetartiodactyla) », Biological Reviews, Wiley, vol. 80, no 3, , p. 445-73 (ISSN 1464-7931, 0006-3231 et 1469-185X, PMID 16094808, DOI 10.1017/S1464793105006743, lire en ligne
 [PDF])
[PDF]) - ↑ (en) Michelle Spaulding, Maureen A O'Leary et John Gatesy, « Relationships of Cetacea (Artiodactyla) among mammals: increased taxon sampling alters interpretations of key fossils and character evolution », PLOS One, PLoS, vol. 4, no 9, , e7062 (ISSN 1932-6203, OCLC 228234657, PMID 19774069, PMCID 2740860, DOI 10.1371/JOURNAL.PONE.0007062)
- ↑ (fr + en) Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer, Bettine Jansen van Vuuren, Conrad Matthee, Manuel Ruiz-Garcia, François Catzeflis, Veronika Areskoug, Trung Thanh Nguyen et Arnaud Couloux, « Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes », Comptes Rendus Biologies, Elsevier, vol. 335, no 1, , p. 32-50 (ISSN 1631-0691 et 1768-3238, OCLC 49200702, PMID 22226162, DOI 10.1016/J.CRVI.2011.11.002)
- ↑ Rees, T. (compiler). The Interim Register of Marine and Nonmarine Genera. Available from https://www.irmng.org at VLIZ, consulté le 28 avril 2022
- 1 2 Castelló 2016, p. 21.
- ↑ Bibi 2013, p. 8.
- 1 2 Bibi et al. 2009, p. 2.
- ↑ Hassanin et Douzery 1999, p. 241.
- 1 2 3 Hassanin et al. 2012, p. 46.
- ↑ Bibi 2013, p. 11.
- 1 2 3 Bibi et al. 2009, p. 4.
- ↑ Bibi 2011, p. 6.
- ↑ Bibi 2011, p. 7.
- ↑ Hassanin et al. 2012, p. 46-47.
- ↑ Zhang et al. 2020, p. 642.
- ↑ Zhang et al. 2020, p. 644-646.
- 1 2 Zhang et al. 2020, p. 639.
- ↑ Zhang et al. 2020, p. 646.
Autres références
- ↑ Informations lexicographiques et étymologiques de « Bovidés » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- ↑ (en) Terry A. Vaughan, James M. Ryan et Nicholas J. Czaplewski, Mammalogy, Jones & Bartlett Publishers, , 756 p. (ISBN 978-1-284-03218-5, lire en ligne), p. 327-328.
- ↑ (en) Bernhard Grzimek, Grzimek's Animal life encyclopedia, t. 13, Van Nostrand Reinhold, 565 p. (ISBN 978-0-442-23048-7), p. 294.
- ↑ (en) John Gatesy et Peter Arctander, « Hidden Morphological Support for the Phylogenetic Placement of Pseudoryx nghetinhensis with Bovine Bovids : A Combined Analysis of Gross Anatomical Evidence and DNA Sequences from Five Genes », Systematic Biology, vol. 49, no 3, , p. 515–538 (DOI 10.1080/10635159950127376).
- 1 2 (en) Anne Ropiquet et Alexandre Hassanin, « Molecular phylogeny of caprines (Bovidae, Antilopinae) : the question of their origin and diversification during the Miocene », Journal of Zoological Systematics and Evolutionary Research, vol. 43, no 1, , p. 49–60 (DOI 10.1111/j.1439-0469.2004.00290.x).
- ↑ (en) Bienvenido Martínez-Navarro, Juan Antonio Pérez-Claros, Maria Rita Palombo, Lorenzo Rook et Paul Palmqvist, « The Olduvai buffalo Pelorovis and the origin of Bos », Quaternary Research, vol. 68, no 2, , p. 220–226 (DOI 10.1016/j.yqres.2007.06.002).
- ↑ (en) Dimitris S. Kostopoulos et George D. Koufos, « Pheraios chryssomallos, gen. et sp. nov. (Mammalia, Bovidae, Tragelaphini), from the late Miocene of Thessaly (Greece) : implications for tragelaphin biogeography », Journal of Vertebrate Paleontology, vol. 26, no 2, , p. 436–445 (DOI 10.1671/0272-4634(2006)26[436:PCGESN]2.0.CO;2).
- ↑ (en) J. Tyler Faith, Christian A. Tryon, Daniel J. Peppe, Emily J. Beverly et Nick Blegen, « Biogeographic and Evolutionary Implications of an Extinct Late Pleistocene Impala from the Lake Victoria Basin, Kenya », Journal of Mammalian Evolution, vol. 21, no 2, , p. 213–222 (DOI 10.1007/s10914-013-9238-1).
- ↑ (en) Hafiz Ishfaq Ahmad, Muhammad Jamil Ahmad, Farwa Jabbir, Sunny Ahmar, Nisar Ahmad, Abdelmotaleb A. Elokil et Jinping Chen, « The Domestication Makeup : Evolution, Survival, and Challenges », Frontiers in Ecology and Evolution, vol. 8, no 103, , p. 1-17 (DOI 10.3389/fevo.2020.00103).
- ↑ (en) Anthea Gentry, Juliet Clutton-Brock et Colin P. Groves, « The naming of wild animal species and their domestic derivatives », Journal of Archaeological Science, vol. 31, no 5, , p. 645–651 (DOI 10.1016/j.jas.2003.10.006).
- ↑ (en) Jean-Denis Vigne, « The origins of animal domestication and husbandry : A major change in the history of humanity and the biosphere », Comptes Rendus Biologies, vol. 334, no 3, , p. 171–181 (DOI 10.1016/j.crvi.2010.12.009).
- ↑ (en) Greger Larson et Dorian Q. Fuller, « The Evolution of Animal Domestication », Annual Review of Ecology, Evolution, and Systematics, vol. 45, no 1, , p. 115–136 (DOI 10.1146/annurev-ecolsys-110512-135813).
- ↑ (en) Andrew Sherratt, « The secondary exploitation of animals in the Old World », World Archaeology, vol. 15, no 1, , p. 90–104 (DOI 10.1080/00438243.1983.9979887).
- ↑ (en) Organisation des Nations unies pour l'alimentation et l'agriculture, « Données de l’alimentation et de l’agriculture », sur FAOSTAT (consulté le ).
- 1 2 3 4 5 (en) John A. Marchello et Elaine V. Marchello, « Contributions to Society : Slaughter By-Products », dans Wilson G. Pond, Duane E. Ullrey et Charlotte Kirk Baer, Encyclopedia of animal science, Boca Raton, CRC Press, , 2e éd., 952 p. (ISBN 978-1-351-23801-4), p. 258-260.
Annexes
Articles connexes
- Antilocapridae
- Cervidae
Bibliographie
Ouvrages spécialisés
- (en) Richard Estes, « Social Organization of the African Bovidae », dans Valerius Geist et Fritz R. Walther, The Behaviour of Ungulates and its relation to management, vol. 1 (documents d'un symposium international tenu à l'Université de Calgary, Alberta, Canada, du 2 au 5 novembre 1971), Morges, Union Internationale pour la Conservation de la Nature et de ses Ressources, , 940 p. (lire en ligne [PDF]), p. 166-205.
- (en) Richard Estes, chap. 2 « Antelopes and Buffalo : Family Bovidae », dans The behavior guide to African mammals : including hoofed mammals, carnivores, primates, University of California Press, , 611 p. (ISBN 978-0-520-05831-6, lire en ligne), p. 7-25.
- (en) Colin P. Groves, David Leslie, Brent Huffman, Raul Valdez, Khushal Habibi, Paul Weinberg, James Burton, Peter Jarman et William Robichaud, « Family Bovidae (Hollow-horned Ruminants) », dans Don E. Wilson et Russell A. Mittermeier, Handbook of the mammals of the world, Lynx Edicions, , 886 p. (ISBN 978-84-96553-49-1).
- (en) Jonathan Kingdon et Michael Hoffmann, Mammals of Africa, vol. VI : Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer, and Bovids, Londres, Bloomsbury Publishing, (ISBN 978-1-4081-2251-8, lire en ligne).
- (en) José R. Castelló, Bovids of the world : antelopes, gazelles, cattle, goats, sheep, and relatives, Princeton et Oxford, Princeton University Press, , 664 p. (ISBN 978-1-4008-8065-2, lire en ligne).
Articles scientifiques
- Herbert Thomas, « Les bovidae (Artiodactyla: Mammalia) du miocene du sous-continent indien, de la peninsule arabique et de l'afrique : Biostratigraphie, biogeographie et ecologie », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 45, nos 3-4, , p. 251–299 (DOI 10.1016/0031-0182(84)90009-9).
- (en) Barbara Lundrigan, « Morphology of Horns and Fighting Behavior in the Family Bovidae », Journal of Mammalogy, vol. 77, no 2, , p. 462–475 (DOI 10.2307/1382822).
- (en) Alexandre Hassanin et Emmanuel J.P Douzery, « The Tribal Radiation of the Family Bovidae (Artiodactyla) and the Evolution of the Mitochondrial Cytochrome b Gene », Molecular Phylogenetics and Evolution, vol. 13, no 2, , p. 227–243 (DOI 10.1006/mpev.1999.0619).
- (en) Mario Gagnon et Amy E. Chew, « Dietary Preferences in Extant African Bovidae », Journal of Mammalogy, vol. 81, no 2, , p. 490–511 (DOI 10.1093/jmammal/81.2.490).
- (en) Conrad A. Matthee et Scott K. Davis, « Molecular Insights into the Evolution of the Family Bovidae : A Nuclear DNA Perspective », Molecular Biology and Evolution, vol. 18, no 7, , p. 1220–1230 (DOI 10.1093/oxfordjournals.molbev.a003908).
- (en) Faysal Bibi, Maia Bukhsianidze, Alan W. Gentry, Denis Geraads, Dimitris S. Kostopoulos et Elisabeth S. Vrba, « The Fossil Record and Evolution of Bovidae : State of the Field », Palaeontologia Electronica, vol. 12, no 3, , p. 11 (lire en ligne [PDF]).
- (en) Faysal Bibi, « Mio-Pliocene Faunal Exchanges and African Biogeography : The Record of Fossil Bovids », PLoS ONE, vol. 6, no 2, , p. 1-10 (DOI 10.1371/journal.pone.0016688).
- (en) Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer et al., « Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes », Comptes Rendus Biologies, vol. 335, no 1, , p. 32–50 (DOI 10.1016/j.crvi.2011.11.002).
- (en) Faysal Bibi, « A multi-calibrated mitochondrial phylogeny of extant Bovidae (Artiodactyla, Ruminantia) and the importance of the fossil record to systematics », BMC Evolutionary Biology, vol. 13, no 1, , p. 166 (DOI 10.1186/1471-2148-13-166).
- (en) Chengzhong Yang, Changkui Xiang, Wenhua Qi, Shan Xia et al., « Phylogenetic analyses and improved resolution of the family Bovidae based on complete mitochondrial genomes », Biochemical Systematics and Ecology, vol. 48, , p. 136–143 (DOI 10.1016/j.bse.2012.12.005).
- (en) Ignacio A. Lazagabaster, John Rowan, Jason M. Kamilar et Kaye E. Reed, « Evolution of Craniodental Correlates of Diet in African Bovidae », Journal of Mammalian Evolution, vol. 23, no 4, , p. 385–396 (DOI 10.1007/s10914-016-9329-x).
- (en) K. Zhang, J. A. Lenstra, S. Zhang, W. Liu et J. Liu, « Evolution and domestication of the Bovini species », Animal Genetics, vol. 51, no 5, , p. 637–657 (DOI 10.1111/age.12974).
- (en) Bian Wang, Miriam Zelditch et Catherine Badgley, « Geometric morphometrics of mandibles for dietary differentiation of Bovidae (Mammalia: Artiodactyla) », Current Zoology, , p. 1-13 (DOI 10.1093/cz/zoab036).
- (en) Zachary T. Calamari, « Total Evidence Phylogenetic Analysis Supports New Morphological Synapomorphies for Bovidae (Mammalia, Artiodactyla) », American Museum Novitates, no 3970, , p. 1-38 (DOI 10.1206/3970.1, lire en ligne [PDF], consulté le ).
Publication originale
- (en) John Edward Gray, « On the natural arrangement of vertebrose animals », London Medical Repository, no 15, , p. 297-310 (lire en ligne).
Autres publications taxinomiques
- (la) Carl von Linné, Systema naturae, Stockholm, Salvius, , 823 p. (lire en ligne).
- (en) John Edward Gray, Catalogue of the specimens of Mammalia in the collection of the British Museum, vol. 3 : Ungulata furcipeda, Londres, Trustees of the British Museum, (lire en ligne), p. 286.
- (en) John Edward Gray, Catalogue of ruminant Mammalia (Pecora, Linnaeus) in the British Museum, Londres, British Museum, , 102 p. (lire en ligne).
- (en) William Henry Flower et Richard Lydekker, An Introduction to the Study of Mammals Living and Extinct, Londres, Adam et Charles Black, , 763 p. (lire en ligne).
- (en) Philip Lutley Sclater et Oldfield Thomas, The book of antelopes, Londres, R.H. Porter, 1894-1900 (lire en ligne).
- (de) Max Schlosser, Die fossilen Cavicornia von Samos : mit 10 Tafeln und 16 Textabbildungen, vol. XVII, Vienne, Braumüller, coll. « Beiträge zu Paläontologie und Geologie Österreich-Ungarns und des Orients », , 118 p. (lire en ligne).
- (en) Reginald Innes Pocock, « On the specialized cutaneous glands of ruminants », Proceedings of the Zoological Society of London, , p. 840-986.
- (en) George Gaylord Simpson, The Principles of Classification and a Classification of Mammals, New York, American Museum of Natural History, , 350 p. (lire en ligne).
- (de) Theodor Haltenorth, « Klassifikation der Säugetiere : Artiodactyla », Handbuch der Zoologie, Berlin, W. de Gruyter, vol. 8, no 32, , p. 1–167.
- (en) Alan William Gentry, « The subfamilies and tribes of the family Bovidae », Mammal Review, vol. 22, no 1, , p. 1–32 (DOI 10.1111/j.1365-2907.1992.tb00116.x).
- (en) Peter Grubb, « Review of Family-Group Names of Living Bovids », Journal of Mammalogy, vol. 82, no 2, , p. 374–388 (lire en ligne).
- (en) Peter Grubb, « Order Artiodactyla », dans Don E. Wilson et DeeAnn M. Reeder, Mammal Species of the World, Baltimore, Johns Hopkins University Press, , 3e éd. (lire en ligne), p. 637-722.
- (en) Colin P. Groves et Peter Grubb, Ungulate taxonomy, Baltimore, Johns Hopkins University Press, , 317 p. (ISBN 978-1-4214-0093-8, lire en ligne).
Liens externes
- (en) American Society of Mammalogists, « The Mammal Diversity Database (Version 1.8) », sur mammaldiversity.org, .
- (en) Gomez, W. et al., Animal Diversity Web : Bovidae, 2011 (consulté le )
- (en) Référence BioLib : Bovidae Gray, 1821 (consulté le )
- (en) Référence Catalogue of Life : Bovidae Gray, 1821 (consulté le )
- (fr+en) Référence EOL : Bovidae (consulté le )
- (en) Référence Fauna Europaea : Bovidae (consulté le )
- (fr+en) Référence GBIF : Bovidae (consulté le )
- (fr) Référence INPN : Bovidae Gray, 1821 (TAXREF) (consulté le )
- (en) Référence IRMNG : Bovidae Gray, 1821 (consulté le )
- (fr+en) Référence ITIS : Bovidae Gray, 1821 (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Bovidae Gray, 1821 (consulté le )
- (en) Référence NCBI : Bovidae (taxons inclus) (consulté le )
- (en) Référence OEPP : Bovidae (consulté le )
- (en) Référence Paleobiology Database : Bovidae (consulté le )
- (en) Référence The Taxonomicon : Bovidae Gray, 1821 (consulté le )
- (en) Référence Tree of Life Web Project : Bovidae (consulté le )
- (en) Référence UICN : taxon Bovidae (consulté le )
- (en) Référence World Register of Marine Species : Bovidae Gray, 1821 (+ liste espèces) (consulté le )