Buteo buteo
.jpg.webp)
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Accipitriformes |
| Famille | Accipitridae |
| Genre | Buteo |
Statut CITES
La Buse variable (Buteo buteo) est une espèce de rapaces diurnes de taille moyenne, appartenant à la famille des Accipitridés, très répandue dans le Paléarctique, où elle niche depuis les îles de l'océan Atlantique jusqu'au nord-ouest de la Chine et de la Mongolie, en passant par l'Europe et la Russie occidentale. Sa zone d'hivernage inclut le Paléarctique occidental, l'Afrique de l'Est et australe, ainsi que le sous-continent indien.
Comme son nom l'indique, son plumage est très variable selon les individus, mais les plus classiques ont un plumage brun uni sur le dessus, barré sur le dessous, avec un croissant blanc caractéristique sur la poitrine. Son allure est compacte, avec une tête courte et robuste. Ses ailes sont larges et arrondies. Elle est facilement confondue avec d'autres rapaces de taille moyenne, comme la Bondrée apivore, la Buse pattue et la Buse féroce.
La Buse variable est un prédateur opportuniste. Elle se nourrit principalement de micromammifères, d'où son nom de « buse des souris » dans plusieurs pays européens, mais elle consomme également des insectes, des amphibiens et reptiles, de petits oiseaux, des vers de terre et ne dédaigne pas les cadavres. Elle chasse le plus souvent à l'affût, fixe sur un arbre ou un poteau, ou mobile en décrivant de larges cercles, portée par les courants ascendants thermiques, en poussant son cri caractéristique, ressemblant à un miaulement.
Elle affectionne les interfaces entre les bois, où elle niche et où elle se repose, et les espaces ouverts, où elle chasse. En revanche, elle évite les landes, les forêts de conifères et les bâtiments. La superficie de son domaine vital est de l'ordre de 100 ha (1 km2). En période de reproduction, elle défend un territoire où elle implante son nid et qui lui sert également de terrain de chasse.
Elle forme un couple de long terme et ne change de partenaire qu'à la mort de ce dernier. Avec lui, elle bâtit plusieurs larges nids dans un endroit élevé, généralement un arbre ou une falaise, pour éviter les prédateurs de nid. Ces nids présentent la particularité d'être décorés avec de la végétation fraîche, dont la fonction est inconnue, mais qui pourrait constituer un signal de l'occupation du territoire et de la vigueur des propriétaires.
Elle pond typiquement un à trois œufs, à partir de la fin février en Europe du centre et du sud, jusqu'à la fin mai plus au nord. Les jeunes sont des nidicoles typiques et doivent être couverts par leur mère pendant deux semaines, pendant lesquelles leur poids augmente en flèche, au fur et à mesure que le père apporte des proies. Ils commencent à percher sur les branches alentour six à huit semaines après l'éclosion.
Les reprises de bagues montrent qu'une Buse variable peut vivre plus de 30 ans. Près de la moitié des oiseaux survit trois ans. Les causes de mortalité incluent les combats entre buses, la prédation par d'autres rapaces, comme l'Autour des palombes, le Pygargue à queue blanche, le Hibou grand-duc et le Faucon pèlerin et la collision avec des infrastructures humaines (voitures, trains, pylônes électriques, éoliennes). Par temps exceptionnellement rigoureux, elle peut mourir de faim, même si sa capacité à absorber les nutriments et son régime alimentaire particulièrement adaptable la rendent beaucoup moins susceptible à ce risque que d'autres rapaces.
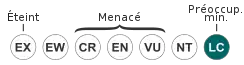
Très commune dans son aire de répartition, la Buse variable a été persécutée à partir du XVIe siècle à cause de ses déprédations sur les oiseaux de basse-cour, puis sur le gibier à plumes, au point de pratiquement disparaître dans certaines régions. Avec une population estimée à un million de couples en Europe, elle est aujourd'hui l'une des espèces de rapaces les plus abondantes au monde et ses effectifs sont en croissance depuis les années 1980 dans la plupart des pays européens. Elle est donc considérée comme une espèce de préoccupation mineure par l'UICN.
Dénomination, taxonomie et systématique
Noms et étymologie
Le nom binominal de la Buse variable, Buteo buteo est un tautonyme : son épithète spécifique est identique au nom de genre. Le terme buteo vient directement du latin et signifie « buse, busard » ou « butor »[1]. Il viendrait d'une base b-t d'origine onomatopéique, en lien avec son cri perçant[2].
Le nom vernaculaire « buse » est une dérivation régressive de l'ancien français buison ou buson. Dans son aire de répartition, les termes « buse commune », « buse vulgaire », voire « buse » tout court désignent la Buse variable[3]. L'épithète « variable » renvoie à la forte variabilité de son plumage. Buffon note : « Cette espèce est sujette à varier, au point que, si l'on compare cinq ou six buses ensemble, on en trouve à peine deux bien semblables »[4].
Au sens figuré, le mot « buse » désigne une personne stupide, ignorante et bornée ; on parle même de triple buse[5]. Sans doute cet usage péjoratif tient-il à ce que cet oiseau se dresse mal pour la chasse au vol. Buffon écrit aussi : « cet oiseau (…) paraît assez stupide, soit dans l'état de domesticité, soit dans celui de liberté »[4].
Les noms de la Buse variable dans d'autres langues européennes font souvent allusion à son régime alimentaire : elle est la « buse des souris » ou le « souricier » en allemand (Maüsebussard), bulgare (Обикновен мишелов), danois (Musvåge), espagnol (busardo ratonero), finnois (hiirihaukka), hongrois (Egerészölyv), islandais (Músvákur), norvégien (Musvåk), polonais (myszołów) et serbe (Mišar), et le « souricier des montagnes » en slovaque (myšiak hôrny). En suédois, elle est celle qui mange des serpents (ormvråk), tandis qu'en italien (poiana comune), elle se nourrit de poules et est commune. D'autres langues insistent sur son caractère commun, comme l'anglais (common buzzard), le catalan (aligot comú) et le roumain (șorecar comun). En néerlandais, elle est simplement une buse (buizerd) ; en tchèque, c'est une buse des forêts (káně lesní). En portugais, il s'agit d'un aigle à ailes arrondies (águia-d'asa-redonda). Plus récemment, l'ONG Birdlife International et le Handbook of the Birds of the World ont opté pour le nom Eurasian Buzzard ou « Buse d'Eurasie », en référence à son aire de répartition[6].
Il est à noter que l'anglais buzzard vient de l'ancien français buisart, c'est-à-dire « buse » avec le suffixe péjoratif -art/ard, renvoyant là encore à son incapacité à chasser[7]. Dans les années 1830, le nom est été repris dans le Nouveau Monde pour désigner de nouvelles espèces jugées semblables, mais sans lien avec le genre Buteo, comme l'Urubu à tête rouge, souvent appelé turkey buzzard. Inversement, le mot français busard est un faux ami renvoyant au genre Circus.
Taxonomie
La Buse variable a été formellement décrite par le naturaliste suédois Carl von Linné en 1758 sous le nom Falco buteo, littéralement « Faucon buse »[8]. Le genre Buteo a été créé en 1799 par Lacépède en 1799 par tautonymie, d'où le nom scientifique actuel Buteo buteo. Les naturalistes Conrad Gessner et Francis Willughby avaient précédemment proposé Buteo vulgaris (« Buse vulgaire ») respectivement en 1555 et 1678[9].
Le genre Buteo compte actuellement 28 espèces, dont dix de l'Ancien Monde, mais sa phylogénie est controversée[10]. Une équipe autrichienne a étudié six espèces et treize sous-espèces qui s'y rattachent, selon deux approches différentes : morphométrique et génétique. La première, fondée sur les mensurations des oiseaux (longueur et largeur de l'aile, longueur du tarse, largeur du bec, etc.), confirme quatre taxons : Buteo brachypterus, Buteo hemilasius, Buteo oreophilus et Buteo buteo. Buteo rufinus rufinus est lui aussi bien distinct, mais Buteo rufinus cirtensis se rapproche beaucoup de Buteo buteo. L'approche génétique produit des résultats différents : seuls les taxons du Paléarctique oriental (Buteo buteo japonicus, Buteo buteo refectus, Buteo buteo toyoshimai et Buteo hemilasius) sont bien différenciés, contrairement à ceux du Paléarctique occidental qui forment un complexe d'espèces. En conclusion, les auteurs proposent d'élever Buteo buteo refectus au rang d'espèce, de même que Buteo buteo japonicus (avec deux sous-espèces, japonicus et toyoshimai). Buteo buteo deviendrait une super-espèce comprenant trois allo-espèces : Buteo [buteo] buteo, Buteo [buteo] rufinus et Buteo [buteo] oreophilus[11].
La faible différenciation génétique entre les buses de l'Ancien Monde suggère une origine assez récente, durant la dernière glaciation, à partir d'une population isolée de Buse rouilleuse ou de Buse pattue en Béringie, un pont terrestre qui a existé de manière intermittente entre la Sibérie orientale et l'Alaska[12].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Autres Accipitridae | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En raison de la très forte variabilité du plumage au sein de chaque espèce, la détermination d'hybrides de buses est une tâche particulièrement ardue[14]. Néanmoins, quelques cas ont été documentés. Deux couples de Buse variable × Buse pattue ont été rapportés en Norvège et en Finlande ; dans les deux cas, le couple a élevé des jeunes[14]. Une zone d'hybridation existe avec la Buse féroce en Hongrie, en Italie et en Espagne[14]. Des Buses variables se sont également reproduites avec des Milans noirs en Italie, sans que l'on sache si la descendance est fertile[15].
Sous-espèces
| Sous-espèces | Aire de répartition | Décrit par | Autres |
|---|---|---|---|
| Buteo buteo bannermani | Cap-Vert | Swann,1919 | parfois traitée comme une espèce à part entière, la buse du Cap-Vert |
| Buteo buteo buteo | Europe | Linnaeus,1758 | |
| Buteo buteo harterti | Madère | Swann,1919 | se distinguant peu de la sous-espèce buteo |
| Buteo buteo insularum | Îles Canaries | Floericke, 1903 | |
| Buteo buteo menetriesi | Caucase | Bogdanov, 1879 | |
| Buteo buteo pojana | Sardaigne, Corse, Sicile et Italie méridionale | Savi, 1831 | |
| Buteo buteo vulpinus | L'est de l'Eurasie | Gloger, 1833 | migratrice longue distance excepté pour les individus vivant dans l'Himalaya, aussi appelée Buse des steppes ou Buse de Russie. Elle est un peu plus petite que la sous-espèce nominale et arbore souvent un dessous couleur rouille[16]. |
| Sous-espèces | Aire de répartition | Décrit par | Autres |
|---|---|---|---|
| Buteo buteo arrigonii | Corse et Sardaigne | Picchi, 1903 | reconnue par Clements (6e édition, révision 2009) |
| Buteo buteo japonicus | Asie | Temminck & Schlegel, 1844 | reconnue par Clements (6e édition, révision 2009), Howard & Moore ; pour le Congrès ornithologique international, cette sous-espèce est l'espèce à part entière Buteo japonicus |
| Buteo buteo refectus | Asie | Portenko, 1935 | reconnue par Clements (6e édition, révision 2009), Howard & Moore ; pour le Congrès ornithologique international, cette sous-espèce est l'espèce à part entière Buteo burmanicus |
| Buteo buteo rothschildi | Açores | Swann, 1919 | reconnue par Clements (6e édition, révision 2009) |
Description
Dimensions
La Buse variable a une taille d'environ 50 à 57 cm de long pour une envergure de 113 à 128 cm. Son poids est de 625 à 1 364 g pour la femelle et de 525 à 1 183 g pour le mâle[17].
Apparence extérieure
La Buse variable est un rapace aux formes plutôt massives, doté d'ailes larges, avec une queue courte et large. Son plumage est très variable, d'où son nom[18]. La plupart des individus ont le haut de la poitrine sombre et très strié, un croissant pâle sur la poitrine, ainsi que des flancs et une culotte sombres[19]. Ce croissant est à peine visible chez les individus les plus sombres, tandis que les individus les plus pâles ont tendance à conserver des marques sombres sur le cou et sur les côtés de la poitrine[19].
On distingue classiquement trois formes : claire, intermédiaire et sombre[20]. Une étude fondée sur un examen photographique montre néanmoins que la variation de coloration est progressive et propose sept types différents : très sombre, sombre, intermédiaire sombre, intermédiaire, intermédiaire pâle, pâle et très pâle[21]. Des oiseaux intégralement blancs (leucisme) ont été signalés en Europe[22].
.jpg.webp) Forme pâle
Forme pâle.jpg.webp) Forme intermédiaire
Forme intermédiaire.jpg.webp) Forme sombre
Forme sombre
On distingue trois classes de plumage :
Plumage juvénile
Les couvertures alaires et les scapulaires affichent classiquement un liseré pâle qui forment un motif régulier, écailleux, sur le dessus. La queue est finement barrée, sans la bande subterminale noire de l'adulte. La tête, le cou et le dessus sont le plus souvent striés, parfois tachetés, et les couvertures sous-alaires sont striées, au lieu de barrées comme chez les adultes[23]. De loin, le dessus est caractéristique : chez le juvénile, les couvertures sus-alaires sont plus claires que les grandes couvertures et les secondaires, tandis que chez l'adulte, les parties supérieures sont assez uniformément sombres[23]. Le plumage juvénile est conservé jusqu'à l'automne de la deuxième année.
Plumage subadulte
Ce plumage est acquis à l'automne de la deuxième année, après la fin de la première mue. Il ressemble largement au plumage adulte, mais l'oiseau conserve des primaires externes juvéniles, qui apparaissent donc usées et sont plus courtes que le reste de l'aile[23]. L'iris est brun et contraste avec la pupille noire, alors que l'œil est sombre chez l'adulte[23]. Le plumage subadulte est conservé jusqu'à l'été de la troisième année.
Plumage adulte
Ce plumage est acquis à l'automne de la troisième année. Dans l'ensemble, il est plus sombre et plus uniforme que chez le juvénile[24]. De dessous, le bord de fuite de l'aile est sombre et bien marqué et la queue arbore une large bande subterminale noire[24]. L'adulte a l'iris uniformément brun sombre, sans possibilité de distinguer la pupille.
La Buse variable possède par ailleurs les attributs typiques des rapaces, comme la cire à la base du bec, usuellement du même jaune que les tarses et les serres, mais qui peut parfois être d'un jaune délavé et bleuté[25]. Les yeux, positionnés frontalement, possèdent un iris brun sombre chez l'adulte et jaune pâle chez le jeune[25]. Pour un rapace, la Buse variable possède des serres assez petites comparées à sa taille[26].
Contrairement à la plupart des autres rapaces, la Buse variable ne présente pas de dimorphisme sexuel très prononcé, ni pour la taille, ni pour le plumage[25]. Les mâles tendent à avoir la tête proportionnellement plus grosse, les ailes plus étroites et la queue plus courte que les femelles, mais il est pratiquement impossible de déterminer le sexe sur le terrain[24].
Mue

Comme chez tous les petits rapaces de type busards ou éperviers, sédentaires ou migrateurs à courte distance, le schéma de mue de la Buse variable est assez simple comparé à celui des grands rapaces de type grands aigles, pygargues et vautours[27].
La mue des rémiges (plumes de l'aile) commence par la primaire la plus interne (P1) et se termine par la plus externe (P10)[27]. Quand elle a atteint les primaires P4 à P6, celle des rémiges secondaires et des rectrices (plumes de la queue) commence[27]. La queue d'une Buse variable comporte six paires de rectrices ; leur mue commence habituellement par l'une des plumes centrales, tandis que les rectrices externes sont presque toujours renouvelées en même temps[20]. La mue des régimes secondaires se produit à partir de trois foyers : elle commence par la chute de la secondaire la plus externe (S1), puis à partir de la secondaire médiane S5 et de la secondaire S11[27]. La mue à partir de S1 et de S5 progresse en direction du corps de l'oiseau, alors que celle à partir de S11 va vers l'extérieur[27]. Les deux vagues de mue amorcées en S5 et S11 convergent au niveau de S8, au moment où celle initié en S1 atteint S5[27]. Les dernières secondaires à être renouvelées sont donc les plumes médianes S5 et S8[27].
Risques de confusion
Du fait de la variabilité de son plumage, la Buse variable est facile à confondre avec tout autre rapace de taille moyenne, sombre, avec de larges ailes, en particulier avec d'autres buses du genre Buteo, comme la Buse féroce, dont certains individus sont quasiment identiques avec la sous-espèce Buteo buteo vulpinus (Buse des steppes)[28]. Le risque de confusion est également très important avec la Bondrée apivore juvénile, un autre rapace très commun et qui possède également un plumage très variable[29]. En vol, elle s'en distingue clairement par le motif du dessous de l'aile.
Écologie et comportement
Territoire et domaine vital
Le territoire est l'espace défendu par un animal, entre autres contre ses conspécifiques, tandis que le domaine vital est celui dans lequel il recherche sa nourriture, se reproduit et élève ses petits[30],[31].
Ces espaces étaient historiquement difficiles à déterminer pour des animaux certes volants, mais souvent perchés dans la végétation. L'exercice a été grandement facilité par l'avènement du radiopistage (VHF)[32]. Dans les années 1990, une centaine de Buses variables a ainsi été équipée dans le Dorset, en Angleterre, pour suivre leur domaine d'automne, ainsi qu'une trentaine de jeunes non-reproducteurs, pour suivre leur domaine d'hiver. L'étude, qui a duré quatre ans, a permis de déterminer un domaine vital d'environ 100 ha2 (1 km2)[33]. Une autre étude menée en Allemagne du nord à la même époque, avec des marques alaires, aboutit à un résultat similaire pour des oiseaux territoriaux et à 10 km2 pour des jeunes non-reproducteurs[34]. En comparaison, les domaines vitaux des Autours des palombes, au gabarit similaire, sont dix fois plus grands au Royaume-Uni, pour un habitat similaire (terres agricoles parsemées de petits bois). En Suède, au fur et à mesure que la couverture boisée diminue, ils sont trois à dix fois plus grands qu'au Royaume-Uni et vont jusqu'à 100 km2 dans la forêt boréale extensive[35].
Comme la plupart des rapaces, la Buse variable niche à espace régulier : le voisin le plus proche se trouve entre 0,5 et 2,7 km dans une étude menée dans le Speyside, en Écosse[36], entre 0,5 et 4,2 km dans une autre menée dans le Dorset[37]. Les frontières des territoires tendent à suivre des éléments naturels : buttes, lisières de bois, etc.[38] Le point culminant du territoire tend à se trouver en périphérie de territoire et presque jamais au centre[39], probablement pour mieux protéger le territoire contre des intrus[40].
Les frontières des territoires tendent à être stables dans le temps. Ainsi, un réexamen en 1988-1989 de la zone étudiée dans le Speyside en 1968-1971 a montré une hausse de 57 % du nombre de territoires, sans changement significatif dans la superficie de chaque territoire : les Buses variables supplémentaires ont colonisé des zones inoccupées[41]. Plus récemment, plusieurs études ont montré une augmentation de la densité en Buses variables : elle a été multipliée par deux entre 1977 et 2007 à Snowdonia[42], dans le nord du pays de Galles, et par huit entre 1982 et 2012 près de Bristol[40].
.jpg.webp)
Les territoires des Buses variables établies sont défendus toute l'année. Pour autant, elles se battent peu entre voisins et tendent à respecter les frontières : en règle générale, elles ne les franchissent pas, sauf pour chasser un intrus. Les jeunes non-reproducteurs sont, eux, susceptibles de circuler à la recherche d'un propriétaire susceptible d'être évincé ou d'une zone mal défendue, où ils puissent se tailler un territoire. Il arrive que des Buses variables célibataires puissent tenir un territoire, souvent pendant l'hiver et généralement de plus petite taille que les territoires des couples reproducteurs[43].
Les Buses variables défendent aussi leur territoire contre d'autres espèces, au premier chef d'autres rapaces. Elles partagent leur aire de répartition avec un certain nombre d'entre eux, notamment le Hibou grand-duc et l'Autour des palombes. Dans une étude allemande, un autour empaillé a été installé à 25-50 m de nids de buse actifs, accompagné de 45 min de cris d'autour enregistrés. Le taux de jeunes à l'envol a été de 33 % dans ces nids, contre 75 % dans les sites témoin. L'année suivante, bon nombre des Buses dans les nids ciblés ont choisi de déménager[44]. Des espèces de même taille que la Buse variable, comme le Milan noir[45] et la Bondrée apivore[46] peuvent également entrer en concurrence pour les sites de nidification. Les Buses variables peuvent également être la cible d'espèces plus petites, comme le Faucon crécerelle, probablement pour prévenir des attaques contre leurs petits[43].
Régime alimentaire

La Buse variable est carnivore et opportuniste. Les auteurs d'une monographie qui lui est consacrée, Sean Walls et Robert Kenward, écrivent ainsi : « les buses sont sans doute prêtes à manger tout ce qui bouge et qui est une source probable de gras et de protéines »[47]. Son régime alimentaire a été étudié par l'observation, l'examen des restes au nid, l'analyse du contenu de l'estomac et des pelotes de réjection, chaque technique possédant ses propres limitations[48].
La Buse variable se nourrit largement de rongeurs, d'où son nom dans un certain nombre de langues : Maüsebussard (« buse des souris ») en allemand et Ratonero commun (« ratier commun ») en espagnol[49]. Ainsi, dans une étude menée en hiver sur des landes à Lagopède d'Écosse (grouse), l'analyse des pelotes a montré que les petits mammifères représentaient 60 à 67 % des proies et étaient présentes dans 88 à 92 % des pelotes[50]. Les micromammmifères proies les plus fréquents sont le Campagnol agreste (Microtus agrestis) au Royaume-Uni et en Pologne et le Campagnol des champs (Microtus arvalis) en Norvège, en Finlande et en Espagne, probablement parce que ces espèces sont actives en journée, quand la buse chasse[51]. Son choix peut varier selon l'altitude : en Slovaquie centrale, durant le pic de campagnols de 2007, les couples de la vallée se sont focalisés sur le Campagnol des champs et ceux du piémont sur la taupe et sur le Campagnol roussâtre, tandis que ceux des monts Vtáčnik se sont concentrés sur le Campagnol roussâtre (Apodemus flavicollis)[52]. Le régime alimentaire de la Buse inclut également l'Écureuil roux[53],[54], des musaraignes et le hérisson[55].
Selon l'endroit, le Lapin de garenne peut constituer la proie majoritaire, notamment dans les îles Britanniques[56]. En Irlande du Nord, où les campagnols du genre Microtus sont absents, le succès reproducteur de la Buse variable est même corrélé aux fluctuations de la population de lapins[57]. La plupart du temps, les lapins tués sont des jeunes, qui n'ont pas encore atteint leur taille d'adulte[38],[58] — le poids maximal d'une proie semble être de 500 g[59]. Quand les lapins sont rares ou absents, la buse peut se tourner vers le Lièvre d'Europe et le Lièvre variable, notamment en Finlande[60], en Norvège[61], en Italie[45] et en Écosse[62].
Les oiseaux figurent également à son tableau de chasse. Dans certains cas, ils représentent jusqu'à 75 % des restes trouvés au nid[55]. Le plus souvent, cette proportion élevée correspond à des années avec peu de campagnols[63] ou dans les zones où les campagnols sont absents[57]. Certains individus se spécialisent également dans la capture d'oiseaux : dans une étude menée en Angleterre, quelques nids ne contenaient que des restes de Pigeon ramier[64]. Dans la forêt de Białowieża, en Pologne, les pelotes se composent en majorité d'os d'oiseaux, dont la moitié de Grives musiciennes[55]. Dans les pré-Alpes italiennes, les oiseaux forment 46 % des proies des buses locales, avec une majorité de Merles noirs[45]. Plutôt que de sélectionner certaines espèces, un certain nombre de buses visent les juvéniles en général, plus faciles à capturer et à rapporter au nid, et dont le pic correspond à la nécessité de nourrir leurs propres jeunes[65]. Ainsi, les juvéniles forment 61 % des oiseaux des bois capturés à Białowieża[55]. En Irlande, où les campagnols sont absents, les buses locales se sont spécialisées dans les jeunes corvidés : selon une estimation, les buses irlandaises pourraient en tuer 135 000 par an[57]. Des buses ont également été vues en train de capturer des oisillons au nid, y compris de petites espèces comme des Gobemouches noirs[66] ou des Pouillots siffleurs[67]. La buse est souvent accusée de manger les poules ; il semble que le phénomène soit rare, dû à des oiseaux spécialisés et plutôt en hiver, quand la faim les tenaille[68].
_konnaga_2012.jpg.webp)
La Buse variable se nourrit également de reptiles et d'amphibiens, notamment dans le sud de l'Europe[69]. En Catalogne, les reptiles peuvent représenter la deuxième source de proies, avec des espèces comme Psammodromus algirus ou le Lézard ocellé[58]. Dans le nord de l'Espagne, l'analyse d'estomacs de buses a montré des Salamandres tachetées, des amphibiens de la famille des Dicroglossidae, et des Anoures[70]. Dans les pré-Alpes italiennes, les serpents et les Crapauds communs peuvent constituer un quart des restes trouvés au nid[45]. Même en Norvège, les reptiles et amphibiens peuvent peser pour un tiers des restes trouvés au nid. De manière contre-intuitive, leur part est plus élevée les années à campagnols, sans doute parce que les buses chassent dans les zones, comme les coupes rases, où ils prennent le soleil[71]. Au Royaume-Uni, leur poids dans le régime alimentaire des buses a été estimé à 20 % en masse, avec une variation saisonnière des proies : les Grenouilles rousses sont consommées en mars-avril, lors de leur migration vers les zones de ponte, tandis que la Vipère péliade, les lézards du genre Lacerta et les Orvets communs sont mangés au printemps et en été[69].
La capture d'invertébrés est connue dès le XVIIe siècle[72]. Le pionnier de l'ornithologie Francis Willughby écrit ainsi en 1676 : « faute de mieux, elle se nourrit de scarabées, de vers de terre et d'autres insectes »[73]. Dans une étude réalisée en Catalogne sur des cadavres de buses confisqués à des braconniers, 73 % des proies dans les estomacs analysés étaient des invertébrés[58]. Les Buses variables fréquentent les champs récemment labourés ou semés à la recherche de vers de terre, en particulier en hiver où ils peuvent quasiment suffire à les sustenter, s'ils sont présents en quantité suffisante[74]. Les buses peuvent aussi se nourrir d'orthoptères[75]. Une étude menée en Auvergne-Limousin une année sans campagnols montre ainsi une prépondérance des Grillons champêtres dans leur alimentation[76]. Les buses se nourrissent notamment de gros coléoptères lents à se déplacer, comme les géotrupes ou les Minotaures[75]. Dans le Devon, elles ont également été vues capturant des larves de papillons, de tipules et de taons et même des papillons adultes (Piéride du chou), des perce-oreilles, des araignées et des cloportes[38].

Adeptes du moindre effort, les Buses variables se font charognardes dès qu'elles en ont la possibilité[77]. Elles exploitent les animaux tués en bord de route, patrouillant le long les voies pour trouver leur repas[78], au risque d'être elles-mêmes percutées[79]. Dans une étude réalisée dans une forêt anglaise, avec des cadavres de cervidés (Cerf sika et Chevreuil européen) surveillés par des pièges photographique, les Buses variables ont figuré parmi les principaux charognards, surtout lors de la période froide, et intervenaient avant les insectes nécrophages[80]. Elles fréquentent les sites de nourrissage britanniques pour Milans royaux réintroduits et font les poubelles des abattoirs[38]. Tout leur est bon : bisons dans la forêt de Białowieża[81], agneaux morts dans les champs gallois[82], belettes ou renards[38] et même cadavres d'autres buses[83]. Elles préfèrent néanmoins les cadavres de petits mammifères, comme les lapins, à ceux d'animaux plus gros, sauf si la carcasse a déjà été ouverte[84]. Lorsqu'elle charogne, la Buse variable est généralement en compétition avec d'autres espèces. Une étude menée en Écosse montre qu'elle parvient la plupart du temps à les écarter : elle domine non seulement les Corneilles mantelées, mais aussi les Grands Corbeaux et les Goélands marins[84].
Des observateurs rapportent également des proies inhabituelles, comme du poisson, probablement mangé à l'état de cadavre, car les Buses variables ne sont pas taillées pour plonger dans l'eau[74],[85]. Une Buse variable pêchant une carpe avec ses serres a toutefois été photographiée en France, dans le Gard[86]. Une autre a été signalée mangeant des pommes[87].
Techniques de chasse
Si le Faucon pèlerin est célèbre pour son attaque en piqué et le Faucon crécerelle pour son vol « en Saint-Esprit », la Buse variable est surtout connue pour scruter ses environs, posée sur un perchoir ou volant en grands cercles, haut dans le ciel[88].
Caractéristiques physiques

Son style de chasse s'explique par des considérations physiologiques. Ses larges ailes lui offrent une bonne portance et autorisent un vol lent, propice à une inspection scrupuleuse du sol pour détecter des proies dans la végétation. Dans la mesure du possible, elle garde ses ailes déployées et immobiles, pour minimiser la dépense d'énergie[90]. Inversement, la largeur de ses ailes génère de la traînée, ce qui la rend incapable de la vitesse d'attaque des faucons aux ailes étroites, mais lui permet de manœuvrer plus facilement et notamment d'opérer des virages plus serrés que d'autres rapaces de même taille[91]. Ses muscles pectoraux, moins imposants que ceux des rapaces spécialisés dans l'attaque, lui interdisent de battre rapidement des ailes. Son appareil digestif est en revanche comparativement plus long. Elle est donc plus efficace pour extraire des nutriments de ses proies[89].
La Buse variable présente des serres assez courtes : l'Autour des palombes, par exemple, possède des doigts et des griffes 20 % plus longs alors que son gabarit est très similaire[91]. Cette particularité s'explique sans doute parce que des serres plus grandes seraient moins adaptées à la capture de petites proies dans une végétation dense. En outre, des doigts plus courts lui offrent une poigne plus ferme, utile notamment pour maîtriser lièvres et lapins[92].
Son bec est assez large, ce qui lui permet d'avaler tout ronds les rongeurs et par grandes bouchées les plus gros mammifères. La Buse variable peut donc manger plus rapidement que le Faucon pèlerin ou l'Autour des palombes, qui consacrent beaucoup de temps à préparer leur proie en arrachant ses plumes ou ses poils[93].
Comme beaucoup de rapaces, la Buse variable possède deux fovéas, zones de la rétine où la vision des détails est la plus précise, contre une seule chez l'humain[94]. Ses grands yeux collectent une grande quantité de lumière et lui permettent de chasser depuis une demi-heure avant le lever du soleil jusqu'à l'obscurité quasi complète[95].
Chasse en vol
Quand elle chasse en vol, la Buse variable combine vol plané et vol à voile, voire vol stationnaire pour surveiller le sol, généralement à une hauteur de 15 à 30 mètres au-dessus du sol. Quand elle a repéré sa proie, elle referme ses ailes et plonge quasiment à la verticale avant d'effectuer un court vol plané à haute vitesse. Au dernier moment, elle lance les serres vers l'avant pour capturer sa proie, produisant au passage un claquement sec dû au choc des ailes sur le sol. Si la proie est de grande taille, la buse au sol garde parfois ses ailes déployées pour se stabiliser pendant qu'elle la met à mort avec ses serres[96].
Pour repérer sa proie, la buse se fonde parfois sur des indices humains : elle suit volontiers les moissonneuses-batteuses en espérant capturer des petits mammifères[97]. Elle attend également à proximité des tracteurs faisant les foins[38]. Elle peut aussi survoler le sol à faible altitude, à moins de 3 m de hauteur, à la recherche d'invertébrés[98].
La Buse variable peut pratiquer le vol sur place, mais assez rarement[59]. Ce type de chasse s'observe le plus souvent au printemps, dans les terrains ouverts et les landes qui possèdent peu de perchoirs, et par météo favorable : temps sec et ensoleillé, avec une brise modérée[99]. La Buse adopte alors l'attitude dite « du Saint-Esprit », caractéristique du Faucon crécerelle : face au vent, elle étend les ailes en écartant bien les primaires et tient sa queue en éventail, tout en baissant la tête pour scruter le sol[100].
Chasse au perchoir

Peu énergivore, la chasse au perchoir est une technique très utilisée, au point que l'existence de perchoirs convenables est un critère de choix primordial pour un territoire[101]. Dans une étude menée au nord de la Suède, des perchoirs artificiels ont été installés dans des clairières créées par coupe rase. Au printemps, les Buses variables ont utilisé significativement plus ces clairières que les clairières-témoin, dépourvues de perchoirs. Quand les perchoirs ont été déménagés dans les clairières-témoin, les buses ont changé de terrain de chasse[102]. Par ailleurs, les perchoirs sont multi-fonctions : ils servent à chasser, à se reposer ou à signaler sa défense d'un territoire[103].
Sur son perchoir, la buse se tient face au vent et tourne la tête pour scruter les environs[103]. Si cette surveillance ne permet pas de détecter de proies, la buse change de perchoir, souvent en suivant une clôture ou une haie[38]. La durée passée à chaque perchoir est variable : dans une étude, la buse change de perchoir après 8 minutes environ[102], dans une autre, après deux à trois heures[38]. La différence tient sans doute au degré de faim de l'individu observé[103]. Quand elle détecte un mouvement, la buse tend la tête et parfois l'ensemble du corps vers l'avant, comme un sprinter sur les starting-blocks[103]. Suivant la hauteur du perchoir, la buse se laisse tomber de ce dernier ou plane directement, dans une approche silencieuse, jusqu'à sa proie. Dans une observation inhabituelle, une buse a été vue perchée sur le versoir d'une charrue en train de retourner la terre au printemps, probablement pour capturer des vers de terre[104].
Chasse au sol
La chasse au sol est utilisée principalement pour les invertébrés et en particulier les vers de terre. Les buses se tiennent campées sur leurs pattes et tournent la tête en tous sens, en partie pour détecter des vers et en partie pour détecter une éventuelle attaque. Une fois le ver repéré, elles l'attrapent par le bec et tirent dessus pour le faire sortir de terre. Elles peuvent courir au sol d'un ver à l'autre avec une vitesse surprenante, à la manière des turdidés. Quand le terrain est favorable, par exemple dans un champ fraîchement retourné, elles peuvent se trouver à plusieurs dizaines, parfois en compagnie de Laridés et de limicoles[105].
Mise à mort des proies

Contrairement aux faucons, les Buses variables ne disposent pas d'une encoche sur le bec pour faciliter la mise à mort des proies[106]. Une expérience a été menée avec des souris de laboratoire vivantes et avec un leurre en forme de souris, relié à un dynamomètre. Dans les deux cas, la buse attrape la souris avec une seule patte, sans préférence entre la gauche ou la droite. Elle exerce une série de pressions de quelques secondes, pour une durée totale moyenne de 26 s[107]. La pression exercée est en moyenne de 5,8 kg/cm2, avec un maximum de 8,75 kg/cm2, suffisante pour entraîner la mort par suffocation sur un animal de cette taille. Il est probable que la buse parvienne également à écraser la cage thoracique des lagomorphes[106].
Une fois la proie mise à mort, la Buse variable adopte la posture dite du « manteau », avec les ailes déployées pour recouvrir sa nourriture. Pendant qu'elle mange, elle relève la tête de temps en temps pour surveiller les alentours. Il s'agit d'éviter à la fois d'être volée par un autre prédateur et d'être attaquée. En période de reproduction, la buse rapporte directement sa proie au nid[106].
Cleptoparasitisme
La Buse variable vole parfois une proie déjà capturée par autrui, une pratique qualifiée de cleptoparasitisme. Elle a été observée harcelant des individus de plusieurs espèces pour leur faire lâcher leur prise : Faucon hobereau[108], Faucon pèlerin[109], Faucon de Barbarie et Faucon crécerelle[110] ou encore Busard des roseaux[111]. Dans la plupart des cas, la victime est beaucoup plus petite que la Buse variable, ce qui réduit le risque de représailles[112]. Dans une observation, la buse, inexpérimentée, s'est fait reprendre sa proie, un cadavre de Mouette rieuse, par le jeune Faucon pèlerin qui l'avait capturée[113].
Budget énergétique
Sur la base de deux ans d'observations dans le sud de la Suède, où la Buse variable est sédentaire, la dépense énergétique quotidienne d'une buse a été évaluée à 149 kcal en hiver (de novembre à février) et à 278 kcal pendant la saison de reproduction (d'avril à juillet)[114],[115]. Les besoins hivernaux correspondent environ à 100 g de proies ou cinq Campagnols agrestes[116]. En présence d'une grande quantité de nourriture, les Buses peuvent manger beaucoup plus que nécessaire, jusqu'à 30 % de leur poids en une journée, contre 10-15 % normalement[117]. La quantité de nourriture nécessaire pour mener un jeune à l'envol a été estimée à 7 kg dans le Dartmoor, soit l'équivalent de 350 Campagnols agrestes adultes ou de 28 jeunes lapins[118].
La Buse variable peut consacrer jusqu'à 16 heures 30 par jour à la chasse l'hiver ou par mauvais temps. Au printemps, la période de chasse dure plutôt 8 heures 30 à 11 heures pour un mâle. En hiver, elle peut jeûner jusqu'à 15 jours[119]. Des individus affamés ont été pesés en Allemagne pendant des hivers rigoureux : les mâles ne pesaient que deux tiers du poids d'un individu en bonne santé et les femelles encore moins, soit l'équivalent du poids de juvéniles âgés de trois à quatre semaines[117].
Vocalisations
La Buse variable produit le plus souvent le cri hi-é, décrit comme un miaulement[120],[121]. On dit qu'elle « piaule », terme issu de l'onomatopée évoquant un bruit aigu et qui a donné aussi « piailler » ou « pioupiou »[122]. Elle émet son cri presque exclusivement quand elle tourne dans le ciel, dans son territoire, en rencontrant d'autres Buses variables, ou lors des parades nuptiales. Elle pousse également des ksièèè grinçants lors de l'accouplement et la femelle quémande auprès du mâle par le cri psiii[121].
Reproduction
La Buse variable peut se reproduire à partir de sa seconde année, mais la plupart s'y mettent plus tard, à trois, quatre ans, voire au-delà[123].
Parades nuptiales
Le mécanisme de formation des couples est connu essentiellement par une longue série d'observations réalisées près de Bristol, en Angleterre[40]. Une femelle en quête d'un partenaire qui arrive dans le territoire d'un mâle célibataire s'installe sur un perchoir. Le mâle s'adonne alors à des simulacres d'attaque, esquivant la femelle à la dernière minute, pendant qu'elle reste impassible, comme si elle testait la compétence du mâle à défendre leur futur territoire. La femelle se fonde également sur l'apparence des candidats : elle tend à préférer ceux qui ressemblent à sa mère[124]. Une fois le couple formé, les parades se poursuivent, cette fois à deux : le couple s'élève sur un courant ascendant thermique en décrivant des cercles concentriques, avant de survoler son territoire. Cette ascension est entrecoupée de poursuites et de démonstrations acrobatiques[125].
Le mâle commence à nourrir la femelle environ un mois avant la ponte, début mars au Royaume-Uni, ce qui marque le début des copulations. La femelle la sollicite habituellement en baissant la tête, depuis un endroit dégagé : branche, piquet, rocher, pylône. Le mâle plane au-dessus d'elle avant de se poser sur son dos pour le baiser cloacal. Ces copulations se réitèrent tout au long de la saison de reproduction et même au-delà de la dernière éclosion[126],[127]. Leur rythme culmine début avril au Royaume-Uni, avec plus d'une copulation par heure[128].
Comme la plupart des rapaces, la Buse variable est monogame, mais il existe plusieurs observations de polygynie (plusieurs femelles pour un mâle) comme de polyandrie (plusieurs mâles pour une femelle). À Fuerteventura, dans les îles Canaries, une femelle et deux mâles de la sous-espèce locale, Buteo buteo insularum ont été vus prenant part ensemble à des parades nuptiales et défendant activement le nid contre les Grands Corbeaux. Alors que la femelle était en train de couver, elle a rejoint l'un des deux mâles pour copuler. L'autre mâle, situé à une dizaine de mètres, s'est aussitôt envolé vers le nid pour prendre le relais de l'incubation. La ponte contenait quatre œufs, soit plus que la moyenne. Elle n'a toutefois pas été menée à terme, le trio ayant abandonné le nid alors qu'il ne comptait plus qu'un seul œuf[129]. Les oiseaux sédentaires semblent vivre en couple durant toute leur vie[120].
Nidification
En règle générale, la Buse variable construit elle-même son nid, même si le réemploi n'est pas inconnu : dans l'ouest de la Finlande, 26 % des nids étaient d'anciens nids d'autres rapaces, plus petits[130]. L'emplacement peut être assez variable : en plaine, la Buse variable tend à nicher dans un arbre, mais elle peut aussi s'installer sur une falaise ou même directement sur le sol[131].

Quand elle niche dans un arbre, la Buse variable choisit plutôt un bosquet ou du moins un arbre proche de la lisière du bois. La densité en nids tend à décroître avec la taille d'un bois, sans doute parce que les buses préfèrent s'installer sur le pourtour[132] : l'accès aux zones de chasse et le transport des proies vers le nid est ainsi plus court[127]. Les buses n'ont même aucun problème à établir leur nid dans des haies d'arbres. Dans une zone d'Irlande du nord où les forêts sont rares, les nids se sont trouvés majoritairement dans des arbres de haie (30 %), par opposition aux lisières de bois (21 %) et aux bosquets (13 %)[126].
Les buses ne semblent pas attachées à une essence d'arbre particulière. Les nids se trouvent à 50 % dans des chênes dans le Limousin[133] et à 78 % en Côte-d'Or[134], mais en Finlande, ils sont à 66 % dans des épicéas[135] et dans le Jura souabe, à 70 % dans des hêtres[136]. Des nids ont même été trouvés dans un Sorbier des oiseleurs et dans une aubépine dans le Dartmoor[38] et dans des Bouleaux verruqueux dans le Dorset[137]. En revanche, les buses choisissent avec soin leur type d'arbre : elles préfèrent les spécimens les plus âgés, sans doute parce qu'ils sont plus hauts et avec des branches plus solides[137]. Elles apprécient également les arbres abîmés, qui présentent des fourches ou des branches horizontales. Les nids sont généralement bâtis assez haut : les plus bas se situent à 4 m et la majorité se trouve entre 11 et 15 m[138].
Les falaises rocheuses sont plus souvent utilisées à des altitudes plus élevées. La préférence des buses pour les falaises ou pour les arbres n'est pas claire : selon les études, elles favorisent les unes ou les autres. Il est possible que la préférence pour un type de nid résulte d'une empreinte, comme c'est le cas chez le Faucon pèlerin[139]. Le sommet des falaises est généralement l'emplacement préféré, sans doute pour mieux se protéger des prédateurs[140]. Une Buse variable a été observée nichant dans un bâtiment, en l'occurrence une maison isolée à moitié en ruines, dans le sud-est de l'Espagne[141].
Quand les prédateurs sont suffisamment rares, les Buses variables peuvent nicher à même le sol : en Finlande, des nids ont été observés dans les algues sur une plage, parmi des dunes de sable et sous une touffe d'ajoncs[135].
Un couple bâtit généralement plusieurs nids, souvent trois, situés dans un rayon de 200 m[142]. La raison n'est pas claire ; peut-être s'agit-il de marquer son territoire. Ces nids sont tous décorés avec de la végétation fraîche : branches des arbres alentour, fougères, joncs, bruyère ou mousse. Ces végétaux peuvent être insérés dans la structure du nid, mais aussi simplement posés sur le rebord, au risque de tomber. Ils n'ont donc pas de rôle architectural. Peut-être s'agit-il de rendre la coupe interne plus confortable pour les oisillons, mais des brindilles de houx ont déjà été observées dans des nids. Une hypothèse est qu'il s'agisse d'un signal « honnête » sur l'occupation du territoire et sur la vigueur des propriétaires du nid[143], comme c'est le cas chez le Milan noir[144].
La construction du nid peut démarrer dès la fin de l'hiver, mais se situe le plus souvent entre la mi-février et la mi-mars au Royaume-Uni. La construction à proprement parler est mal connue. Elle est rapide : le nid est bâti en quelques jours. Sa taille est très variable et peut dépasser le mètre de diamètre comme d'épaisseur. Une étude portant sur 104 nids identifiés dans le comté d'Avon montre que la plupart mesurent 50 à 70 cm de diamètre[145]. Le nid est consolidé et décoré pendant toute la période de reproduction[146]. Un nid utilisé treize années de suite a été observé à New Forest, en Angleterre ; il mesurait 1,5 m de diamètre pour 70 cm de hauteur.
Incubation
La période précise de ponte est mal connue, car les Buses variables sont promptes à abandonner le nid, si un humain s'approche trop[147]. Dans une étude danoise, 40 % se sont envolées du nid avant que l'intrus approche à 100 m et 60 % à 50 m, seules 15 % restant au nid quand la personne atteint leur arbre[148]. En outre, les pontes de remplacement sont très rares[149].
En Europe, les pontes se situent entre la fin mars pour les latitudes les plus au sud et la fin mai pour celles les plus au nord[150], mais tendent à devenir plus précoces avec le changement climatique : en Finlande, la date moyenne de ponte a avancé de dix jours entre 1979 et 2004[151]. Une ponte classique compte deux à trois œufs, mais il n'est pas rare de voir un seul œuf et, de temps en temps, des pontes de quatre œufs. Des pontes record de cinq, voire six œufs ont été observées. Les œufs de Buse variable sont ellipsoïdaux et mesurent approximativement 55 mm sur le grand axe pour 44 mm le petit. Ils sont de couleur blanc mat, tacheté de rouge-brun. Ils pèsent environ 60 g[152].
L'incubation démarre dès la ponte du premier œuf. Elle est assurée par la femelle, relayée pour de brèves périodes par le mâle, qui assure son ravitaillement. Elle dure entre 33 et 38 jours.
 Ponte collectée à Allondrelle-la-Malmaison, en Meurthe-et-Moselle, France (MHNT).
Ponte collectée à Allondrelle-la-Malmaison, en Meurthe-et-Moselle, France (MHNT). Œufs de Buteo buteo rotschildi (MNHT).
Œufs de Buteo buteo rotschildi (MNHT). Œufs de Buteo buteo vulpinus (MNHT).
Œufs de Buteo buteo vulpinus (MNHT).
Jeunes au nid

Les œufs d'un même nid éclosent les uns après les autres, à un à trois jours d'intervalle. Une nichée peut donc comprendre des oisillons à un stade de développement assez différent[152].
À la naissance, les jeunes sont couverts d'un duvet blanc et pèsent 40 à 50 g. La femelle doit les couvrir pour assurer leur régulation thermique pendant environ une semaine. Ils passent leur temps à dormir entre deux nourrissages. Après huit jours, le premier duvet est remplacé par un autre plus épais. Après un peu moins de deux semaines, les étuis des futures primaires et rectrices apparaissent. Ils commencent à s'ouvrir quelques jours plus tard. Parallèlement, les plumes du manteau et les scapulaires remplacent le duvet, respectivement sur le dos et les épaules. Pendant ces deux premières semaines, la femelle assure l'hygiène du nid, qu'elle ne quitte que rarement. Elle est ravitaillée par le mâle qui, pour se nourrir, mange souvent la tête des proies avant de les apporter[153], car la cervelle est riche en graisses.
À l'âge de trois semaines, les jeunes voient leurs flancs se garnir à leur tour de plumes. À ce stade, leur masse a été multipliée par dix. Ils sont capables d'agiter les ailes et d'ingurgiter de animaux de petite taille, comme des musaraignes ou de petits campagnols. Ils produisent des pelotes constituées de fourrure. À la quatrième semaine, ils commencent à utiliser leurs serres pour démembrer les proies qu'on leur apporte. À un mois, la jeune buse est quasi entièrement emplumée, sauf la tête, qui reste couverte de duvet. À ce stade, la demande en nourriture a crû de manière très importante, forçant le mâle à chasser jusqu'à 16 heures et demie par jour dans le Devon, soit quasiment la durée entière du jour en été[38].
La croissance rapide des jeunes, couplée à leur éclosion asynchrone, entraîne des disparités allant jusqu'à 90 g dans leurs masses respectives, ce qui n'est pas anodin quand ils se disputent la nourriture apportée par leurs parents[154]. À l'âge de 20 jours, la différence entre les sexes commence à apparaître : une femelle de cet âge pèse autant qu'un mâle de 24 jours[155]. Outre l'âge et le sexe, l'agressivité individuelle entre en jeu pour déterminer qui sera nourri en premier. À partir d'un certain âge, le premier avale tout rond la proie apportée, ne laissant rien aux autres. Si la nourriture vient à manquer, le plus vieux des juvéniles peut attaquer le plus faible, habituellement le plus jeune, un comportement appelé le caïnisme. L'individu faible peut succomber à ces attaques et, souvent, finir par être mangé[154].
Les jeunes au nid sont protégés par leur mère, mais l'un d'entre eux peut être emporté comme proie par un rapace plus gros. Il est donc arrivé, rarement, mais à plusieurs reprises, qu'une buse juvénile se retrouve dans un autre nid et soit adoptée par une autre espèce. Des adoptions par des Pygargues à queue blanche ont été rapportées en Hongrie[156],[157], en Tchéquie[158] et en Allemagne[159], ainsi que par des Aigles pomarins en Slovaquie[160]. Le cas allemand a concerné un nid surveillé par piège photographique, ce qui a permis de confirmer le déroulé des événements. En Suisse, une aire d'Autour des palombes a été trouvée contenant une jeune Buse variable ainsi qu'un œuf soit de buse, soit d'autour. Les circonstances ayant conduit à cette situation sont inconnues, mais un nid construit simultanément par des autours et par des buses a déjà été recensé dans la littérature : les deux espèces apportaient des matériaux tour à tour, avant que le nid ne soit finalement revendiqué par les autours[161].
Jeunes à l'envol

Une fois que les jeunes sont suffisamment grands et que leurs ailes sont suffisamment robustes pour ralentir une chute éventuelle, ils commencent à sortir du nid pour se percher sur une branche voisine. Ils sont alors très proches de l'envol. Dans une étude menée à New Forest, les premiers vols se sont produits quand les jeunes étaient âgés de 49 à 60 jours, contre 43 à 54 jours dans une étude dans le Dorset[162]. Malgré la différence d'âge au sein de la nichée, tous les jeunes s'envolent le même jour[163]. Les plumes de vol ne sont pas encore totalement développées et continuent de croître dans leur étui jusqu'à 65 jours environ, après quoi leurs vols sont de plus en plus longs, vont de plus en plus et retournent de moins en moins au nid. Parallèlement, les parents continuent de les nourrir : au début, ils apportent toujours les proies au nid, puis les jeunes viennent à leur rencontre.
Dispersion
Le suivi de jeunes buses équipées de radio-émetteurs montre une certaine variabilité de comportement : certaines se dispersent un mois à peine après avoir quitté le nid, mais d'autres explorent les alentours du territoire de leurs parents, rentrant parfois au nid le lendemain[164],[76],[165]. Dans une étude dans le Dorset, 56 % des 77 buses suivies ont quitté définitivement le nid entre juillet et décembre, à un âge moyen de 107 jours[165], souvent pour rejoindre des regroupements informels de buses avec lesquelles elles se nourrissent. 39 % continuent pendant l'hiver à chercher leurs proies à moins de 1 km du territoire parental, avant de se disperser au printemps, vers le mois de mars[165].
À la saison de reproduction suivante, une partie des jeunes buses ayant quitté le territoire parental à l'automne y reviennent : on parle de philopatrie[166]. Ces aller-retours se poursuivent parfois jusqu'à leur troisième année, c'est-à-dire à un moment où elles sont elles-mêmes prêtes à se reproduire.
La dispersion des buses n'est pas liée à un manque de nourriture : les jeunes continuent de quémander et de recevoir des proies de leurs parents pendant leur premier hiver. Rien ne montre non plus que les parents mettent leurs jeunes dehors. Il semble que les jeunes partent d'eux-mêmes, motivés par la compétition avec les autres jeunes de la nichée et par le type de couvert végétal alentour, indicateur de l'abondance en proies[167].
Dans l'étude du Dorset, un tiers des jeunes suivis s'est dispersé à plus de 15 km de son territoire natal et une petite minorité a dépassé les 100 km de distance. La distance médiane a été de 13 km[166]. Les femelles se sont dispersées plus loin que les mâles, comme c'est le cas dans beaucoup d'espèces : il s'agit sans doute d'éviter la consanguinité[166].
Succès reproductif
En règle générale, les Buses variables ont une nichée par an. Un cas de double nichée a toutefois été observée à Fuerteventura, dans les Canaries : après une ponte assez précoce dans l'année, un seul jeune a survécu. Quand il a été âgé de quatre semaines environ, sa mère a pondu de nouveau, en poussant son jeune vers l'extérieur du nid, pour faire de la place. Ce jeune s'est envolé vers l'âge de neuf mois et n'a plus été revu sur le territoire. Quant à la deuxième ponte, les œufs n'ont pas éclos et ont été abandonnés[168].
Le succès reproductif de la Buse variable a été mesuré au centre de la Pologne sur une période de dix ans. Il en ressort une moyenne de 1,67 jeune à l'envol par territoire actif, chiffre qui se décompose en 1,78 jeune à l'envol par couple reproducteur et 2,34 jeunes à l'envol par couple ayant mené au moins un jeune à l'envol[132]. Dans le Dorset, sur 239 œufs recensés sur une période de sept ans, 5 % n'éclosent jamais et 13 % sont morts en bas âge[169].
Parmi les facteurs du succès reproductif, la nourriture disponible figure en bonne position. En Norvège, le nombre de jeunes à l'envol a été estimé à 2,6 par nid les années à campagnols contre 0,3 seulement les années sans[63]. Au centre de la Pologne, les grandes nichées ne se produisent que les années où les rongeurs sont abondants[132],[170]. L'abondance en lapins peut également être cruciale. Ainsi, un tiers des nichées ont échoué dans le Devon immédiatement après l'introduction de la myxomatose[74], contre un dixième dans les années 1960 et quasiment zéro dans les années 1990[171].
Les conditions climatiques sont également un facteur important : au pays de Galles, le taux de succès est passé de 91 % à 86 % en 1979, après un hiver rude[82]. En Allemagne, une étude a suivi des territoires sur une décennie, en notant les moyennes annuelles de température et de précipitations, ainsi qu'un indice d'abondance des campagnols. L'échec total de la nichée était corrélé aux pluies abondantes en mai, tandis que le nombre de jeunes à l'envol était corrélé aux pluies d'avril et mai. En revanche, la pluie en juin n'avait pas d'impact, à une période où les jeunes ont développé un plumage étanche[172].
La compétition avec les autres buses peut entrer en ligne de compte. Une étude menée dans le Somerset suggère que la productivité de la Buse variable diminue quand la densité de nids devient trop importante. Au début de la période suivie, en 1988, la zone comptait 19 couples, avec une distance moyenne de 1 km entre les nids. Le taux de succès était de 1,89 jeune par couple. En 2007, la même zone accueillait 92 nids, espacés en moyenne de 600 m, pour 0,87 jeune par couple[40].
La perturbation humaine joue également. Une vaste étude menée de 1950 à 1995 dans les Midlands de l'Ouest, en Angleterre, montre un taux d'échec de 15 % : 2,5 % des œufs ont été volés par des collectionneurs et 5 % des jeunes ont disparu (sic)[173]. Une analyse des archives du British Trust for Ornithology de 1937 à 1969 révèle que la « prédation humaine » est la première cause d'échec[174]. Une étude dans le Speyside, en Écosse, estime que 35 % des nids sont perturbés délibérément chaque année[175]. En Pologne, ce taux est évalué à 30 %[132]. La perturbation involontaire, par exemple par des promeneurs ou par des ornithologues amateurs, peut également être un facteur, de plus en plus important au fur et à mesure que la population des buses augmente[176].
Survie
Longévité
.jpg.webp)
La plus grande longévité enregistrée chez une Buse variable baguée européenne était, en 2017, de 28 ans et 9 mois, suivi par une donnée de 26 ans et 10 mois, dans les deux cas pour des oiseaux trouvés morts au Danemark[177]. Au pays de Galles, un oiseau âgé de 30 ans et 5 mois a été retrouvé en 2016, en vie, mais malade[178], à 10 km de l'endroit où il avait été bagué au nid[179].
L'espérance de vie des Buses variables est bien différente. L'analyse des reprises de bagues néerlandaises jusqu'en 1994 a ainsi montré que 47 % des oiseaux survivent leur première année, puis 77 % chacune des années suivantes, soit un âge médian d'un an[180]. Dans le sud de l'Angleterre, 146 jeunes buses au nid ont été équipées de balises radio entre 1990 à 1994 et suivies jusqu'à ce que les batteries cessent de fonctionner, quatre ans plus tard. Il en ressort que le taux de survie en juin de l'année suivante est de 73 % si l'on considère comme morts seulement les oiseaux retrouvés morts avec une balise en fonctionnement ou 66 % si l'on prend en compte tous les oiseaux dont la balise n'émet plus. Les mois les plus critiques sont les quatre premiers après le départ du nid : 5 à 8 % d'entre eux meurent chaque mois de juillet à octobre. Inversement, le taux de survie se situe entre 91 et 97 % la deuxième année, puis tombe à 82-86 % la troisième. Près de la moitié des oiseaux survit donc trois ans[181].
Morbidité
Comme la très grande majorité des oiseaux de proie sauvages, la Buse variable est communément porteuse de parasites, à la fois sur son plumage (ectoparasites) et dans son organisme (endoparasites). Dans une étude menée à Berlin et dans le Land de Brandebourg sur 84 rapaces diurnes et nocturnes, dont 32 buses, 97,6 % présentaient des acariens du plumage (espèces de la famille des Epidermoptidae) et des mouches plates (espèces de la famille des Hippoboscidae). 26,9 % des espèces examinées étaient porteuses de parasites sanguins (espèces des genres Leucocytozoon et Haemoproteus), avec une prévalence particulière chez les Buses variables (44,8 %)[182]. Dans une autre étude menée en Grande-Bretagne sur 379 rapaces, dont 77 buses, un examen visuel a trouvé des parasites intestinaux (nématodes) dans 20 % des cas, sans différence significative entre les espèces. Sur cet échantillon, les buses en mauvaise condition, avec le moins de réserves de graisses, étaient les plus susceptibles de porter des parasites[183].
La Buse variable est susceptible de contracter la tuberculose aviaire, une maladie infectieuse et contagieuse causée par la bactérie Mycobacterium avium. Une étude menée sur 11 000 oiseaux aux Pays-Bas entre 1975 et 1985 a montré que moins de 1 % d'entre eux étaient atteints, mais avec une incidence plus importante chez les rapaces, en particulier la buse (2,2 %). Elle peut également porter la grippe aviaire (H5N1), comme l'a montré un relevé effectué en mars 2006 dans la Dombes, une zone humide française. Centré sur les oiseaux d'eau, en particulier le Cygne tuberculé, il a néanmoins permis de collecter 40 cadavres de buses, dont une s'est avérée porter le virus[184]. Une étude allemande, ciblant cette fois les oiseaux de proie, a mis en évidence 3,1 % de cas positifs sur 385 cadavres de buse testés[185].
Mortalité

Une Buse variable adulte n'est pas sans prédateurs : elle peut être tuée ou grièvement blessée notamment par l'Autour des palombes, le Pygargue à queue blanche, le Hibou grand-duc ou encore le Faucon pèlerin[186]. Ainsi, un couple de Faucons pèlerins nichant dans une église au centre d'Exeter, dans le Devon a été observé menant 470 attaques contre des Buses variables entre 2012 et 2017, les forçant à se poser en catastrophe dans 70 cas. Neuf cadavres de Buses variables ont été retrouvées à proximité, probablement des victimes de ces attaques, souvent opérées en duo : le mâle attaque en premier la victime, qui se renverse en arrière pour se défendre avec ses serres. Dès que la buse se rétablit, la femelle pèlerin l'attaque à la tête, dans le dos ou à l'aile. Pourtant, les buses survolent Exeter à haute altitude, à 60 m ou plus. Inversement, le couple de pèlerins ne s'en prend pas aux Grands Cormorans ou aux Aigrettes garzettes qui remontent le fleuve Exe en passant près de leur aire et ses accrochages avec les Laridés et Corvidés restent sporadiques. Toute l'agressivité du couple semblent concentrée contre les Buses variables, sans qu'on en connaisse la raison[187],[188].
La Buse variable peut se sustenter sur une large variété de proies, dont certaines, comme les vers de terre, ne nourriraient pas d'autres rapaces[189]. Malgré tout, elle peut mourir de faim, si les conditions climatiques sont particulièrement mauvaises et l'empêchent à la fois de chasser et de partir chercher ailleurs sa nourriture. Ainsi, un tiers de la population adulte est morte dans le sud-ouest de l'Angleterre après un hiver particulièrement enneigé en 1963[190].
Plusieurs infrastructures humaines peuvent poser problème à la Buse variable. Elle peut entrer en collision avec des pylônes électriques. Dans deux études menées dans le centre de l'Espagne, elle est l'oiseau le plus concerné par les électrocutions[191],[192]. Le même constat a été fait en Hongrie[193].
Les éoliennes sont une cause de mortalité nouvelle pour les rapaces : elles sont souvent installées à des endroits très ventés utilisés par les oiseaux voiliers. Une étude menée à Campo de Gibraltar, au sud de l'Espagne, montre que les Buses variables parviennent à s'élever en cercles le long des pentes, mais sans trop s'approcher des éoliennes, contrairement par exemple aux Vautours fauves[194]. Malgré tout, des morts par collision sont parfois enregistrées[195],[196]

Les collisions avec les voitures ou d'autres véhicules surviennent souvent en situation de charognage, quand la Buse variable mange une proie déjà tuée par la circulation. La situation est d'autant plus fréquente que les buses perchent volontiers sur les poteaux téléphoniques ou les piquets de clôture en bord de route ou de voie ferrée[197]. Dans une étude menée dans le Dorset, six Buses variables ont été percutées par un train et deux par des voitures, sur un total de cinquante retrouvées mortes[181].
Au sommet de la chaîne alimentaire, les rapaces sont particulièrement susceptibles d'accumuler des métaux lourds dans leur organisme. L'analyse des cadavres de Buses variables déposés à un institut vétérinaire des Pays-Bas en 1992 a montré que la moitié d'entre eux présentaient des taux élevés en cadmium, cuivre, plomb et manganèse, certes non fatals, mais reflétant la contamination de l'environnement. L'étude a conclu que la Buse variable pouvait servir de bio-indicateur[198]. Une étude belge plus récente montre même qu'il est possible de mesurer efficacement les concentrations en polluants organiques persistants et en métaux lourds dans une simple plume de Buse variable[199].
Si la Buse variable a été peu concernée par le DDT par rapport à d'autres rapaces, elle l'a été par le carbofuran, un insecticide utilisé sous forme de granules, déposés notamment dans les lignes de semis des betteraves fourragères et à sucre : les granules dissous par la pluie étaient absorbés par les vers de terre, à leur tour mangés par les buses[200]. Interdit en 2008 par l'Union européenne, le cabofuran a été impliqué dans 50 % des cas confirmés d'empoisonnement de rapaces au Royaume-Uni au début des années 2000[201] et continue d'être présent, dix ans plus tard, dans les foies de Buses variables en Pologne[202].
Friandes de gibier non ramassé par les chasseurs, les Buses variables sont également susceptibles d'empoisonnement indirect au plomb contenu dans certaines munitions. L'une d'entre elles a par exemple été trouvée près de Parme, au nord de l'Italie : apportée à un centre de sauvegarde des rapaces, elle est morte quelques jours plus tard, probablement d'empoisonnement aigu, en raison de l'ingestion d'une dizaine de plombs[203].
Répartition et habitat
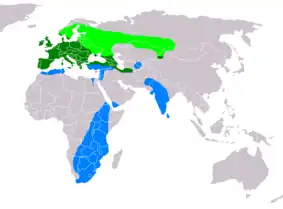
- aire de nidification
- aire d'habitat permanent
- aire d'hivernage
L'aire de nidification de la Buse variable recouvre la plus grande partie de l'Eurasie[204]. Elle s'étend des côtes atlantiques du Portugal, de l'Espagne, de la France, des îles Britanniques et de la Scandinavie jusqu'au nord de la Turquie, à l'Azerbaïdjan et à la mer Caspienne au sud-est. Vers le nord-est, elle inclut le Kazakhstan et la Russie, jusqu'au Kirghizstan, où sa distribution touche celle de la Buse du Japon (parfois considérée comme une sous-espèce) en Mongolie occidentale. L'aire d'hivernage recouvre la moitié sud de l'Afrique et remonte jusqu'à l'Afrique de l'Est.
Selon Birdlife international (2020), ses effectifs se situent entre 882 000 et 1,23 million de couples en Europe, zone qui constitue 75 % de son aire de répartition, ce qui permet d'estimer entre 2,03 et 3,46 millions le nombre de couples en tout[205]. En Europe, la Buse variable est le rapace le plus commun avec le Faucon crécerelle[206]. Elle pourrait être le rapace de l'ordre des Accipitriformes le plus nombreux au monde, devant l'Épervier d'Europe, dont la population est estimée entre 2,3 et 3,3 millions d'individus[207].
L'importance de ses effectifs et sa tendance en hausse entraînent son classement en espèce de préoccupation mineure par l'UICN. Le tableau ci-dessous fournit les effectifs et leur tendance dans tous les pays européens où la Buse variable est documentée quantitativement, sur la base des données de BirdLife International en 2015. La qualité des données est décrite comme suit :
- bonne : bon état de connaissance — donnée quantitative fiable disponible pour l'ensemble du pays et sur toute la période ;
- moyenne : état de connaissance moyen — données à disposition médiocres, périmées ou incomplètes ;
- mauvaise : état de connaissance médiocre – peu connu, sans donnée quantitative disponible.
| Pays/Territoire | Nombre de couples | Tendance depuis 2000 | Qualité des données |
|---|---|---|---|
| Albanie | 200-800 | -20–30 % | moyenne |
| Allemagne | 80 000-135 000 | -4–15% | bonne |
| Andorre | 20-30 | ? | moyenne |
| Arménie | 100-150 | ? | moyenne |
| Autriche | 12 000-19 000 | stable | moyenne |
| Azerbaïdjan | 300-1 000 | ? | mauvaise |
| Belgique | 7 900-10 200 | stable | moyenne |
| Biélorussie | 18 000-24 000 | stable | moyenne |
| Bosnie-Herzégovine | 5 000-8 000 | ? | mauvaise |
| Bulgarie | 2 400-4 200 | stable | moyenne |
| Croatie | 8 000-9 000 | ? | mauvaise |
| Danemark | 5 000 | stable | moyenne |
| Espagne | 31 010-31 400 | -8 % | bonne |
| Espagne : îles Canaries | 250-1 000 | en hausse | mauvaise |
| Estonie | 6 000-7 000 | stable (0–10 %) | moyenne |
| Finlande | 4 000-4 200 | -21–25 % | bonne |
| France | 130 000 | -20–22% | bonne |
| Géorgie | 900-1 600 | stable | moyenne |
| Grèce | 4 000-8 000 | stable | moyenne |
| Hongrie | 15 000-30 000 | stable | moyenne |
| Irlande | 1 500 | +5669 % | moyenne |
| Italie | 4 000-8 000 | +30–40 % | mauvaise |
| Kosovo | 300-400 | ? | moyenne |
| Lettonie | 34 360-71 160 | -2–50 % | moyenne |
| Liechtenstein | 20-30 | stable | moyenne |
| Lituanie | 6 000-12 000 | stable | moyenne |
| Luxembourg | 800–1 200 | fluctue (0-20 %) | moyenne |
| Macédoine du Nord | 400-1 200 | ? | mauvaise |
| Moldavie | 200-300 | stable | bonne |
| Monténégro | 400-600 | ? | moyenne |
| Norvège | 1 000-2 000 | +0-10 % | mauvaise |
| Pays-Bas | 9 551–11 939 | +13–26 % | moyenne |
| Pologne | 51 000-55 000 | -10–30 % | bonne |
| Portugal | 5 000-10 000 | ? | moyenne |
| Portugal : Açores | 508 | ? | bonne |
| Portugal : Madère | 100–500 | stable | moyenne |
| Roumanie | 20 000-50 000 | ? | mauvaise |
| Royaume-Uni | 57 000–79 000 | +146 % | moyenne |
| Russie | 200 000-500 000 | stable | moyenne |
| Serbie | 3 800-4 700 | +1–9 % | moyenne |
| Slovaquie | 8 000-15 000 | stable | moyenne |
| Slovénie | 5 000-8 000 | stable (0-10 %) | mauvaise |
| Suède | 17 000-45 000 | stable | moyenne |
| Suisse | 20 000-25 000 | stable | moyenne |
| Tchéquie | (11 000-14 000) | stable | moyenne |
| Turquie | (4 000-6 000) | -0–19 % | mauvaise |
| Ukraine | 22 500-32 500 | fluctue | moyenne |
| Europe des 27 | 528 000-768 000 | en baisse | |
| Europe | 814 000-1 390 000 | stable |
Habitat
La Buse variable se trouve jusqu'à 5 000 mètres d'altitude au Kazakhstan, au Tibet et en Mongolie, où elle est remplacée plus en altitude par la Buse de Chine[209]. Cette limite altitudinale est très variable selon la région : la Buse variable ne dépasse guère les 380 mètres d'altitude en Écosse[175] et les 870 mètres en Italie[45]. En France, ses effectifs diminuent à partir de 800 mètres d'altitude, même si elle peut nicher jusqu'à 1 600 mètres[210].
Elle fréquente les milieux boisés pour nicher et les milieux ouverts pour chasser. Elle ne semble pas avoir de milieu préféré, mais rechercher avant tout leur diversité, probablement parce qu'elle offre plus d'opportunités de chasse[211]. Elle semble éviter les éléments de paysage conçus par l'homme, comme les routes, les immeubles ou les vergers. Un nid de Buse variable a néanmoins été trouvé au beau milieu d'un terrain de paintball ; le couple a mené ses jeunes à l'envol et a conservé son nid au moins une année supplémentaire[212]. La Buse variable se rapproche également des villes : certains individus ont été vus en banlieue, cherchant des vers de terre sur des terrains de sport ou perchant sur des cages de football. Néanmoins, elle niche très rarement sur des structures artificielles et ne devrait donc pas se retrouver au cœur des villes, comme le fait par exemple le Faucon pèlerin[213].
Migration
.jpg.webp)
La sous-espèce nominale de la Buse variable est un migrateur partiel[206]. Les populations d'Europe du Sud et centrale sont sédentaires, tandis que celles d'Europe du Nord sont plutôt migratrices, plutôt à courte distance : les buses norvégiennes sont reprises au Benelux et en France et les buses suédoises du Danemark jusqu'au détroit de Gibraltar, tandis que les buses finlandaises sont contrôlées partout en Europe et en Afrique subsaharienne[206]. En Allemagne, dans les îles Britanniques et en France, la population est majoritairement sédentaire[214].
La sous-espèce Buteo buteo vulpinus, la Buse des steppes ou Buse de Russie, est migratrice longue distance. Elle se reproduit au sud de la Scandinavie, en Russie européenne et en Asie centrale, au sud des monts Caucase. Elle parcourt jusqu'à 13 000 km pour rejoindre ses quartiers d'hiver, en Afrique subsaharienne et au sud-ouest de l'Asie. Une concentration importante se situe notamment dans la province du Cap, en Afrique du sud, où elle est un oiseau fréquent à commun, avec un pic de présence entre décembre et février[215].
Dans le cadre de ses travaux sur l'évitement des collisions entre oiseaux et aéronefs, un groupe de chercheurs a étudié l'altitude et le comportement de vol de 447 Buses variables pendant leur période de reproduction au sud-est des Pays-Bas. Il en ressort que leur altitude maximale se situe entre 208 et 1 592 m, pour une moyenne de 665 m. 81 % de leur temps est passé à planer, 4 % à battre des ailes et 5 % à chercher de la nourriture[216]. Une étude israélienne de la Buse des steppes en migration montre que 85 % du temps de l'oiseau est passé en vol plané ou à voile (en utilisant les vents ascendants), à une altitude moyenne de 500 m. En planant, il se déplace dans l'air à une vitesse moyenne de 59 km/h. Il s'élève dans les courants ascendants à 8,6 km/h et descend à 6,1 km/h. Il peut donc voyager à 30 à 40 km/h suivant la force et la direction du vent[217]. Une autre étude réalisée sur quinze Buses variables suédoises suivies par satellite montre que les oiseaux passent de quatre à 41 jours en migration, à des vitesses moyennes variant entre 16 et 133 km/jour sur l'ensemble du trajet (33 à 133 km/jour en excluant les escales)[218].
L'importance cruciale des courants thermiques pour les longs déplacements signifie que les grandes étendues d'eau sont des obstacles majeurs pour la Buse variable. Elle se concentre donc quelques hauts lieux de migration, qui offrent la route la plus courte pour traverser l'eau. Falsterbo, situé à l'extrême sud de la Scanie, voit passer 12 500 Buses variables en moyenne chaque année depuis 1973, avec un pic à 32 700 en 2017[206]. La Buse variable (sous-espèce nominale ou Buse des steppes) est l'un des rapaces les plus souvent comptés au Bosphore et au détroit des Dardanelles[219]. Inversement, très peu de Buses variables s'attaquent à une traversée par le milieu de la mer Méditerranée : le maximum annuel a été de sept à Malte pendant la migration d'automne[220] et de six au-dessus du canal de Sicile entre la Tunisie et l'Italie[221]. Pendant la migration d'automne, la Buse des steppes rejoint l'Afrique en passant principalement par le détroit de Bab-el-Mandeb, entre le Yémen et Djibouti. En sens inverse, pour la migration de printemps, elle revient par le canal de Suez. En 1986, elle représentait 53 % des effectifs comptés en migration à Eilat, dans le sud d'Israël, soit 465 827 individus décomptés entre la mi-février et la première semaine de juin[222].
Les montagnes constituent également des obstacles importants, obligeant les rapaces à voler tellement haut qu'ils peuvent échapper aux observateurs humains et n'être repérés que par radar. En France, le premier site pour l'espèce est le défilé de l'Écluse, qui sépare l'Ain et la Haute-Savoie, avec 18 000 migrateurs en moyenne chaque automne et un pic à 33 000 oiseaux en 2012[214].
La Buse variable et l'être humain
La Buse variable dans la culture
.jpg.webp)
La Buse variable fait partie des oiseaux dont les ossements ont été retrouvés dans des grottes du Néolithique moyen, notamment à Gibraltar, portant des traces d'exploitation non-alimentaire par l'Homme de Néandertal, possiblement comme ornements (plumes, griffes)[223].
Sous l'Antiquité grecque, la Buse variable est probablement l'oiseau appelé τρίoρχις / tríorkhis, littéralement « à trois testicules », une légende qui perdurera jusqu'à l'époque moderne avec le nom Buteo triorchis, utilisé notamment par Christopher Merret (1614-1695), auteur de la première liste d'oiseaux britanniques. Selon l'ornithologue anglais Francis Willughby (1635-1682), le scientifique italien Ulisse Aldrovandi (1522-1605) aurait disséqué une buse mâle et trouvé trois testicules. Willughby lui-même déclare avoir cherché, en vain, le troisième testicule[224],[225].
Aristote indique que le tríorkhis a la même taille qu'un iktinos (probablement un milan), qu'il est résident toute l'année en Grèce et qu'il est carnivore et non granivore[226]. Il se nourrit de batraciens et de serpents[227] et il est le plus fort parmi les oiseaux du type hierax, nom donné par Aristote à tous les rapaces diurnes plus petits que les aigles et les vautours[228]. Chez Aristophane, son nom est utilisé pour un personnage de débauché[229]. Sémonide d'Amorgos décrit également un erōdios (Héron cendré) volant une anguille à un triorkhos en train de la manger[230]. Chez les Romains, Pline l'Ancien nomme l'oiseau à la fois triorchis[231] et buteo[232]. Selon lui, cet oiseau est l'ennemi du Gypaète barbu et des milans[231]. Il est considéré comme un mets délicat dans les Baléares[233]. Festus Grammaticus le décrit comme volant la proie des autres rapaces[234]. Élien en fait un oiseau sacré pour Artémis[235] et Antoninus Liberalis précise que Mounichos, roi des Molosses, s'est métamorphosé en cet oiseau[236],[237].
Les rapaces sont étroitement liés à l'homme au travers de la fauconnerie. L'origine de cette pratique est sujette à débats, mais il semble que son berceau se situe en Mésopotamie ou en Asie intérieure, il y a au moins 5 000 ans[238]. À cet égard, la Buse variable est un oiseau assez facile à dresser, car elle s'habitue très bien à l'homme. Adepte du moindre effort, elle peut préférer le morceau de viande placé sur le gant du fauconnier à une proie vivante. Le Livre de saint Alban, publié en 1486, contient une liste de rangs nobiliaires et d'oiseaux de proie considérés comme dignes d'eux ; il la mentionne pour un baron. En réalité, cette liste reflète moins les véritables pratiques de la fauconnerie médiévale que l'habitude de l'époque de tout classer par ordre de noblesse[239].
De fait, la Buse variable est considérée comme un oiseau « paresseux » et peu populaire auprès des fauconniers[75] : elle est tout à fait susceptible d'aller chercher des vers de terre dans le champ voisin plutôt que de poursuivre la proie désignée ou de retourner au gant[240]. En pratique, elle n'est pas employée au Moyen Âge. Au contraire, la buse est une image à connotation négative dans la littérature de l'époque, par opposition aux oiseaux nobles : l'Autour des palombes, l'Épervier d'Europe et les faucons. On trouve ainsi fréquemment le proverbe L’en ne puet faire de buisart espervier (« on ne saurait faire d'une buse un épervier »)[241]. À l'époque contemporaine, Edward Michell l'exclut délibérément de son traité L'Art et la pratique de la fauconnerie (1900)[242]. Dans L'Entraînement des oiseaux de proie (2012) Jemima Parry-Jones écrit : « Si vous voulez faire voler un oiseau, sans forcément réussir à chasser avec, la Buse variable est faite pour vous – un oiseau qui s'accommode volontiers d'échouer à attraper à que ce soit, surtout s'il a une « andouille » d'humain pour le nourrir »[243].
L'essor des buses dans les courants thermiques a inspiré le poète Martin Armstrong pour son poème « Les buses » (1921)[244]. Le pianiste Olivier Messiaen a consacré à cet oiseau une pièce, qui en porte le nom, de son Catalogue d'oiseaux[245].
La Buse variable a été représentée sur près d'une cinquantaine de timbres émis par 39 administrations postales différentes : Alderney (2008), Autriche (1953), Açores (1988), Belgique (2010), République du Congo (1993), Corée du Nord (1992), Danemark (2004), Espagne (1998), Gambie (2018), Grande-Bretagne (2019), Guernesey (2021), Guinée (2002, 2014 et 2015), Guinée-Bissau (2001, 2006, 2009 et 2011), Hongrie (1983 et 2012), Irlande (2010), Jordanie (2014), Kosovo (2019), Libye (2002), Liechtenstein (1939), Maldives (2013, 2015 et 2016), Mongolie (1970 et 1985), Mozambique (2007 et 2013), Pays-Bas (2021), Palestine (1998), Pays-Bas caribéens (2021 et 2022), RDA (1965), RFA (1973), Roumanie (2007), Russie (URSS) (1965), Sao Tomé-et-Principe (2015), Serbie (2011), Sierra Leone (1998), îles Salomon (2014), Tadjikistan (2016 et 2018), Tchad (1998), Tchéquie (2013), Togo (2013), Turquie (2014) et Viêt Nam (1998)[246].
Statut juridique
Commune dans toute son aire de répartition et en progression, la Buse variable est déclarée « préoccupation mineure » par l'UICN. Elle figure à l'annexe II de la CITES, comme tous les Falconiformes[247].
En Grande-Bretagne
La Buse variable est depuis longtemps un oiseau très commun en Grande-Bretagne. On estime qu'au Mésolithique, l'île accueillait 65 000 couples reproducteurs[248]. Parmi les pères fondateurs des sciences britanniques, William Turner la décrit en 1544 comme visible toute l'année et Francis Willughby en 1678 comme très répandue. Thomas Pennant (1726-1798) la mentionne comme l'accipitridé le plus commun du pays et John Latham (1740-1837) en parle comme un oiseau connu de tous[249].

Après la Restauration Stuart de 1660, la production de grain britannique se développe et les sources de protéines animales se diversifient. La Buse variable devient de la « vermine volante », coupable comme les milans et le Grand Corbeau de s'en prendre aux oiseaux de basse-cour et aux jeunes animaux d'élevage. Des actes d'Henri VIII en 1532-1533 puis d'Élisabeth Ire en 1566 mettent à prix la tête de plusieurs animaux jugés coupables de s'en prendre au grain, au premier chef les corvidés. Ces textes sont interprétés largement par les conseils paroissiaux. Ainsi, les comptes des marguilliers de Tenterden, dans le Kent, montrent les récompenses financières versées sur présentation des cadavres d'oiseaux incriminés, souvent par lots de deux, trois ou quatre, ce qui suggère qu'il s'agit de nichées détruites[250]. Toutefois, il est difficile de savoir si ces données peuvent être extrapolées à l'ensemble du pays, d'autant que les termes employés sont confus et que des espèces différentes sont souvent prises l'une pour l'autre[249].
Les Buses variables subissent une deuxième vague de persécution avec les Inclosure Acts, à partir des années 1760 et 1770, qui enclosent des terres auparavant dévolues à l'usage collectif. Le perfectionnement du fusil de chasse à double canon puis l'introduction vers 1785 de la sous-espèce Phasianus colchicus torquatus, le Faisan à collier, aboutissent à la création de vastes de domaines de chasse. La loi sur la chasse (Game Act) de 1831 institutionnalise le rôle des gardes-chasse, dont la mission est de protéger le gibier de la concurrence à la fois des braconniers et des prédateurs naturels[251]. Le domaine de Glengarry, en Écosse, mentionne par exemple 385 buses tuées entre 1837 et 1840[249]. La population de Buses décline alors rapidement. Dans son relevé « sur la distribution des oiseaux en Grande-Bretagne pendant la saison de nidification », publié en 1865, A. G. More écrit que l'oiseau n'est « pas du tout commun et pratiquement exterminé dans les comtés du centre et de l'est de l'Angleterre ». Le constat est le même en Écosse. L'arrivée de la Première Guerre mondiale et la conscription massive des gardes-chasse débouche sur une lente remontée des effectifs[252],[253].
Après l'introduction de la myxomatose en 1953 et l'effondrement de la population des lapins de garenne, le British Trust for Ornithology commande en 1954 une étude sur la Buse variable qui fait état de 12 000 couples reproducteurs. Elle montre aussi une corrélation entre la distribution des Buses variables au Royaume-Uni et la densité de gardes-chasse[254]. La même année, les effets négatifs des pesticides organochlorés sur les populations de rapaces poussent à leur inclusion dans la loi sur la protection des oiseaux (Protection of Birds Act). La Buse variable fait partie des espèces nouvellement protégées. La proportion de buses baguées retrouvées tuées délibérément passe alors de 48 % à 14 %[252]. Malgré tout, la population continue à décroître, jusqu'à une fourchette de 8 000 à 10 000 couples dans les années 1970[255].
L'autorisation en 1990-1991 des cages-piège Larsen, qui permettent un piégeage plus sélectif des corvidés, ainsi que la prise de position des organisations professionnelles de gardes-chasse entraînent néanmoins une évolution des pratiques et une diminution de la persécution des rapaces[256]. Il s'ensuit des augmentations spectaculaires des populations de buses : une augmentation de 500 % par exemple dans le nord du Somerset entre 1982 et 2001. À cette date, les effectifs de Buses variables sont estimées entre 44 000 et 61 000 couples reproducteurs, ce qui fait de l'espèce le rapace le plus abondant de Grande-Bretagne, devant le Faucon crécerelle[257].
En Irlande
L'Irlande constitue la frange occidentale de l'aire de répartition de la Buse variable et présente des particularités en tant qu'île : elle n'abrite que cinq espèces de petits mammifères (contre treize en Grande-Bretagne) et aucune espèce de campagnols du genre Microtus, qui constituent ailleurs la base de l'alimentation d'un certain nombre de rapaces, dont la buse. Elle s'est donc tournée vers les lapins, mais aussi les rats et les oiseaux de taille moyenne, notamment les corvidés[57].
La Buse variable était le rapace le plus commun dans l'ensemble des îles Britanniques au début du XIXe siècle, avant de s'éteindre vers le milieu du siècle dans le sud de l'Irlande, probablement sous l'effet de la persécution humaine[254]. Elle a continué à se reproduire dans les comtés d'Antrim, Donegal, Down et Londonderry, avant de décliner à son tour dans le nord et de s'éteindre vers 1900.
Au XXe siècle, la reproduction est attestée de manière sporadique : un couple s'installe en Antrim en 1933 depuis l'Écosse, puis quatre en 1953 (dont trois sur l'île de Rathlin), avant que la myxomatose ne vienne décimer leur source de nourriture principale. Les buses s'installent de nouveau depuis l'Écosse dans les années 1960 : 27 couples dans le nord en 1977, puis une centaine en 1986[258]. Les effectifs s'étendent alors progressivement vers le sud et l'ouest de l'île, renforcés par des oiseaux venus du pays de Galles. Cette recolonisation se fait néanmoins assez lentement, notamment en raison d'empoisonnements, délibérés ou secondaires, pour contrôler les populations de renards et de corvidés. L'interdiction de la strychnine en 1991, puis de tous les poisons contre les renards en 2010, donne un coup d'accélérateur à la population de buses[259],[260].
En Europe continentale
.jpg.webp)
En Europe continentale également, les rapaces ont été historiquement victimes de la persécution humaine, plusieurs pays ayant mis leur tête à prix. Ainsi, aux Pays-Bas, de 1852 à 1857, 39 233 oiseaux de proie ont donné lieu à récompense financière, dont 1 756 oiseaux présentés comme des buses. En Autriche, 3 500 à 7 500 buses étaient tuées chaque année entre 1948 et 1968. À la fin des années 1970, quatorze pays européens protégeaient totalement les rapaces, seize en partie (en fonction de l'espèce, de la région ou de la saison) et un pas du tout (Malte). La Buse variable, rapace le plus commun en Europe, faisait partie des espèces les moins protégées[252].
En 1979, deux textes majeurs viennent faire des rapaces européens l'un des groupes d'espèces les mieux protégées au monde : la directive 79/409/CE, dite directive Oiseaux, et la Convention relative à la conservation de la vie sauvage et du milieu naturel de l'Europe, dite convention de Berne[261]. Elle reste malgré tout victime de la persécution humaine : sur 2 829 Buses variables et pattues passées par un centre de sauvegarde de la faune sauvage en Grèce de 1996 à 2005, 75 % des Buses variables et 70 % des Buses pattues avaient été abattues par tir[262].
En Espagne, la sous-espèce Buteo buteo insularum, initialement présente dans toutes les îles Canaries, s'est éteinte à Lanzarote dans les années 1960 et était proche de l'extinction dans les années 1970 à Fuerteventura, avec seulement 5 à 7 couples. Les mesures prises pour sa protection ont permis de passer à 15–20 couples en 1988, puis à 85–90 couples en 2004[263],[264]. Malgré tout, l'espèce est restée victime de tirs : elle représente la troisième espèce (8 % des cas) parmi les oiseaux apportés au centre de sauvegarde de Tafira entre 2003 et 2013 et celle qui présente la plus forte occurrence de tirs[265].
En France, la Buse variable est depuis longtemps un oiseau très commun. Buffon note ainsi dans son Histoire naturelle qu'elle est « un oiseau assez commun, assez connu pour n'avoir pas besoin d'une ample description »[4]. Comme tous les rapaces, elle bénéficie d'une protection totale sur le territoire français depuis l'arrêté ministériel du relatif aux oiseaux protégés sur l'ensemble du territoire, protection par ailleurs reconduite par l'arrêté du fixant la liste des oiseaux protégés sur l'ensemble du territoire et les modalités de leur protection. Il est donc interdit de la détruire, la mutiler, la capturer ou l'enlever, de la perturber intentionnellement ou de la naturaliser, ainsi que de détruire ou enlever les œufs et les nids, et de détruire, altérer ou dégrader son milieu. Qu'elle soit vivante ou morte, il est aussi interdit de la transporter, colporter, de l'utiliser, de la détenir, de la vendre ou de l'acheter[266].
.jpg.webp)
En Hongrie, la population de Buses variables résidentes est augmentée l'hiver d'oiseaux venant de Scandinavie et de la Baltique. Il est interdit depuis 1933 de chasser l'espèce, qui est également protégée depuis 1946. Aux alentours des années 2010, les chasseurs et agriculteurs hongrois ont demandé la levée de la protection légale, arguant que les effectifs de buses avaient explosé, au point de menacer ceux du petit gibier. Le débat sociétal qui s'en est suivi a poussé l'Association hongroise d’ornithologie et de conservation de la nature (MME) à déclarer la Buse variable « oiseau de l'année » en 2012. Les données du programme paneuropéen de suivi des oiseaux communs (PECBMS) ont par ailleurs montré que ses effectifs étaient restées stables entre 1992 et 2012[267].
La Buse variable a également été déclarée « oiseau de l'année » en 2021 par la Société tchèque d’ornithologie (ČSO). L'association explique que la « buse forestière », comme elle est appelée localement (káně lesní), est le rapace le plus commun en Tchéquie et que toute personne se promenant dans la nature a déjà eu l'occasion d'en apercevoir une. Il s'agit du troisième rapace ainsi distingué par la ČSO, après le Faucon crécerelle en 2002 et le Pygargue à queue blanche en 2006[268],[269].
Notes et références
- ↑ Alfred Ernout et Antoine Meillet, Dictionnaire étymologique de la langue latine, Klincksieck, (réimpr. 2001), p. 79.
- ↑ Michel Desfayes, Origine des noms des oiseaux et des mammifères d'Europe : y compris l'espèce humaine, Saint Maurice, Pillet, , 196 p. (ISBN 2-940145-26-1, lire en ligne), p. 30-31.
- ↑ Informations lexicographiques et étymologiques de « buse » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- 1 2 3 Buffon, Histoire naturelle, 1770, tome IX, p. 206.
- ↑ Pierre Cabard, L'Étymologie des noms d'oiseaux, Delachaux et Niestlé, , 800 p. (ISBN 978-2-603-02879-7, lire en ligne).
- ↑ Walls et Kenward 2020, p. 11.
- ↑ (en) « buzzard », sur Online Etymology Dictionary (consulté le ).
- ↑ Carl von Linné, Systema Naturae, 10e éd., tome I, p. 90.
- ↑ (en) James A. Jobling, Helm Dictionary of Scientific Bird Names, A&C Black, , 432 p. (ISBN 9781408133262, lire en ligne), p. 81.
- ↑ (en) Elisabeth Haring, Martin J. Riesing, Wilhelm Pinsker et Anita Gamauf, « Evolution of a pseudo-control region in the mitochondrial genome of Palearctic buzzards (genus Buteo) », Journal of Zoological Systematics and Evolutionary Research, vol. 37, no 4, , p. 185-194 (DOI 10.1111/j.1439-0469.1999.tb00982.x).
- 1 2 (en) Luise Kruckenhauser, Elisabeth Haring, Wilhelm Pinsker, Martin J. Riesing, Hans Winkler, Mickael Wink et Anita Gamauf, « Genetic vs. morphological differentiation of Old World buzzards (genus Buteo, Accipitridae) », Zoologica Scripta, vol. 33, no 3, , p. 197-211 (DOI 10.1111/j.0300-3256.2004.00147.x).
- ↑ Walls et Kenward 2020, p. 17.
- ↑ Walls et Kenward 2020, p. 18.
- 1 2 3 Forsman 2017, p. 303.
- ↑ Walls et Kenward 2020, p. 16.
- ↑ Orta, Boesman, Marks et Garcia 2022.
- ↑ Thiollay 1994, p. 185.
- ↑ Frédéric Jiguet et Aurélien Audevard, Petit Larousse des oiseaux de France et d'Europe, Paris/impr. en Espagne, Larousse, , 415 p. (ISBN 978-2-03-589875-3), p. 150
- 1 2 Forsman 2017, p. 304.
- 1 2 Marc Duquet, « Pièges de l'identification. Les Buses variables Buteo buteo « blanches » », Ornithos, nos 29-6, , p. 355-368.
- ↑ (en) E.F. Kappers, N. Chakarov, O. Krüger, A.K. Mueller, M. Valcu, B. Kempenaers, C. Both, « Classification and temporal stability of plumage variation in Common Buzzards », Ardea, vol. 105, no 2, , p. 125-136.
- ↑ Dare 2015, p. 2.
- 1 2 3 4 Forsman 2017, p. 305.
- 1 2 3 Forsman 2017, p. 306.
- 1 2 3 Walls et Kenward 2020, p. 21.
- ↑ Walls et Kenward 2020, p. 22.
- 1 2 3 4 5 6 7 Marc Duquet, Comprendre la mue des oiseaux : Une aide pour l'ornitho de terrain, Delachaux & Niestlé, , 191 p. (ISBN 978-2-603-02466-9), p. 116
- ↑ Forsman 2017, p. 329.
- ↑ Forsman 2017, p. 302.
- ↑ (en) William Henry Burt, « Territoriality and home range concepts as applied to mammals », Journal of Mammalogy, vol. 24, no 3, , p. 346–352 (DOI 10.2307/1374834).
- ↑ Walls et Kenward 2020, p. 77-78.
- ↑ Walls et Kenward 2020, p. 76.
- ↑ (en) Robert E. Kenward, Ralph T. Clarke, Kathy H. Hodder et Sean S. Walls, « Density and linkage estimators of home range: nearest-neighbor clustering defines multinuclear cores », Ecology, vol. 82, no 7, , p. 905-1920 (DOI 10.2307/2680056).
- ↑ (de) U. Hohmann, « Untersuchungen zur Raumnutzung und zur Brutbiologie des Mäusebussards (Buteo buteo) im Westen Schleswig-Holsteins », Corax, vol. 16, , p. 94-104 (lire en ligne).
- ↑ (en) Robert E. Kenward, « Goshawk hunting behaviour, and range size as a function of food and habitat availability », Journal of Animal Ecology, vol. 51, no 1, , p. 69-80 (DOI 10.2307/4311).
- ↑ (en) N. Picozzi et D.N. Weir, « Breeding biology of the Buzzard in Speyside », British Birds, vol. 67, , p. 199-210 (lire en ligne).
- ↑ Walls et Kenward 2020, p. 99.
- 1 2 3 4 5 6 7 8 9 10 (en) Peter J. Dare, « A buzzard population on Dartmoor, 1955-1993 », Devon Birds, vol. 51, , p. 4-31.
- ↑ Walls et Kenward 2020, p. 101.
- 1 2 3 4 (en) Robin Prytherch, « The breeding biology of the common buzzard », British Birds, vol. 106, no 5, , p. 264-279.
- ↑ (en) Duncan J. Halley, « Population changes and territorial distribution of Common Buzzards Buteo buteo in the Central Highlands, Scotland », Bird Study, vol. 40, no 1, , p. 24-30 (DOI 10.1080/00063659309477125).
- ↑ (en) Julian Driver et Peter J. Dare, « Population increase of buzzards in Snowdonia 1977–2007 », Welsh Birds, vol. 6, no 1, , p. 38-48.
- 1 2 Walls et Kenward 2020, p. 104.
- ↑ (en) Oliver Krüger, « Interactions between Common Buzzard Buteo buteo and Goshawk Accipiter gentilis: trade-offs revealed by a field experiment », Oikos, vol. 96, no 3, , p. 441-452 (DOI 10.1034/j.1600-0706.2002.960306.x).
- 1 2 3 4 5 Fabrizio Sergio, Alberto Boto, Chiara Scandolara, Giuseppe Bogliani, « Density, nest sites, diet, and productivity of Common Buzzards (Buteo buteo) in the Italian pre-Alps », Journal of Raptor Research, vol. 36, no 1, , p. 24-32
- ↑ (en) Achim Kostrzewa, « Interspecific interference competition in three European raptor species », Ethology Ecology & Evolution, vol. 3, no 2, , p. 127-143 (DOI 10.1080/08927014.1991.9525379).
- ↑ « It is likely that Buzzards will eat anything that moves, as it is likely to provide some fat and protein. » Walls et Kenward 2020, p. 50.
- ↑ Walls et Kenward 2020, p. 36-40.
- ↑ Walls et Kenward 2020, p. 41.
- ↑ (en) Richard M. Francksen, Mark J. Whittingham, Sonja C. Ludwig et David Baines, « Winter diet of Common Buzzards Buteo buteo on a Scottish grouse moor », Bird Study, vol. 63, no 4, (DOI 10.1080/00063657.2016.1238868).
- ↑ Walls et Kenward 2020, p. 42.
- ↑ (en) Ján Obuch et Karol Šotnár, « Feeding ecology of a nesting population of the Common Buzzard (Buteo buteo) in the Upper Nitra Region, Central Slovakia », Slovak Raptor Journal, vol. 3, , p. 13-20 (DOI 10.2478/v10262-012-0028-0).
- ↑ T. Blanc, « La voracité d'un couple de Buses Buteo buteo », Nos Oiseaux, vol. 25, , p. 254.
- ↑ R. L. Swann et B. Etheridge, « A comparison of breeding success and prey of the Common Buzzard Buteo buteo in two areas of northern Scotland », Bird Study, vol. 42, no 1, , p. 37-43 (DOI 10.1080/00063659509477146).
- 1 2 3 4 (en) W. Jędrzejewski, A. Szymura et B. Jędrzejewska, « Reproduction and food of the Buzzard Buteo buteo in relation to the abundance of rodents and birds in Białowieża National Park, Poland », Ethology Ecology & Evolution, vol. 6, no 2, , p. 179-190 (DOI 10.1080/08927014.1994.9522993).
- ↑ (en) I. M. Graham, S. M. Redpath et S. J. Thirgood, « The diet and breeding density of Common Buzzards Buteo buteo in relation to indices of prey abundance », Bird Study, vol. 42, no 2, , p. 165-173 (DOI 10.1080/00063659509477162).
- 1 2 3 4 (en) Eimear Rooney et W. Ian Montgomery, « Diet diversity of the Common Buzzard (Buteo buteo) in a vole-less environment », Bird Study, vol. 60, no 2, , p. 147-155 (DOI 10.1080/00063657.2013.772085).
- 1 2 3 (en) Santi Mañosa et Pedro J. Cordero, « Seasonal and sexual variation in the diet of the Common buzzard in Northeastern Spain », Journal of Raptor Research, vol. 26, no 4, , p. 235-238.
- 1 2 Génsbøl 2005, p. 131.
- ↑ (en) Risto Tornberg et Vitali Reif, « Assessing the diet of birds of prey: a comparison of prey items found in nests and images », Ornis Fennica, vol. 84, no 1, , p. 21-31.
- ↑ (en) Vidar Selås, Reidar Tveiten, Ole M. Aanonsen, Aanonsen Selås, « Diet of Common Buzzards (Buteo buteo) in southern Norway determined from prey remains and video recordings », Ornis Fennica, vol. 84, no 3, , p. 97–104.
- ↑ Walls et Kenward 2020, p. 43.
- 1 2 (en) T.K. Spidsø et V. Selås, « Prey selection and breeding success in the common buzzard Buteo buteo in relation to small rodents cycles in southern Norway », Fauna Norvegica Serie C: Cinclus, vol. 11, , p. 61-66.
- ↑ Walls et Kenward 2020, p. 44.
- ↑ Walls et Kenward 2020, p. 46.
- ↑ (en) Mark Bolton, Nigel Butcher, Fiona Sharpe, Danaë Stevens et Gareth Fisher, « Remote monitoring of nests using digital camera technology », Journal of Field Ornithology, vol. 78, no 2, , p. 213-220 (DOI 10.1111/j.1557-9263.2007.00104.x).
- ↑ (en) John W. Mallord, Christopher J. Orsman, Andrew Cristinacce, Nigel Butcher, Tim J. Stowe et Elisabeth C. Charman, « Mortality of Wood Warbler Phylloscopus sibilatrix nests in Welsh Oakwoods: predation rates and the identification of nest predators using miniature nest cameras », Bird Study, vol. 59, no 3, , p. 286-295 (DOI 10.1080/00063657.2012.669359).
- ↑ Géroudet 2013, p. 128-129.
- 1 2 Walls et Kenward 2020, p. 52.
- ↑ (en) Javier Bustamante Díaz, « Alimentación del ratonero común (Buteo buteo, L.1758) en el norte de España », Doñana. Acta vertebrata,
- ↑ (en) Vidar Selås, « Predation on reptiles and birds by the common buzzard, Buteo buteo, in relation to changes in its main prey, voles », Canadian Journal of Zoology, , p. 2086-2093 (DOI 10.1139/z01-18).
- ↑ Walls et Kenward 2020, p. 49.
- ↑ « For want of better food it will feed on beetles, earthworms and other insects. » Cité par Tubbs 1974, p. 37.
- 1 2 3 (en) Peter J. Dare, « The post-myxomatosis diet of the buzzard », Devon Birds, no 10, , p. 2–6.
- 1 2 3 Walls et Kenward 2020, p. 50.
- 1 2 (en) Thérèse Nore, Jean-Pierre Malafosse, Geneviève Nore et Éric Buffard, « La dispersion des jeunes de première année dans une population sédentaire de buse variable (Buteo buteo) », Revue d'Écologie (La Terre et La Vie), vol. 47, no 3, , p. 259-286 (lire en ligne).
- ↑ Walls et Kenward 2020, p. 51.
- ↑ (en) Francis D. Meunier, Christophe Verheyden, Pierre Jouventin, « Use of roadsides by diurnal raptors in agricultural landscapes », Biological Conservation, vol. 92, no 3, , p. 291-298.
- ↑ (en) D. Vidal–Vallés, A. Rodríguez, E. Pérez–Collazos, « Bird roadkill occurences in Aragon, Spain », Animal Biodiversity and Conservation, vol. 41, no 2, , p. 379–388.
- ↑ (en) Alexandria Young, Richard Stillman, Martin J. Smith et Amanda H. Korstjens, « An experimental study of vertebrate scavenging behavior in a northwest European woodland context », Forensic Sciences, vol. 59, no 5, (DOI 10.1111/1556-4029.12468).
- ↑ (en) Nuria Selva, Bogumiła Jędrzejewska, Włodzimierz Jędrzejewski et Adam Wajrak, « Scavenging on European bison carcasses in Białowieża Primeval Forest (eastern Poland) », Écoscience, vol. 10, no 3, , p. 303-311 (DOI 10.1080/11956860.2003.11682778).
- 1 2 (en) I. Newton, P. E. Davis et J. E. Davis, « Ravens and Buzzards in relation to sheep-farming and forestry in Wales », Journal of Applied Ecology, vol. 19, no 3, , p. 681-706 (DOI 10.2307/2403275).
- ↑ Dare 2015, p. 45.
- 1 2 (en) Raymond Hewson, « Scavenging of mammal carcasses by birds in west Scotland », Journal of Zoology, vol. 194, , p. 525-537.
- ↑ Walls et Kenward 2020, p. 53.
- ↑ Ornithomedia, « Une Buse variable capture une carpe dans le Gard (France) », (consulté le )
- ↑ (en) M.T. Tyler, « Common Buzzard feeding on apple », British Birds, vol. 93, no 2, , p. 90.
- ↑ Walls et Kenward 2020, p. 58.
- 1 2 (en) N. W. H. Barton et D. C. Houston, « Morphological adaptation of the digestive tract in relation to feeding ecology of raptors », Journal of Zoology, vol. 232, no 1, , p. 133-150.
- ↑ Walls et Kenward 2020, p. 60.
- 1 2 Walls et Kenward 2020, p. 61.
- ↑ Walls et Kenward 2020, p. 63.
- ↑ (en) Tore Slagsvold et Geir A. Sonerud, « Prey size and ingestion rate in raptors: importance for sex roles and reversed sexual size dimorphism », Journal of Avian Biology, vol. 38, no 6, , p. 650-661 (DOI 10.1111/j.2007.0908-8857.04022.x)
- ↑ Walls et Kenward 2020, p. 64.
- ↑ Dare 2015, p. 179-180.
- ↑ Walls et Kenward 2020, p. 65.
- ↑ (en) Bernard King, « Food-seeking Buzzard following combine-harvester », British Birds, vol. 79, , p. 429
- ↑ Walls et Kenward 2020, p. 72.
- ↑ Dare 2015, p. 64.
- ↑ Dare 2015, p. 62.
- ↑ Dare 2015, p. 155.
- 1 2 (en) Per Widén, « Habitat quality for raptors: a field experiment », Journal of Avian Biology, vol. 25, no 3, , p. 219-223 (DOI 10.2307/3677078).
- 1 2 3 4 Walls et Kenward 2020, p. 67.
- ↑ (en) M. Hampden Smith, « Buzzards following and alighting on working plough », British Birds, vol. 79, , p. 42.
- ↑ Walls et Kenward 2020, p. 71.
- 1 2 3 Walls et Kenward 2020, p. 69.
- ↑ (en) Davide Csermely et Giorgia Gaibani, « Is foot squeezing pressure by two raptor species sufficient to subdue their prey? », The Condor, vol. 100, no 4, , p. 757-763 (DOI 10.2307/1369762).
- ↑ (de) Walter Busch, « Mausebussard (Buteo buteo) nimmt Baumfalke (Falco subbuteo) die Beute ab », Ornithologische Schnellmitteilungen für Baden-Württemberg, vol. 51/52, , p. 41.
- ↑ (en) R.L. Kinley et D.B. Thexton, « Note on opportunistic food acquisition by Buzzard while mobbed by Peregrines », British Birds, vol. 78, no 4, , p. 193.
- ↑ (en) Felipe Siverio, Airam Rodríguez et David P. Padilla, « Kleptoparasitism by Eurasian Buzzard (Buteo buteo) on two Falco species », Journal of Raptor Research, vol. 42, no 1, , p. 67-68 (DOI 10.3356/JRR-07-24.1).
- ↑ (en) A. Bloomfield, « Common Buzzards robbing Marsh Harriers of prey », British Birds, vol. 106, no 7, , p. 411-412.
- ↑ Walls et Kenward 2020, p. 74.
- ↑ (en) R.C. Dickson, « Buzzard robbing juvenile Peregrine of prey », Scottish Birds, vol. 19, , p. 124-125.
- ↑ (en) Magnus Sylvén, Reproduction and survival in common buzzards (Buteo buteo) illustrated by the seasonal allocation of energy expenses (thèse de doctorat), Université de Lund, .
- ↑ Dare 2015, p. 160.
- ↑ Dare 2015, p. 162.
- 1 2 Dare 2015, p. 172.
- ↑ Dare 2015, p. 169.
- ↑ Géroudet 2013, p. 129.
- 1 2 Génsbøl 2005, p. 130.
- 1 2 Géroudet 2013, p. 127.
- ↑ Pierre Cabard et Bernard Chauvet, L'Étymologie des noms d'oiseaux, Paris, Belin, coll. « Éveil nature », (réimpr. 2003), 589 p. (ISBN 2-7011-3783-7), p. 114.
- ↑ Walls et Kenward 2020, p. 227-228.
- ↑ (en) Oliver Krüger, Jan Lindström et William Amos, « Maladaptive mate choice maintained by heterozygote advantage », Evolution, vol. 55, no 6, , p. 1207-1214 (DOI 10.1554/0014-3820).
- ↑ Walls et Kenward 2020, p. 125-126.
- 1 2 Eimear Rooney, Ecology and breeding biology of the common buzzard Buteo Buteo, in Ireland (thèse de doctorat), Université Queen's de Belfast, .
- 1 2 Walls et Kenward 2020, p. 128.
- ↑ Walls et Kenward 2020, p. 125.
- ↑ (en) Rafael Barrientos, « A case of polyandrous trio of Eurasian Buzzards (Buteo buteo) on Fuerteventura Island, Canary Islands », Journal of Raptor Research, vol. 40, no 4, , p. 305-306 (DOI 10.3356/0892-1016).
- ↑ (en) Harri Hakkarainen, Sakari Mykrä, Sami Kurki, Risto Tornberg et Sven Jungell, « Competitive interactions among raptors in boreal forests », Oecologia, vol. 141, , p. 420–424 (DOI 10.1007/s00442-004-1656-6).
- ↑ Walls et Kenward 2020, p. 127.
- 1 2 3 4 (en) Jacek Goszczyński, « Density and productivity of common buzzard Buteo buteo and goshawk Accipiter gentilis populations in Rogów, Central Poland », Acta Ornithologica, vol. 32, no 2, , p. 149-155 (lire en ligne).
- ↑ Thérèse Nore, « Rapaces diurnes communs en Limousin pendant la période de nidification (Buse, Bondrée, Milan noir, Busards Saint-Martin et cendré) », Alauda, vol. 47, , p. 183-194.
- ↑ J. Roché, « Un recensement de Buses en plaine de Saône ; quelques données concernant la nidification », Le Jean le Blanc, vol. 16, , p. 49-63.
- 1 2 (en) Tapio Solonen, « Nest-sites of the Common Buzzard Buteo buteo in Finland », Ornis Fennica, vol. 59, , p. 191–192.
- ↑ (de) Dieter Rockenbauch, « Zwölfjährige Untersuchungen zur Ökologie des Mäusebussards (Buteo buteo) auf der Schwäbischen Alb », Journal für Ornithologie, vol. 116, , p. 39–54 (DOI 10.1007/BF01643074).
- 1 2 Walls et Kenward 2020, p. 131.
- ↑ Walls et Kenward 2020, p. 132.
- ↑ Walls et Kenward 2020, p. 129.
- ↑ Walls et Kenward 2020, p. 133.
- ↑ (en) Carlos Castillo-Gómez et Gregorio Moreno-Rueda, « A record of a Common Buzzard (Buteo buteo) nesting in an abandoned building », Journal of Raptor Research, vol. 45, no 3, , p. 275-277 (DOI 10.3356/JRR-10-114.1).
- ↑ Walls et Kenward 2020, p. 134.
- ↑ Walls et Kenward 2020, p. 137.
- ↑ (en) F. Sergio, J. Blas, G. Blanco, A. Tanferna, L. López, J. A. Lemus et F. Hiraldo, « Raptor nest decorations are a reliable threat against conspecifics », Science, vol. 331, , p. 327-30 (DOI 10.1126/science.1199422).
- ↑ (en) Robin Prytherch, « Common Buzzard nests, nest trees and prey remains in Avon », British Birds, vol. 109, no 5, , p. 256–264.
- ↑ Walls et Kenward 2020, p. 138.
- ↑ Walls et Kenward 2020, p. 141.
- ↑ (en) Peter Sunde, Peter Odderskær et Kurt Storgaard, « Flight distances of incubating Common Buzzards Buteo buteo are independent of human disturbance », Ardea, vol. 97, , p. 369-372 (DOI 10.5253/078.097.0313).
- ↑ Walls et Kenward 2020, p. 142.
- ↑ Walls et Kenward 2020, p. 143.
- ↑ (en) Aleksi Lehikoinen, Patrik Byholm, Esa Ranta, Pertti Saurola, Jari Valkama, Erkki Korpimäki, Hannu Pietiäinen et Heikki Henttonen, « Reproduction of the common buzzard at its northern range margin under climatic change », Oikos, vol. 118, no 6, , p. 829-836 (DOI 10.1111/j.1600-0706.2008.17440.x).
- 1 2 Walls et Kenward 2020, p. 145.
- ↑ Walls et Kenward 2020, p. 150.
- 1 2 Walls et Kenward 2020, p. 149.
- ↑ (nl + en) Rob G. Biljsma, « Geslachtsdeterminatie van nestjonge Buizerds (Buteo buteo) », Limosa, vol. 72, , p. 1-10 (lire en ligne).
- ↑ (hu) Zoltán Horváth, « Egerészölyv (Buteo buteo) fiórák rétisas (Haliaeetus albicilla) fészekben », Heliaca, vol. 5, , p. 94-97.
- ↑ (en) Zoltán Horváth, « White-tailed Eagle (Haliaeetus albicilla) populations in Hungary between 1987–2007 », Denisia, vol. 27, , p. 85-95 (lire en ligne).
- ↑ (en) Ivan Literak et Jakub Mraz, « Adoptions of young Common Buzzards in White-tailed Sea Eagle nests », The Wilson Journal of Ornithology, vol. 123, no 1, , p. 174-176.
- ↑ (de) Joachim Neumann et Joachim Schwarz, « Seeadlerpaar mit einer besonderen Vorliebe für junge Mäusebussarde », GAV-Journal, vol. 13, , p. 35-40 (lire en ligne).
- ↑ (en) Miroslav Dravecký et Miroslav Lehocký, « Young of the common buzzard (Buteo buteo) reared by lesser spotted eagles (Aquila pomarina) in natural conditions in Slovakia », Slovak Raptor Journal, vol. 7, (DOI 10.2478/srj-2013-0001).
- ↑ Laurent Broch, Romain Cantin, Mikaël Cantin, Serge Jaquier et Charly Henninger, « Un couple d’Autours des palombes Accipiter gentilis élève un poussin de Buse variable Buteo buteo », Nos oiseaux, vol. 57/2, no 500, (lire en ligne).
- ↑ (en) A. J. Tyack, S. S. Walls et R. E. Kenward, « Behaviour in the post-nestling dependence period of radio-tagged Common Buzzards Buteo buteo », Ibis, vol. 140, no 1, , p. 58-63 (DOI 10.1111/j.1474-919X.1998.tb04541.x).
- ↑ Walls et Kenward 2020, p. 152.
- ↑ (en) N. Picozzi et D. Weir, « Dispersal and causes of death in Buzzards », British Birds, vol. 69, no 6, , p. 193–201.
- 1 2 3 (en) Sean Walls et Robert Kenward, « Movements of radio-tagged Common Buzzards Buteo buteo in their first year », Ibis, vol. 137, no 2, , p. 177-182 (DOI 10.1111/j.1474-919X.1995.tb03237.x).
- 1 2 3 (en) Sean Walls et Robert Kenward, « Movements of radio-tagged Buzzards Buteo buteo in early life », Ibis, vol. 140, no 4, , p. 561-568 (DOI 10.1111/j.1474-919X.1998.tb04700.x).
- ↑ Walls et Kenward 2020, p. 179-180.
- ↑ (en) Marta López-Darias, « First documented case of double-brooding in the Eurasian Buzzard (Buteo buteo) », Journal of Raptor Research, vol. 41, no 4, , p. 340-341.
- ↑ Walls et Kenward 2020, p. 155.
- ↑ (en) Jacek Goszczyński, « The breeding performance of the Common Buzzard Buteo buteo and Goshawk Accipiter gentilis in central Poland », Acta Ornithologica, vol. 36, no 2, , p. 105-110 (DOI 10.3161/068.036.0202).
- ↑ Walls et Kenward 2020, p. 157.
- ↑ (en) Achim Kostrzewa, Renate Kostrzewa, « The relationship of spring and summer weather with density and breeding performance of the Buzzard Buteo buteo, Goshawk Accipiter gentilis and Kestrel Falco tinnunculus », Ibis, vol. 132, no 4, , p. 550-559 (DOI 10.1111/j.1474-919X.1990.tb00278.x).
- ↑ (en) I. M. W. Sim, L. Campbell, D. J. Pain et J. D. Wilson, « Correlates of the population increase of Common Buzzards Buteo buteo in the West Midlands between 1983 and 1996 », Bird Study, vol. 47, no 2, , p. 154-164 (DOI 10.1080/00063650009461171).
- ↑ (en) Colin R. Tubbs, « Analysis of nest record cards for the Buzzard », Bird Study, vol. 19, no 2, , p. 97-104 (DOI 10.1080/00063657209476331).
- 1 2 (en) D. Weir et N. Picozzi, « Dispersion of Buzzards in Speyside », British Birds, vol. 76, no 2, , p. 66-78.
- ↑ Walls et Kenward 2020, p. 162.
- ↑ (en) T. Fransson, L. Jansson, T. Kolehmainen, C. Kroon, et T. Wenninger, « EURING list of longevity records for European birds », sur European Union for Bird Ringing, (consulté le ).
- ↑ (en) British Trust for Ornithology, « Longevity records for Britain & Ireland in 2021 » (consulté le ).
- ↑ Walls et Kenward 2020, p. 197.
- ↑ (en) Rob Lensink, « Range expansion of raptors in Britain and the Netherlands since the 1960s: testing an individual-based diffusion model », Journal of Animal Ecology, vol. 66, no 6, , p. 811-826 (DOI 10.2307/5997).
- 1 2 (en) R. E. Kenward, S. S. Walls, K. H. Hodder, M. Pahkala, S. N. Freeman et V. R. Simpson, « The prevalence of non-breeders in raptor populations: evidence from rings, radio-tags and transect surveys », Oikos, vol. 91, no 2, , p. 271-279.
- ↑ (de) M. Lierz, T. Göbel et R. Schuster, « Untersuchungen zum Vorkommen von Parasiten bei einheimischen Greifvögeln und Eulen », Berliner und Münchener Tierärztliche Wochenschrift, vol. 115, nos 1-2, , p. 43-52.
- ↑ (en) Nigel W.H. Barton et David C. Houston, « The incidence of intestinal parasites in British birds of prey », Journal of Raptor Research, vol. 35, no 1, , p. 71-73.
- ↑ (en) Jean Hars, Sandrine Ruette, Maurice Benmergui, Carol Fouque, Jean-Yves Fournier, Arnaud Legouge, Martine Cherbonnel, Baroux Daniel, Catherine Dupuy et Véronique Jestin, « The epidemiology of the highly pathogenic H5N1 avian influenza in Mute Swan (Cygnus olor) and other Anatidae in the Dombes region (France), 2006 », Journal of Wildlife Diseases, vol. 44, no 4, , p. 811-823 (DOI 10.7589/0090-3558-44.4.811).
- ↑ (en) Judith M.A. van den Brand, Oliver Krone, Peter U. Wolf, Marco W.G. van de Bildt, Geert van Amerongen, Albert D.M.E. Osterhaus et Thijs Kuiken, « Host-specific exposure and fatal neurologic disease in wild raptors from highly pathogenic avian influenza virus H5N1 during the 2006 outbreak in Germany », Veterinary Research, vol. 46, no 24, (DOI 10.1186/s13567-015-0148-5).
- ↑ Walls et Kenward 2020, p. 208.
- ↑ (en) Nick Dixon et Andrew Gibbs, « Extreme territorial aggression by urban Peregrine Falcons toward Common Buzzards in South-West England », Ornis Hungarica, vol. 26, no 2, , p. 232-242 (DOI 10.1515/orhu-2018-0031).
- ↑ « Peregrine falcons attack buzzard in Exeter », sur BBC, (consulté le ).
- ↑ Walls et Kenward 2020, p. 207.
- ↑ Dare 2015, p. 48.
- ↑ (en) Francisco Guil, Mariana Fernández-Olalla, Rubén Moreno-Opo,Ignacio Mosqueda, María Elena Gómez, Antonio Aranda, Ángel Arredondo, José Guzmán, Javier Oria, Luis Mariano González, Antoni Margalida, « Minimising mortality in endangered raptors due to power lines: the importance of spatial aggregation to optimize the application of mitigation measures », PLOS One, (DOI 10.1371/journal.pone.0028212).
- ↑ (en) Guyonne F.E. Janss, « Avian mortality from power lines: a morphologic approach of a species-specific mortality », Biological Conservation, vol. 95, no 3, , p. 353-359 (DOI 10.1016/S0006-3207(00)00021-5).
- ↑ (en) Viktoria Sós-Koroknai, János Gál, Miklos Marosan, Tamás Tóth et Endre Sós, « Causes of morbidity of Common Buzzards (Buteo buteo) and Long-Eared Owls (Asio otus) at a Hungarian wildlife rescue centre between 2014 and 2016 », Biharean Biologist, vol. 14, no 1, , p. 25-29.
- ↑ (en) Luis Barrios et Alejandro Rodríguez, « Behavioural and environmental correlates of soaring-bird mortality at on-shore wind turbines », Journal of Applied Ecology, vol. 41, no 1, , p. 72-81 (DOI 10.1111/j.1365-2664.2004.00876.x
 ).
). - ↑ (de) O. Krone, O. Sömmer, P. Lessow, D. Haas, « Todesursachen, Krankheiten und Parasiten bei Mäusebussarden Buteo buteo in Deutschland », Populationsökologie vonGreifvogel-undEulenarten, vol. 5, , p. 439-448/
- ↑ Walls et Kenward 2020, p. 213.
- ↑ Walls et Kenward 2020, p. 214.
- ↑ (en) Lowie P. Jager, Frank V. J. Rijnierse, Hans Esselink et Aalbert J. Baars, « Biomonitoring with the Buzzard Buteo buteo in the Netherlands: Heavy metals and sources of variation », Journal für Ornithologie, vol. 137, , pages295–318 (DOI 10.1007/BF01651071).
- ↑ (en) Veerle L.B Jaspers, Stefan Voorspoels, Adrian Covaci et Marcel Eens, « Can predatory bird feathers be used as a non-destructive biomonitoring tool of organic pollutants? », Biology Letter, vol. 2, no 2, , p. 283–285 (DOI 10.1098/rsbl.2006.0450).
- ↑ (en) D. R. Dietrich, P. Schmid, U. Zweifel, Ch. Schlatter, S. Jenni-Eiermann, H. Bachmann, U. Bühler & N. Zbinden, « Mortality of birds of prey following field application of granular carbofuran: A case study », Archives of Environmental Contamination and Toxicology, vol. 29, , p. 140–145 (DOI 10.1007/BF00213099).
- ↑ Walls et Kenward 2020, p. 217.
- ↑ (en) Ignacy Kitowski, Rafał Łopucki, Anna Stachniuk et Emilia Fornal, « A pesticide banned in the European Union over a decade ago is still present in raptors in Poland », Environmental Conservation, vol. 47, no 4, , p. 310-314 (DOI doi:10.1017/S037689292000034X).
- ↑ (en) Alessandra Battaglia, Sergio Ghidini, Giorgio Campanini et Roberto Spaggiari, « Heavy metal contamination in little owl (Athene noctua) and common buzzard (Buteo buteo) from northern Italy », Ecotoxicology and Environmental Safety, vol. 60, no 1, , p. 61-66 (DOI 10.1016/j.ecoenv.2003.12.019).
- ↑ Walls et Kenward 2020, p. 12.
- ↑ Birdlife International, « Eurasian Buzzard Buteo buteo », (consulté le ).
- 1 2 3 4 Matérac, Ducruet et Dupuy 2022, p. 660.
- ↑ Walls et Kenward 2020, p. 229.
- ↑ Birdlife International, « Buteo buteo (Eurasian Buzzard) European Red List of birds supplementary material », (consulté le ).
- ↑ Walls et Kenward 2020, p. 14.
- ↑ Nore 1995, p. 194.
- ↑ Walls et Kenward 2020, p. 95.
- ↑ Walls et Kenward 2020, p. 94-95.
- ↑ Walls et Kenward 2020, p. 234.
- 1 2 Matérac, Ducruet et Dupuy 2022, p. 661.
- ↑ A.F. Boshoff, « Steppe Buzzard Bruinjakkalsvoël Buteo buteo », dans J.A. Harrison, D.G. Allan, L.G. Underhill, M. Herremans, A.T. Tree, V. Parker et C.J. Brown (éd.), The Atlas of Southern African Birds, vol. I (non-Passerines), Johannesburg, BirdLife South Africa, (lire en ligne), p. 208–209.
- ↑ (en) Judy Shamoun-Baranes, Emiel van Loon, Hans van Gastere, Jelmer van Belle, Willem Bouten et Luit Buurma, « A comparative analysis of the influence of weather on the flight altitudes of birds », Bulletin of the American Meteorological Society, vol. 87, no 1, , p. 47-62 (DOI 10.1175/BAMS-87-1-47).
- ↑ (en) Reto Spaar et Bruno Bruderer, « Optimal flight behavior of soaring migrants: a case study of migrating steppe buzzards, Buteo buteo vulpinus », Behavioral Ecology, vol. 8, no 3, , p. 288–297 (DOI 10.1093/beheco/8.3.288).
- ↑ (en) Roine Strandberg, Thomas Alerstam, Mikael Hake et Nils Kjellén, « Short‐distance migration of the Common Buzzard Buteo buteo recorded by satellite tracking », Ibis, vol. 151, no 1, , p. 200-206 (DOI 10.1111/j.1474-919X.2008.00890.x).
- ↑ (en) Michele Panuccio, Antonino Duchi, Giuseppe Lucia et Nicolantonio Agostini, « Species-specific behaviour of raptors migrating across the Turkish Straits in relation to weather and geography », Ardeola, vol. 64, no 2, , p. 305-324 (DOI 10.13157/arla.64.2.2017.ra2).
- ↑ (en) Mark Beaman et Charles Galea, « The visible migration of raptors over the Maltese Islands », Ibis, vol. 116, no 4, , p. 419-431 (DOI 10.1111/j.1474-919X.1974.tb07643.x).
- ↑ (en) Nicolantonio Agostini, Paolo Amato, Antonino Provenza et Michele Panuccio, « Do common buzzards Buteo buteo migrate across the Channel of Sicily during autumn? », Avocetta, vol. 19, , p. 19.
- ↑ (en) Hadoram Shirihai et David A. Christi, « Raptor migration at Eilat », British Birds, vol. 85, no 4, , p. 141-186 (lire en ligne).
- ↑ (en) Clive Finlayson, Kimberly Brown, Ruth Blasco, Jordi Rosell, Juan José Negro, et al., « Birds of a feather: Neanderthal exploitation of raptors and corvids », PLOS One, (DOI 10.1371/journal.pone.0045927).
- ↑ Francis Willughby, The ornithology of Francis Willughby of Middleton in the county of Warwick Esq, fellow of the Royal Society in three books : wherein all the birds hitherto known, being reduced into a method sutable (sic) to their natures, are accurately described : the descriptions illustrated by most elegant figures, nearly resembling the live bird, livre II, p. 71, [lire en ligne].
- ↑ Cobham 2014, p. 165.
- ↑ Aristote, Histoire des animaux, 592a29-b5.
- ↑ Aristote, Histoire des animaux, 609a24–29.
- ↑ Aristote, Histoire des animaux, 620a16.
- ↑ Aristophane, Les Oiseaux [détail des éditions] [lire en ligne], 1206.
- ↑ Sémonide, fragment 9 West.
- 1 2 Pline l'Ancien, Histoire naturelle [détail des éditions] [lire en ligne], 10, 204 et 207.
- ↑ Pline l'Ancien, Histoire naturelle, 10, 21.
- ↑ Pline l'Ancien, Histoire naturelle, 10, 135.
- ↑ Festus Grammaticus, p. 29 Lindsay.
- ↑ Claude Élien, La Personnalité des animaux, XII, 4.
- ↑ Antoninus Liberalis, Métamorphoses, XIV, 3.
- ↑ (en) W. Geoffrey Arnott, Birds in the Ancient World from A to Z, Routledge, (ISBN 9780415540889), p. 359-360.
- ↑ (en) Juan José Negro, « Raptors and People: An Ancient Relationship Persisting Today », dans José Hernán Sarasola, Juan Manuel Grande et Juan José Negro (éd.), Birds of Prey. Biology and conservation in the XXI century, Cham, Springer, (ISBN 978-3-319-73744-7), p. 165-166.
- ↑ (en) Robin S. Oggins, The Kings and Their Hawks : Falconry in Medieval England, Yale University Press, , p. 115.
- ↑ Walls et Kenward 2020, p. 32.
- ↑ Baudouin van den Abeele, La fauconnerie dans les lettres françaises du XIIe au XIVe siècle, Leuven University Press, , 404 p. (ISBN 9789061864004, lire en ligne), p. 194 et 203
- ↑ (en) Edward B. Michell, « The Art and Practice of Hawking », Gutenberg Project (consulté le ).
- ↑ “If you want to fly a bird, but not necessarily be successful at hunting, the Common Buzzard is wonderful. A bird happy to fail in catching things, especially with a human 'mug' to feed it.“
- ↑ Dare 2015, p. 59.
- ↑ « Buse variable », sur le site de l'Ircam.
- ↑ (en) Kjell Scharning, « Common Buzzard Buteo buteo », sur Theme Birds on Stamps (consulté le ).
- ↑ (en) « Buteo buteo », sur CITES.org.
- ↑ (en) Derek Yalden et Umberto Albarella, The History of British Birds, Oxford, Oxford University Press, , 270 p. (ISBN 9780199217519, DOI 10.1093/acprof:oso/9780199217519.001.0001, lire en ligne), p. 65.
- 1 2 3 (en) Roger Lovegrove, Silent Fields : the Long Decline of a Nation's Wildlife, Oxford University Press, , 418 p. (ISBN 978-0-19-852071-9, lire en ligne), p. 134-140.
- ↑ (en) E.L. Jones, « The bird pests of British agriculture in recent centuries », The Agricultural History Review, vol. 20, , p. 107–125.
- ↑ Cobham 2014, p. 167-168.
- 1 2 3 (en) Ian Newton, « Effects of human persecution on European raptors », Raptor Research, vol. 13, no 3, , p. 65-78.
- ↑ Cobham 2014, p. 169.
- 1 2 (en) Norman Moore, « The past and present status of the Buzzard in the British Isles », British Birds, vol. 50, , p. 173-197.
- ↑ (en) J. T. R. Sharrock (s. dir.), The Atlas of Breeding Birds in Britain and Ireland, T. et A. D. Poyser, .
- ↑ Walls et Kenward 2020, p. 247-248.
- ↑ (en) Rob Clements, « The Common Buzzard in Britain: a new population estimate », British Birds, vol. 95, , p. 377-383 (lire en ligne).
- ↑ (en) Clive S. Hutchinson, Birds in Ireland, T. and A.D. Poyser, , 2e éd., 218 p. (ISBN 9781408137000, lire en ligne), p. 88.
- ↑ (en) John Lusby, « Buzzard comeback: numbers continue to soar », Wings, , p. 21-23 (lire en ligne).
- ↑ (en) Allan Mee, « An overview of monitoring for raptors in Ireland », Acrocephalus, vol. 33, nos 154/155, , p. 239-245 (lire en ligne).
- ↑ (en) David A. Stroud, « The status and legislative protection of birds of prey and their habitats in Europe », dans D. B. A. Thompson, S. M. Redpath, A. H. Fielding, M. Marquiss et C. A. Galbraith (éd.), Birds of Prey in a Changing Environment, The Stationery Office, (ISBN 9780114973087), p. 51-84.
- ↑ (en) Stauros Kalpakis, Antonio D. Mazaris, Yiannis Mamakis et Yiannis Poulopoulos, « A retrospective study of mortality and morbidity factors for Common Buzzards Buteo buteo and Long-legged Buzzards Buteo rufinus in Greece: 1996–2005 », Bird Conservation International, vol. 19, no 1, , p. 15-21 (DOI 10.1017/S095927090800806X).
- ↑ (es) Manuel Alamo Tavio, Pedro Martin Gomez et Antonio Cardona Sosa, Asociación Canaria para Defensa de la Naturaleza, « Aves de Lanzarote en Peligro de Extincion », dans Nicolas De Paiz Pereyra, Aves y plantas de Lanzarote en Peligro de Extincion, Lanzarote, EXCMO - Cabildo Insular, , 53 p., p. 11
- ↑ (en) Cesar-Javier Palacios, « Current status and distribution of birds of prey in the Canary Islands », Bird Conservation International, vol. 14, no 3, , p. 203-213 (DOI 10.1017/S0959270904000255).
- ↑ (en) Natalia Montesdeoca, Pascual Calabuig, Juan A. Corbera et Jorge Orós, « Causes of Admission for Raptors to the Tafira Wildlife Rehabilitation Center, Gran Canaria Island, Spain: 2003–13 », Journal of Wildlife Diseases, vol. 52, no 3, , p. 647–652 (DOI 10.7589/2015-09-255).
- ↑ Arrêté du 29 octobre 2009 fixant la liste des oiseaux protégés sur l'ensemble du territoire et les modalités de leur protection
- ↑ (en) Tibor Csörgő, Richárd Zornánszky, Tibor Szép, Péter Fehérvári, « Should the Common Buzzard be hunted? », Ornis Hungarica, vol. 20, no 2, , p. 1–12 (DOI 10.2478/orhu-2013-0006).
- ↑ (cs) Věra Sychrová, « Pták roku 2021: káně lesní », sur Česká společnost ornitologická, (consulté le ).
- ↑ Guillaume Narguet, « La buse variable, Oiseau de l’année 2021 en République tchèque », sur Radio Prague International, (consulté le ).
Voir aussi
Bibliographie
- (en) David Cobham, A Sparrowhawk's Lament : How British Breeding Birds of Prey Are Faring, Princeton University Press, , 272 p. (ISBN 978-0-691-15764-1, lire en ligne).

- (en) Peter J. Dare, The Life of Buzzards, Caithness, Whittles Publishing, (ISBN 978-184995-130-2).

- James Ferguson-Lees et David Christie (trad. de l'anglais par Bertrand Eliotout), Guide des rapaces diurnes du monde. 338 espèces décrites et illustrées, Paris, Delachaux et Niestlé, coll. « Les guides du naturaliste », , 320 p. (ISBN 978-2-603-01547-6), p. 224 (pl. 74)
- Dick Forsman (trad. de l'anglais par Marc Duquet), Identifier les rapaces en vol. Europe, Afrique du Nord et Moyen-Orient, Paris, Delachaux et Niestlé, , 543 p. (ISBN 978-2-603-02472-0).

- Benny Génsbøl (trad. du danois par Marie-Anne Tattevin), Guide des rapaces diurnes. Europe, Afrique du Nord et Moyen-Orient, Paris, Delachaux et Niestlé, coll. « Les guides du naturaliste », , 403 p. (ISBN 2-603-01327-0), p. 127-133.

- Paul Géroudet et Michel Cuisin (mise à jour), Les rapaces diurnes et nocturnes d’Europe, Lausanne, Delachaux et Niestlé, , 446 p. (ISBN 978-2-603-01958-0), p. 126-135.

- (en) Jean-Marc Thiollay, « Eurasian Buzzard Buteo buteo », dans Josep del Hoyo, Andrew Elliott, Jordi Sargatal (éds.), Handbook of the Birds of the World, vol. 2: New World Vultures to Guineafowl, Barcelone, Lynx Edicions, (ISBN 84-87334-15-6), p. 185 (pl. 18).

- Jean-Pierre Matérac, Daniel Ducruet et Jérémy Dupuy, « Buse variable », dans Jérôme Dupuy et Louis Sallé (coord.), Atlas des oiseaux migrateurs de france, vol. 2 : des Ciconiidés aux Emberizidés, Biotope — Muséum national d'histoire naturelle — Ligue pour la protection des oiseaux, (ISBN 978-2-85653-994-1), p. 660-663.

- André Mauxion, Les rapaces : faucons, buse variable, épervier d'Europe et autres rapaces diurnes, Lausanne, Payot, coll. « Atlas visuels », , 120 p. (ISBN 2601022272)
- (de) Manfred Melde, Der Mäusebussard : Brutbiologie und wirtschaftliche Bedeutung, Wittenberg, A. Ziemsen, coll. « Die Neue Brehm-Bücherei », .

- Thérèse Nore, « Buse variable Buteo buteo », dans Jean-Marc Thiollay et Vincent Bretagnolle, Rapaces nicheurs de France — Distribution, effectifs et conservation, Paris, Delachaux et Niestlé, coll. « La bibliothèque du naturaliste », (ISBN 2-603-01313-0), p. 90-95.

- Thérèse Nore, « Buse variable Buteo buteo », dans Dosithée Yeatman-Berthelot et Guy Jarry, Nouvel atlas des oiseaux nicheurs de France 1985-1989, Paris, Société ornithologique de France, , 2e éd. (ISBN 2-9505440-2-9), p. 194-195.

- (en) Jaume Orta, Peter F. D. Boesman, Jeffrey S. Marks et Ernest Garcia, « Common Buzzard (Buteo buteo), version 1.1 », dans S. M. Billerman, B. K. Keeney, P. G. Rodewald et T. S. Schulenberg (éd.), Birds of the World, Ithaca, NY, Cornell Lab of Ornithology, (DOI 10.2173/bow.combuz1.01.1).

- (en) Sean Walls et Robert Kenward, The Common Buzzard, Londres, T & AD Poyser, , 304 p. (ISBN 978-1-4729-7208-8).

- (en) Colin R. Tubbs, The Buzzard, Newton Abbot, David & Charles, (ISBN 0715363239)
Liens externes
- Ressources relatives au vivant :
- Avibase
- Convention de Bonn
- Global Biodiversity Information Facility
- Global Raptor Information Network
- Oiseaux.net
- TAXREF (INPN)
- (en) Animal Diversity Web
- (en) ARKive
- (cs + en) BioLib
- (en) BirdFacts
- (en) BirdLife International
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) Internet Bird Collection
- (cs) Nálezová databáze ochrany přírody
- (en) NBN Atlas
- (nl) Nederlands Soortenregister
- (en) Species+
- (en) Système d'information taxonomique intégré
- (en) Union internationale pour la conservation de la nature
- (en) World Register of Marine Species
- (en) Xeno-canto
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Référence Congrès ornithologique international : (consulté le )
- (fr+en) Référence Avibase : Buteo buteo (+ répartition) (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Buteo buteo dans Accipitriformes
- (fr) Référence Oiseaux.net : Buteo buteo (+ répartition)
- (en) Référence CITES : espèce Buteo buteo (Linnaeus, 1758) (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Buteo buteo (sur le site du ministère français de l'Écologie) (consulté le )
- (en) Référence Fauna Europaea : Buteo buteo (Linnaeus, 1758) (consulté le )
- (fr+en) Référence ITIS : Buteo buteo (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Buteo buteo
- (en) Référence NCBI : Buteo buteo (taxons inclus)
- (en) Référence UICN : espèce Buteo buteo (consulté le )