| Thallium | |||||||||||
.jpg.webp) Thallium dans une ampoule. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Tl | ||||||||||
| Nom | Thallium | ||||||||||
| Numéro atomique | 81 | ||||||||||
| Groupe | 13 | ||||||||||
| Période | 6e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Métal pauvre | ||||||||||
| Configuration électronique | [Xe] 4f14 5d10 6s2 6p1 | ||||||||||
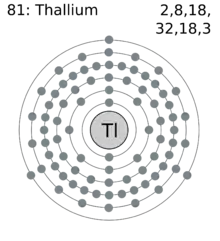
| Électrons par niveau d’énergie | 2, 8, 18, 32, 18, 3 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 204,383 3 ± 0,000 2 u[1] | ||||||||||
| Rayon atomique (calc) | 190 pm (156 pm) | ||||||||||
| Rayon de covalence | 145 ± 7 pm[2] | ||||||||||
| Rayon de van der Waals | 196 pm | ||||||||||
| État d’oxydation | 3,1 | ||||||||||
| Électronégativité (Pauling) | 1,62 | ||||||||||
| Oxyde | basique | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 6,108 194 eV | 2e : 20,428 3 eV | ||||||||||
| 3e : 29,83 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide | ||||||||||
| Masse volumique | 11,85 g·cm-3 (20 °C)[1] | ||||||||||
| Système cristallin | Hexagonal compact | ||||||||||
| Dureté (Mohs) | 1,2 | ||||||||||
| Couleur | Blanc-gris | ||||||||||
| Point de fusion | 304 °C[1] | ||||||||||
| Point d’ébullition | 1 473 °C[1], 1 456,9 °C[4] | ||||||||||
| Énergie de fusion | 4,142 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 164,1 kJ·mol-1 | ||||||||||
| Volume molaire | 17,22×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 3,805×10-6 Pa à 577 K[4] | ||||||||||
| Vitesse du son | 818 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 129 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 6,17×106 S·m-1 | ||||||||||
| Conductivité thermique | 46,1 W·m-1·K-1 | ||||||||||
| Solubilité | sol. dans H2SO4 concentré chaud[5] | ||||||||||
| Divers | |||||||||||
| No CAS | [6] | ||||||||||
| No ECHA | 100.028.307 | ||||||||||
| No CE | 231-138-1 | ||||||||||
| Précautions | |||||||||||
| SGH[7] | |||||||||||
État pulvérulent :  Danger |
|||||||||||
| SIMDUT[8] | |||||||||||
Produit non classé |
|||||||||||
| Transport[7] | |||||||||||
|
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le thallium, de symbole Tl, est l'élément chimique de numéro atomique 81. Il appartient au groupe 13 du tableau périodique ainsi qu'à la famille des métaux pauvres. Son corps simple est un métal gris argenté, assez mou pour être coupé au couteau.
Le thallium est un élément « non essentiel » (il n'a aucune utilité biologique connue), en revanche il est hautement toxique, plus même que le mercure, le plomb et le cadmium[9]. Dans la nature, il est surtout présent sous la forme de sulfures et de silicates, dans certaines roches volcaniques et minerais sulfurés d'autres métaux (fer, plomb, zinc, etc.). Après altération des roches-mères en contenant, il devient assez mobile et très biodisponible dans l'eau, les sols, les sédiments et les argiles souterraines[10]. Autrefois, essentiellement piégé dans les roches profondes, il était rare dans la biosphère. Mais depuis le début de l'ère industrielle, il est largement répandu dans l'environnement par l'Homme, via l'industrie métallurgique et la combustion du charbon notamment[11]. « En raison de sa géodisponibilité, de sa mobilité, de sa dispersivité, de sa bioaccessibilité, de sa biodisponibilité et de sa toxicité pour les espèces végétales et animales »[12], il est depuis quelques décennies classé parmi les polluants émergents, persistants, devenu préoccupant à échelle mondiale dans l'eau, l'air, les sols, les écosystèmes et dans nos aliments (fruits, légumes et produits d'origine animale)[13],[11].
Le thallium est principalement présent aux nombres d'oxydation I et III. Plusieurs de ses sels (acétates et nitrates, notamment) sont très solubles dans l'eau et bioaccumulables. Ils sont également très réactifs lorsqu'ils sont exposés à l'humidité de l’air ou du sol, libérant alors — dans des conditions ambiantes — deux sortes d'ions thallium : l'ion thalleux monovalent (thallium(I), TlI, Tl+), hautement toxique, et l'ion thallique trivalent (thallium(III), TlIII, Tl3+), moins toxique mais pouvant être réduit en thallium(I).
Le thallium est désormais classé « polluant prioritaire » dans un nombre croissant de pays, notamment par l'Environmental Protection Agency américaine et par la directive-cadre européenne sur l'eau[14]. En raison de la toxicité de ce métal, ainsi que de son augmentation dans l'environnement et les aliments, des scientifiques appellent à renforcer urgemment la surveillance de ce métal, dans l'environnement et dans la chaîne alimentaire[11].
Histoire


Le thallium a été découvert par le chimiste anglais William Crookes en mars 1861 en Angleterre. Celui-ci recherchait, au moyen de la spectroscopie, du tellure dans des dépôts prélevés dans les conduits d'évacuation des fumées d'un four où du minerai de sélénium (pyrite sélinifère) avait été grillé[16]. Le spectroscope de Crookes révèle alors une ligne verte jusque-là inconnue (de longueur d'onde = 535 nm), que le chimiste a attribué à un nouvel élément[17]. Cette couleur évoquant celle d'une jeune végétation, il nomme cet élément « thallium » (qui en latin scientifique, provient du grec θαλλός thallos « bourgeon » ou brindille en herbe ; le même étymon ayant donné en français le mot thalle) et le classe d'abord dans le groupe du soufre 3.
En 1862 et 1863, les propriétés physicochimiques de ce thallium sont étudiées par Crookes[18],[19],[20] ainsi que par un autre chimiste : Claude-Auguste Lamy[15],[21],[22]. Ce dernier est le premier à isoler, en 1862 à Lille, 14 grammes de thallium métallique[23], à partir de boues de chambres de plomb d'une usine belge produisant de l'acide sulfurique. Lamy prouve aussi qu'il s'agit d'un métal.
En étudiant ce produit[15], Lamy ressent une faiblesse et des douleurs dans les jambes. Ceci le conduit à tester la toxicité du sulfate de thallium. Pour cela, il en fait ingérer par des chiens, des canards et des poules. Tous en meurent en quelques jours, après des troubles intestinaux et respiratoires, une paralysie périphérique et une faiblesse générale[21].
De son côté, Crookes met en doute la toxicité du thallium. Il affirme avoir ingéré plusieurs grains d'un composé de thallium (quel composé ?) sans en souffrir. Mais en France, deux autres chercheurs, Paulet, en 1863[24], puis Louis Grandeau, l'année suivante[25],[26], confirmeront la haute toxicité du thallium, toxicité qui s'est révélée dans leurs expériences plus élevée que celle du plomb[26].
Au XXe siècle, le thallium ne prend de la valeur qu'à partir des années 1920, quand on commence à en faire des poisons et pesticides largement commercialisés. Ces derniers seront ensuite progressivement abandonnés, mais le thallium trouve alors de nouveaux usages dans le secteur des technologies de pointe[27].
Le thallium est depuis des décennies identifié par les chercheurs comme le plus toxique des métaux lourds, mais, durant plus d'un siècle, il a été peu recherché dans l'environnement (ni dans le boissons et les aliments)[28], et il n'a suscité que peu d'intérêt dans les priorités liées à l'eau potable[29], à l'agriculture et à l'alimentation[30],[31].
Il faut attendre 2014, pour qu'en République tchèque une étude révèle que les légumes de la famille des crucifères (ex. : chou frisé, brocoli, chou-fleur) tendent à bioaccumuler des niveaux élevés de thallium1. Puis en 2019, d'autres chercheurs dosent le thallium dans 107 vinaigres balsamiques vendus dans trois pays (Italie, Espagne et Japon), pour constater que 32 % des échantillons contenaient plus de 0,01 mg/kg de thallium (limite de détection de l'étude), avec des taux préoccupants trouvés dans les vinaigres balsamiques de Modène, qui en contenaient en moyenne 0,10 mg/litre, soit plus de 10 fois le seuil de sécurité recommandée par l'Organisation mondiale de la santé. Ce thallium pourrait naturellement provenir du sol via le vin transformé en vinaigre ou provenir de l'extraction minière, et/ou de l'utilisation de pesticides en contenant des traces, ou du bois utilisé pour les tonneaux.
En France, concernant l'eau, il faut attendre le PNSE III (2018-2019) et l'interpellation par un rapport, pour que des analyses soient faites sur les captages des départements de la Manche, de l’Orne et du Calvados. Elles ont montré qu’une vingtaine de captages d'eau potable de l’Orne et du Calvados produisaient une eau contenant plus de 0,5 μg de thallium par litre. Les nappes concernées sont dans une zone de contact entre les strates géologiques du Bajocien-bathonien et le socle dans les départements du Calvados et de l’Orne, une zone naturellement riche en thallium[32]. Souvent, l'opérateur du captage ne peut que mélanger l'eau contaminée avec une eau propre en proportions, afin de descendre sous les seuils réglementaires (0,5 μg/L pour l'eau potable).
Dans les réseaux d'eau, le thallium peut s'oxyder, être fixé sur les parois de réservoirs et/ou de conduites d'eau, dont sous forme colloïdale et de biofilm bactérien ; il peut aussi décanter sous forme de particules, ou encore interagir avec le chlore utilisé pour la potabilisation[32]. De plus, des changements de débits d’exhaure, des accidents ou des travaux sur le réseau, des opérations de purges de réseau incendie, etc. peuvent rehausser le niveau de thallium dans les réseaux pour des semaines voire des mois[32].

Caractéristiques notables

C'est un métal gris, malléable, très tendre (il se coupe au couteau), qui ressemble à l'étain et au plomb et se ternit comme eux lorsqu'il est exposé à l'air.
Classification
Après sa découverte, le thallium a été difficile à classer « en raison de ses propriétés très divergentes fondées sur son état d'oxydation »[33]. Dans la classification périodique des éléments, le thallium élémentaire a des caractéristiques physiques (ex. : apparence, poids spécifique, dureté, point de fusion ou encore conductivité électrique) similaires à celles du plomb, mais si la plupart des sels de Tl(I) ont des propriétés chimiques évoquant celles du plomb, leur valence et d'autres caractéristiques les en distinguent bien. En outre, Tl(I) ressemble aux métaux alcalins dans les spectres de flamme, en termes de solubilité de l'hydroxyde et du sulfate et du carbonate dans l'eau ; ou encore car il s'oxyde aisément dans l'air ; et enfin car il peut former des « aluns de thallium »[33] ; on observe d'ailleurs un isomorphisme de certains de ses sels avec ceux du potassium, du césium et du rubidium. Cependant, « l'absence d'isomorphisme et les propriétés divergentes de plusieurs de ses sels communs ont exclu le thallium de la famille des métaux alcalins »[33].
Caractéristiques physiques
- La corrélation pour la masse volumique du liquide est donnée dans la référence[34] ;
- Des équations d'état relatives aux propriétés sur la courbe de pression de vapeur saturante sont données dans la référence[4] ;
- Des équations d'état décrivant la viscosité dynamique du liquide et du gaz sont données dans la référence[4] ;
- L'équation d'état décrivant le coefficient d'auto-diffusion du liquide le long de l'isobare atmosphérique est donnée dans la référence[4].
Le potentiel d’oxydation pour la réaction Tl(I) à Tl(III) est très faible (−1,28 V), et les halogénures Tl(I) ont une énergie de réseau beaucoup plus élevée que les halogénures Tl(III) (Lin et Nriagu 2011).
En raison d'un grand rayon ionique et un nombre de coordination élevé, pour le géologue, c'est un élément incompatible[35].
Solubilité : elle varie selon ses sels : l'acétate de thallium (jaune clair à blanc) est très soluble dans l'eau, même froide, alors que le chlorure ou d'iodure ou d'hydroxyde est peu ou pas soluble[36].
Isotopes
Le thallium a 37 isotopes connus, de nombre de masse variant entre 176 et 212, et 42 isomères nucléaires. Parmi eux, seuls deux, 203Tl et 205Tl, sont stables et constituent la totalité du thallium naturel (si l'on excepte les traces de radioisotopes naturels à faible durée de vie, issus des chaînes de désintégration des isotopes de l'uranium et des isotopes du thorium), dans un ratio 30/70. La masse atomique standard attribuée au thallium est de 204,383 3(2) u.
Le rapport entre les isotopes stables du thallium (rapport 205Tl / 203Tl) est utilisé pour identifier ou confirmer/infirmer l'origine d'une pollution ; tout en sachant que la composition isotopique du thallium (son « empreinte digitale ») dépend aussi des processus du sol (ex. : les oxydes de Mn(III,IV) spécifiques (principalement la birnessite), en raison de leur capacité potentielle de sorption oxydative de thallium, c'est-à-dire, indiquant que les réactions redox Tl sont un facteur de contrôle critique du fractionnement des isotopes stables de thallium dans les sols et sédiments)[37]. Certaines plantes (de la famille Brassica notamment) sont hyperaccumulatrices de thallium. On constate chez elle un fractionnement isotopique de thallium tout au long de la voie de translocation du sol vers le haut de la plante[37]. De nombreuses plantes cultivées peuvent ainsi se contaminer à partir des sols, de l'eau et de l'air[38] ; « Jusqu'à présent, une tendance claire a été observée avec les compositions isotopiques de Tl chez les plantes cultivées sur des sols contaminés et celles cultivées sur des sols non contaminés, indiquant l'importance du milieu de culture sur l'absorption, la translocation et le fractionnement isotopique de Tl »[37].
Dérivés organométalliques
Il en existe beaucoup.
Par exemple, uniquement en condition anaérobie (dans le sédiment en général), certaines bactéries transforment le thallium en diméthylthallium. Avec le développement des zones marines mortes, et l'importance des bouchons vaseux estuariens, l'anaérobiose semble plus fréquente sur les plateaux continentaux[39].
En 2006, on lisait encore dans Van Nostrand's Scientific Encyclopedia que « dans une liste de 65 produits chimiques trouvés dans l'eau de mer, le thallium n'apparaît pas »[40] ; pourtant, en 2000, des analyses d'eau de mer de surface et celles d'un profil de colonne d'eau effectué jusqu'à −4 000 m, ont dosé 0,5 à 3,2 ng L−1 de diméthylthallium (pour une limite de détection de 0,4 ng L−1) dans environ 20 % des échantillons, et 3 à 48 % du thallium total y était du diméthylthallium ((CH3)2Tl+,)[41].
En surface, ce diméthylthallium était corrélé à des taux plutôt élevés de chlorophylle a (indicateur de la bioactivité) et souvent à des pics d'autres composés biométhylés (triméthylplomb, le monométhylcadmium et sulfure de diméthyle)[41]. En profondeur, il était plus concentré entre 40 et 200 m (segment de bioactivité). Enfin, de 1 000 à 4 000 m, on en trouvait encore des quantités importantes[41].
Chez le rat, le diméthylthallium est moins absorbé par le tractus gastro-intestinal que Tl(I) et Tl(III), mais pour la part absorbée, il présente ensuite la même distribution subcellulaire, rénale et hépatique[42].
Abondance
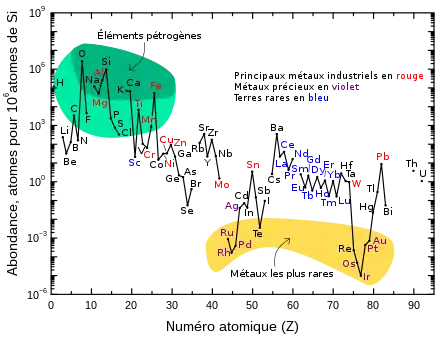
Le thallium dans le fond géochimique naturel
 crookesite
crookesite hutchinsonite
hutchinsonite lorandite
lorandite lorandite
lorandite Enneasartorite & hendekasartorite
Enneasartorite & hendekasartorite galkaite
galkaite galkaite
galkaite galkaite
galkaite galkaite
galkaite Steropesite
Steropesite Cuprostibite
Cuprostibite
Le thallium d'origine naturelle (géogénique) est largement dispersé dans la croûte terrestre et relativement rare (le 60e élément par ordre d'abondance, dans la croûte terrestre selon une estimation, mais il est moins rare que le plomb ou le bismuth selon d'autres estimations).
Sa concentration moyenne dans le sous-sol serait comprise entre 0,1 à 3 mg/kg[43],[44], ou 0,71 à 1 mg/kg selon Wedepohl (1995)[45]. Les roches ignées en contiennent plus (de 0,05 à 1,8 mg/kg) et les roches siliciclastiques encore plus (de 0,4 à 2,0 mg/kg) selon Kabata-Pendias et Pendias (2011)[46]. La part argileuse des roches sédimentaires en contient plus que les roches arénacées, et dans les schistes argileux riches en matière organique on trouve jusqu'à 1 000 mg/kg de thallium. Les calcaires et dolomies en contiennent très peu : de 0,01 à 0,15 mg/kg.
La part du thallium qui est d'origine naturelle semble stable dans l'environnement terrestre, au moins depuis la dernière grande crise d'extinction ; la part de son cycle géochimique naturel est actuellement essentiellement liée au volcanisme, à l'érosion naturelle et à son absorption dans les fonds marins. En solution, une grande partie du thallium naturel s'adsorbe sur les feuillets microscopiques des argiles[47], et en contexte très oxydant, il s'accumule volontiers dans les dépôts manganifères[47] (dont les réserves de minerai cumulées pourraient dépasser 30 milliards de tonnes)[48] ;
En contexte très réducteur, le thallium se concentre légèrement dans les schistes carbonés[47] (où l'on exploite le pétrole de schiste et le gaz de schiste).
Le thallium d'origine anthropique

Remarque : des déblais de forage à base d'eau[note 1] sont parfois aussi utilisés, mélangé à ces cendres pour faire un béton moins coûteux où les ETM sont réputés être bien inertés[49],[50],[51].
Introduit en quantité croissante dans la biosphère depuis le début de la révolution industrielle, ce thallium anthropique a plusieurs grandes origines :
- les activités extractives à grande échelle : presque toutes, et notamment l'extraction de carburants fossiles (charbon, pétrole, gaz, gaz de schiste, sables bitumineux...), ainsi que l'extraction de divers minerais dispersent du thallium dans l'environnement. En particulier, la présence de décharges internes, de haldes à résidus, de bassins de décantation minérale et de suintements très acides expliquent des teneurs, dépassant souvent de loin celles du fond géochimique, comme l'ont montré Zitko (1975)[52], Xiao et al. (2003)[53], Alpers et al. (2003)[54], Casiot et al. (2011)[55], Petrini et al. (2016)[56] ; Campanella et al. (2016)[57] ; Perotti et al. (2018)[58], Liu et al. (2019)[59]... Ce thallium pose alors « un réel danger pour divers systèmes abiotiques et biotiques, y compris les êtres humains »[12].
- l'industrie métallurgique ;
- la combustion d'hydrocarbures fossiles (charbon notamment), de bois, de charbon de bois et l'incinération de déchets contenant du thallium (puis la réutilisation des cendres et mâchefers comme amendement ou matériau de terrassement ou comblement) ;
- la production d'acide sulfurique[60] ;
- l'utilisation d'engrais potassiques ou de dérivés de la potasse[61],[62] ;
- l'érosion et l'acidification des sols : conjointement, elles libèrent du thallium, qui passe en solution vraie (sous forme de cation univalent).
La part respective des sources anthropiques et naturelles du thallium dans le réseau trophique est encore mal connue. Elle varie selon les régions, mais il y a consensus scientifique sur le fait que les apports anthropiques diffus et chroniques sont importants (dépassant de loin toute la production industrielle), et en croissance régulière. Ce thallium provient surtout de l'industrie minière et de mines abandonnées, de l'industrie métallurgique (fusion de pyrites[63], fusion et affinage des métaux), des cimenteries, des briqueteries, tuileries et d'autres installations brûlant des carburants fossiles et/ou produisant ou utilisant des cendres volantes[64] ; Dans le sol des régions industrielles, les taux de thallium peuvent atteindre 73 ppm (contre 0,08 à 1,5 ppm zones non polluées)[65].
Production
On distingue la production volontaire de l'industrie métallurgique (faible, d'environ 15 t/an) des rejets involontaires de thallium, émis par des activités humaines variées. Cette part est, de loin, la plus élevée ; elle a été, à la fin du XXe siècle, estimée entre 2 000 à 5 000 t selon Kazantzis (2000) (soit 130 à 330 fois plus que toute la production industrielle mise sur le marché), et elle croît depuis[66] (détails ci-dessous).
Production volontaire
Avant la Seconde Guerre mondiale, le thallium ne servait pratiquement qu'à produire des pesticides vendus sous forme d'appâts empoisonnés.
Sur la base de ce seul usage, alors en forte croissance, le United States Fish and Wildlife Service a déduit d'une évaluation des besoins qu'en 1942, il en faudrait 3 500 livres pour l'industrie américaine (et 7 500 livres en 1946). Pour fabriquer ces produits aux États-Unis, le thallium était pour partie importé d'Europe (Belgique, France, Allemagne et Pologne)[67]. Le reste était produit dans le pays, principalement par l'American Smelting and Refining Company, qui le récupérait dans des poussières de carneau contenant du cadmium de son usine Globe/ASARCO de Denver (Colorado), aujourd'hui devenue l'une des friches gravement polluées figurant dans la liste de priorités nationales du Superfund de l'Agence de protection de l'environnement des États-Unis[68].
La production de thallium augmente alors, le rendant disponible pour d'autres usages. Selon Breuer (1981), dans les années 1970, les pays producteurs étaient les États-Unis, la Russie, la Belgique et la République fédérale d'Allemagne, avec une production industrielle déclarée faible, de même que dans les années 1980 (pas plus de (20 t/an étaient produites vers 1980 dans le monde, selon Zartner-Nyilas et al.[69], quantité qui (selon les déclarations faites par les industriels aux autorités) serait tombée à 9 tonnes/an dans le monde en 2017 d'après un rapport publié en 2020 par Environnement et Changement climatique Canada et Santé Canada[64].
Ce métal, son minerai et ses produits sont cependant classés minerai stratégique pour la Défense et l'économie[70] et « produits à offre limitée » d'importance stratégique (c'est le cas par exemple au Canada, qui vers 1980 ne l'importe que des États-Unis[71]. Son indice de Herfindahl-Hirschman (IHH) est élevé[71].
Production comme déchet fatal dispersé dans l'air, l'eau et les sols
Une quantité croissante de thallium est rejetée chaque année dans l'environnement, où il s'accumule comme déchet fatal, et DTQD (déchets toxiques en quantités dispersées) (voir détails plus bas).
Au tout début du XXe siècle, on parlait de 2 000 à 5 000 t/an (les évaluations comptant ou non le charbon comme source géogénique), mais il est certain que cette production fatale de thallium a augmenté depuis. En effet :
- malgré les efforts de l'ONU et de nombreuses collectivités, la croissance de consommation de carburants fossiles (charbons sales, pétrole profond et gaz de schiste) n'a cessé de croître. Et le charbon n'est pas seul en cause : par exemple, dans les forages de gaz de schiste, on injecte régulièrement dans les schistes de Marcellus d'énormes quantités d'eau pour la fracturation hydraulique, à 4 000 à 8 500 pieds de profondeur[72], sous très haute pression. Or, l'eau de reflux remonte en surface anormalement chargée en 58 constituants jugés problématiques, dont des métaux toxiques dissous (radionucléides y compris)[73]. On sait depuis 2014 que, parmi ceux de ces métaux remontés à des taux au moins 10 fois supérieurs aux normes existantes pour l'eau potable, figure le thallium[73]. Et sa toxicité intrinsèque peut ici être exacerbée par d'autres polluants remontés conjointement en quantités dépassant de 10 fois ou plus les seuils pour l'eau potable (baryum, benzène, benzo(a)pyrène, chlorure, dibromochlorométhane, alpha brut, fer, manganèse, radium)[73]. Dans cet immense bassin qui s'étend sous plusieurs États, les analyses montrent que « les taux de ces produits chimiques anthropiques sont étroitement corrélés entre eux, mais ni avec les taux de chlorure, ni avec les substances inorganiques (y compris pour les radionucléides d'origine naturelle) » ;
- dans le même temps, la demande de minerais inévitablement contaminés par du thallium explose ; ainsi, le développement des véhicules électriques[74] et d'objets nécessitant une batterie lithium-ion implique d'exploiter des ressources non conventionnelles de carbonate de lithium(Li2CO3) « de qualité batterie ». Ce lithium est essentiellement produit à partir d'un type de micas, la lépidolite, qui contient un peu de thallium ; cette opération produit un déchet riche en gypse potentiellement utilisable pour produire un plâtre synthétique de qualité, mais fortement contaminé par des sels de thallium solubles dans l'eau (24,7 ± 0,9 mg/kg, soit plus de 20 fois la teneur moyenne d'un sol)[75]. Des universitaires ont testé (en 2021) l'ajout de tourbe, d'argile, de biochar et de terre végétale à ce déchet pour tenter d'inerter le thallium qu'il contient, afin de pouvoir l'enfouir dans d'anciennes galeries de mines, ou l'utiliser comme matériau de remblai pour la remise en état des mines. Un traçage isotopique des panaches de lixiviation peut être fait en étudiant le rapport 87Sr/86Sr des isotopes contenus dans ce déchet, et dans le panache[76],[77] ; ce travail montre que, parmi ces 4 matériaux, aucun ne fixe totalement ou durablement le thallium, mais l'argile et la terre végétale en seraient les meilleurs fixateurs dans un milieu drainé, et le biochar dans les milieux peu drainés (fixant au mieux ~ 95 %) du thallium soluble, après un délai de 7 jours[75].
- l'incinération des déchets ménagers et de déchets industriels ; source de thallium atmosphérique et/ou adsorbé dans les résidus de filtration des fumées, cendres et mâchefers.
Utilisations
_chloride.jpg.webp)
Le thallium a de nombreux usages :
- industrie verrière : plusieurs de ses composés sont ou ont été utilisés pour conférer un indice de réfraction élevé au verre destiné à la fabrication de lentilles ou à la production de fausses pierres précieuses[36]. Lié au soufre et à l'arsenic, le thallium peut aussi servir d'agent fondant (abaissant la température de fusion du verre à environ 150 °C)[78]. Il sert aussi dans la production de fibre de verre[64] ;
- métallurgie : ajouter du thallium à certains métaux augmente leur résistance (à la déformation mais aussi à la corrosion)[78] ; le thallium a été utilisé pour allonger la durée de vie des filaments de tungstène des lampes[36] ;
- chimie et Chimie de synthèse : le thallium y est un catalyseur ou un « intermédiaire » dans la production de produits chimiques[64] ; il est aussi utilisé comme « sonde » pour émuler les fonctions biologiques des ions de métaux alcalino-terreux[79],[30] ;
- biochimie[80] ;
- diagnostic médical ; la technique de dosage du flux de thallium par fluorescence sert à mesurer l'activité de certains canaux ioniques (par exemple pour étudier les fonctions et caractéristiques des canaux potassiques, afin de découvrir et caractériser des modulateurs de canaux ioniques d'intérêt pharmacologiques)[81] ;
- Produit radiopharmaceutique (isotope 201Tl ou thallium-201)[82] ;
- médicament (autrefois, l'acétate de thallium a été utilisé pour traiter « les sueurs des tuberculeux », puis, de 1918[83] aux années 1950 au moins, des sels de thallium ont servi à traiter divers troubles dont la tuberculose, des maladies sexuellement transmissibles, des teignes[84],[85],[86],[87]…
- thermomètre : formant avec le mercure, un eutectique restant liquide jusqu'à −60 °C, le mélange Hg (91,5 %)-Tl (8,5 %) est utilisé dans les thermomètres dans les régions très froides ;
- semi-conducteurs : La General Electric Company a utilisé le fait que Tl2S est un semi-conducteur dont la résistance électrique diminue quand la quantité de rayonnement qu'il reçoit augmente[88]. Le thallium est depuis utilisé dans les cellules photoélectriques, et comme activateur dans certains cristaux photosensibles[78] ;
- technologies de l'infrarouge : les halogénures de thallium (chlorure, bromure et iodure) étant transparents au rayonnement infrarouge, ils servent à fabriquer des fenêtres d'entrée pour les détecteurs infrarouges, notamment sous forme de sulfure Tl2S[89] ;
- éclairage et lasers : les premiers luminophores éclairant dans l'ultraviolet étaient des halogénures alcalins activés au thallium[90]. Le thallium est depuis utilisé dans certaines lampes à halogénures métalliques sous forme d'iodure de thallium (qui donne une émission lumineuse verte), dans les lampes à arc au mercure, et dans certains lasers[64] ;
- supraconducteurs (à haute température)[91],[92],[93],[94] ;
- gammadétection : le thallium est un « activateur » dans les détecteurs de rayonnement gamma (scintillomètre)[64] ;
- Le thallium 201 est un isotope radioactif se fixant notamment sur le muscle cardiaque ; il est donc utilisé en scintigraphie cardiaque pour l'étude de la perfusion ou de la viabilité myocardique ;
- Caméras de télévision : des sels de thallium sont présents dans les capteurs de type vidicon et plumbicon ;
- minéralogie, Le thallium est un composant de la liqueur de Clérici, qui sert à séparer différents minéraux[95] ;
- alliages avec d’autres métaux (dont en joaillerie)[64] ou, combiné avec Sn, Sb, et/ou Pb pour produire des alliages anti-friction, ou combiné avec du mercure pour produire des alliages à faible congélation (avec Hg)[12] ;
- antidétonants de carburant pour moteur à explosion, décrits par au moins un brevet (1926)[96], et une circulaire[97] ;
- pigments, colorants à base de thallium[64] ;
- éléments de feux d’artifice[64], de fusées de détresse[98] ;
- traceur (isotopique) permettant de suivre des pollutions ;
- marqueur isotopique d'intérêt pour la géologie et l'étude de paléoenvironnements (ex. : les isotopes sables de thallium authigène et euxinique, bien conservés dans les roches sédimentaires siliciclastiques riches en matière organique, permettent de retracer les phénomènes d'oxydoréduction du passé océanique lointain ; ceci fait du thallium un « proxy paléorédox » ; on a ainsi récemment mieux compris l'extinction de masse du Permien, la plus grande biocrise de l'histoire du Vivant, probablement due à une anoxie océanique, accompagnée d'une phase « d'enfouissement d'oxyde de manganèse, l'une des premières demi-réactions redox à se produire dans des conditions d'hypoxie » dans la Panthalassa[note 2]. Cette phase a été suivie d'un épisode de ré-oxygénation (bref aux échelles géologiques), puis d'un retour à des conditions plus anoxiques spatialement et temporellement variables, mais assez graves pour faire disparaitre 95 % des espèces marines et 70 % des vertébrés terrestres. (l'épisode de ré-oxygénationpeut pourrait être lié à un refroidissement transitoire, que les isotopes de l'oxygène semblent confirmer). « Le système-Terre a donc connu une réponse très fluctuante aux forçages liés aux volatils volcanogènes durant l'EPME ».
De la même manière, en étudiant des schistes noirs marins, on a pu confirmer l'existence d'un système océan-atmosphère à faible teneur en O2 pendant la crise d'extinction (période du Mésoprotérozoïque)[99].
Une évaluation canadienne de 2020 a aussi retrouvé du thallium dans des produits mis sur le marché dans des médicaments et produits radiopharmaceutiques destinés aux patients, et comme ingrédient médicinal dans certains produits de santé autorisés, mais aussi comme composant de certains matériaux d’emballage alimentaire[64].
Parmi ses composés les plus utilisés figurent notamment[64] :
- le sulfate de thallium(I) (TI2SO4, hautement toxique, no CAS:10031-59-1) ;
- le thallure de sodium (NaTI) ;
- l'alkoxyde thalleux ;
- l'acétate de thallium (no CAS:563-68-8) ;
- le chlorure de thallium (201TlCl ; no CAS:7791-12-0). À titre d'exemple, le Canada a évalué qu'entre 100 et 1 000 kg/an de chlorure de thallium ont été fabriqués dans le pays en 2011 (quand la limite de déclaration était de 100 kg/an). Et moins de 30 kg de thallium y auraient été importés en 2017[64].
Concentration croissante et préoccupante dans l'environnement
La croûte terrestre renferme environ 10−4% de thallium (« concentration moyenne de 0,7 mg/kg », ce qui le classe en 61e position par ordre d'importance dans la liste des éléments.
Il n'est généralement présent qu'à de faibles concentrations (de l'ordre de quelques ng/L–µg/L ou ng/kg–µg/kg)[12]. Les minéraux contenant du thallium (crokésite ou (Cu, Tl, Ag)2Se contenant 17 % de thallium), lorandite ou TlAsS2 contenant 59 % de thallium, la hutchinsonite (PbTlAs5S9), l'urbaïte (Tl2S3(As,Sb)2S3) ou TlAs2SbS5 contenant 30 % de thallium), etc.) sont très rares[78] ; on peut aussi citer des sels de soufre comme la jordanite, la gratonite, la dufrénoysite ou la sphalérite[102].
Dans les minerais sulfurés massivement extraits du sous-sol par l'industrie, on le retrouve plus concentré (ex. : dans le minerai de zinc, de cuivre, de fer et de plomb). Il est aussi présent dans les hydrocarbures fossiles, et retrouvé dans les émissions polluantes des raffineries[103].
Les mines de pyrites et leurs déchets miniers comptent parmi les sources les plus importantes de pollution par le thallium. Il y est en outre généralement associé à de l'arsenic et à de l'antimoine toxiques[104],[105],[106],[107] (ex. : 1 299 ppm de thallium en moyenne trouvé dans les pyrites de Sennari ; 1 967 ppm à Canale della Radice ; et 2 623 ppm à Fornovolasco en Italie)[108].
Ce thallium y est « dissous dans la matrice de la pyrite (…), dans des nanoparticules distribuées de manière homogène (…) sous la forme de Tl+, Sb3+, As3+ et As− (…). Tl+ pourrait se produire dans les défauts structuraux de la pyrite. La nature "lâche" du Tl dans la pyrite favorise sa perte rapide lors de la recristallisation métamorphique de la pyrite et sa redistribution dans les corps minéralisés et les roches encaissantes, avec des implications importantes d'un point de vue économique et environnemental »[108].
Les cendres de pyrite utilisées par les cimenteries peuvent aussi en contenir de grandes quantités ; les cimenteries sont une source majeure de pollution par le thallium (via les vapeurs et fumées, mais aussi les envols de poussières)[109].
Dans les régions industrialisées, tous les compartiments de l'environnement terrestre (zones humides notamment) sont touchés, comme le montrent par exemple les analyses faites sur les têtards (stade aquatique) et des crapauds (jeunes et adultes au stade « terrestre ») capturés près d'une fonderie de zinc polonaise[110].
Selon Dmowski et al. (2002), au début du XXIe siècle, environ 5 000 t de thallium étaient injectées dans l'environnement mondial[111], dont environ 1 000 t venaient de la seule combustion du charbon selon Galván-Arzate et Santamaria en 1998[112] et Querol et al. en 1995[113]. La plupart de ce thallium est remonté du sous-sol sous forme de sulfures (environ 70 %), le reste l'est sous forme d'aluminosilicates acides ou lié à des composés organiques[113]. Les sulfures de fer de l'Est de la région Silésie-Cracovie en contiennent de 80 à 10 000 mg kg-1, et les sulfures de zinc de 60 à 280 mg kg−1[114].
Dans l'environnement industriel, les scories et cendres de charbon contiennent généralement les taux les plus élevés de thallium ; quand on brûle le charbon pour fondre du métal ou produire du ciment, le thallium s'oxyde à haute température, puis une grande partie de ce thallium se condense et s'adsorbe à la surface des particules de cendres quand elles refroidissent. C'est pourquoi les cendres volantes en contiennent tant (2 à 10 fois plus que le charbon avant combustion selon Cvjetko et al. en 2010[115], selon Galba J en 1982°[116] et Finkelman en 1999[117]. Ce dernier a estimé qu'à la fin du XXe siècle, les ressources mondiales de thallium dans le charbon s'élevaient à environ 630 000 tonnes[117]. À titre d'illustration, dans les années 1990, les cendres volantes d'une cimenterie polonaise contenaient de 18 à 40 mg kg−1 de thallium[118] ; les émissions gazeuses du doublet cadmium + thallium suivies dans quatre cimenteries d'Autriche de 2009 à 2015 variaient de 0,1 à 4,5 μg/Nm3 d'effluent gazeux[119] ; les cendres du filtre des cheminées d'un four rotatif de l'usine minière-métallurgique « Bolesław » en contenaient en moyenne 882 mg kg−1 ; Kicińska en 2009 notait que les cendres d'un four de frittage en contenaient jusqu'à 5 % en poids sec[120]. Deux études brésiliennes (2004 et 2009) ont relevé dans les cendres de deux centrales au charbon de 2 100 µg kg−1 à 64 500 µg kg−1 de thallium[121],[122].
Des millions de familles se chauffent et/ou cuisent encore leurs aliments avec du charbon dont les cendres sont souvent épandues sur les potagers et les cultures avoisinantes, alors qu'elles contiennent des taux parfois préoccupants de thallium.
L'évolution des teneurs d'un milieu et/ou d'un organisme vivant en thallium dépend de nombreux facteurs[123]. Ces facteurs sont environnementaux et naturels, mais surtout anthropiques. Ils sont encore en cours d'exploration.
On savait que les microplastiques et nanoplastiques en suspension dans l'eau adsorbent, relèguent et transportent de nombreux éléments trace métalliques toxiques. Le thallium en fait partie. Il peut se fixer sur les particules de polyéthylène (PE), de polystyrène (PS) et de polypropylène, en eau douce comme dans l'eau de mer, et plus ou moins selon le pH et les cations compétitifs dans le milieu (cf. salinité). Le polystyrène aurait la capacité d'adsorption de thallium la plus élevée (via un processus de complexation de surface). Selon une prépublication chinoise « avec l'augmentation du pH, la dépronotation des groupes fonctionnels carboxyle sur les microplastiques est améliorée, ce qui augmente les sites d'adsorption efficaces et favorise l'adsorption de thallium. Mais la capacité d'adsorption des microplastiques étudiées pour le thallium est bien inférieure à la capacité correspondante des minéraux naturels (oxydes de fer et de manganèse ou issus d'argile en suspension) rapportée précédemment. Par conséquent, les microplastiques peuvent ne pas être les principaux facteurs affectant le comportement environnemental de thallium », selon une prépublication de Liu et al. (2022)[124].
Au milieu des années 2010, selon l'Institut de physique du globe de Paris (IPGP), sa spéciation et donc sa mobilité et sa cinétique environnementale, de même que ses interactions (adsorption/complexation…) avec la matière organique naturelle et les minéraux argileux sont encore mal connus, mais font activement l'objet de recherches[125].
Dans les milieux aquatiques
Dans l'eau, le thallium ionique peut avoir deux états d’oxydation[64] :
- thalleux monovalent Tl(I) (c’est-à-dire Tl+) ; TlOH et Tl2O, très solubles dans l'eau, conduisant à la formation de complexes solubles, mobiles, bio assimilables et faiblement réactifs de Tl+ avec l'ion chlorure, et un peu moins facilement avec les ions carbonate, nitrate, sulfate et la matière organique. Tl(I) est donc la forme ionique du thallium la plus mobile et biodisponible dans l'environnement, et la plus fréquente en eau douce[126]. L’ion Tl(I) « est l’espèce de thallium la plus biodisponible dans les milieux aquatiques et terrestres. La précipitation de Tl(OH)3 inerte pourrait être un mécanisme efficace pour éliminer le thallium de l’eau. Cependant, le thallium peut être remobilisé depuis les sédiments et pénétrer dans la colonne d’eau dans des conditions anoxiques où Tl(III) sera réduit en Tl(I) »[64]. ;
- thallique trivalent Tl(III) (c’est-à-dire Tl3+) qui se comporte comme un oxydant fort et se transforme facilement en Tl+[30],[126]. Tl(III) aqueux est normalement naturellement plus rare ; il ne se forme que dans des conditions très oxydantes, et il précipite facilement en hydroxyde thallique, Tl(OH)3 peu soluble[127],[128]. Mais il existe des exceptions par exemple décrites par Lin et Nriagu (1999)[129] ; Peacock et Moon (2012)[130] ; Voegelin et al. (2015)[131] ; Campanella et al. (2017)[132], notamment en mer où 80 % du thallium est du Tl(III) intégré dans un complexe anionique stable formé avec le Cl- ou OH-[133]. On en trouve aussi dans les Grands Lacs d'Amérique du Nord, où Tl(III) serait issu d'« une oxydation microbienne du Tl(I) en Tl(III), ce dernier étant complexé avec des substances organiques, inorganiques ou encore méthylé pour former le dimethylthallium ».
Sous forme de métal dissous ou organométallique, le thallium peut être capté et bioconcentré par le plancton. Théoriquement, dans un milieu riche en potassium, les organismes vivants absorbent moins de Tl(I), mais on a montré en 2004 que ceci ne vaut pas pour le diméthylthallium, et en outre, à la différence des diatomées, les Chlorella concentrent autant l'ion Tl(I) que Tl(III)[134]. les lignes directrices visant à protéger l'eau et les écosystèmes de thallium devraient tenir compte du rôle de K[135].
En 2022, la Chine est l'un des pays les plus touchés par cette pollution[136] en raison, notamment, d'accidents industriels locaux (ex. : dans le delta de la rivière des Perles)[137], mais surtout à cause du large développement des industries extractives, d'une utilisation massive de charbon, d'une grande étendue de champs et de rizières facilement polluées par le thallium[138],[139]. Les scientifiques estiment, sur la base de traçages isotopiques notamment, qu'« alors que le contrôle de la pollution par le thallium a été négligé dans le monde entier, d'innombrables polluants contenant du thallium ont été rejetés dans l'environnement, mettant en danger la sécurité de l'eau potable, des sols des terres agricoles et de la chaîne alimentaire, et posant finalement une grande menace pour la santé humaine »[140]. Le traçage isotopique du thallium environnemental montre qu'il provient en grande partie de couches géologiques plus ou moins profondes, du fait des activités humaines extractives (industrie pétrolière, industrie du charbon et « activités industrielles à haute température »), et via certaines eaux hydrothermales[140]. Ces scientifiques suggèrent de créer un monitoring de ce métal dans l'environnement. Ils serait basé sur le traçage isotopique. Il permettrait de cartographier et contrôler, et faire connaître les sources de cette pollution dans les scénarios de contamination élevée par le thallium (dans les systèmes agricoles et forestiers, dans l'eau, dans les sédiments et dans l'air)[140].
Dans les eaux de surface et de nappe, deux sources anthropiques majeures (et chroniques) sont le lessivage de déchets miniers et le drainage minier acide (qui augmente la mobilité et la biodisponibilité du thallium)[141],[142].
Ainsi, tous les sédiments analysés dans la rivière Gaofeng dans la région de Yunfu, en aval d'une zone minière active du sud de la Chine, se montrent très pollués par le thallium (de 1,80 à 16,70 mg/kg). Et dans ce sédiment, une part significative du thallium (0,28 à 2,34 mg/kg) reste présent sous des formes géochimiquement labiles, très facilement remobilisables et biodisponibles. Un traçage isotopique a confirmé que 47 à 76 % de ce thallium provient de l'exploitation minière (des pyrites) située en amont. Les auteurs appellent à mieux contrôler cette pollution et à des contre-mesures, techniques, de remédiation ciblant aussi le sédiment des cours d'eau pollués[143],[59].
Au Canada, l'analyse du profil sédimentaire de deux lacs isolés (lac Vose et lac Tantaré) indique une forte croissance des apports aériens (anthropiques) de thallium à partir de 1880 environ jusqu'à un summum (environ 10 fois le niveau antérieur) atteint en 1960 au lac Tanaé et en 1980 au lac Rose (également soumis aux retombées d'une fonderie)[144].
Selon Santé Canada (2020) : « Les concentrations chroniques estimées sans effet (CESE) du thallium pour les organismes aquatiques ont été obtenues à partir d’études d’écotoxicité fiables. L’information actuellement disponible sur la toxicité du thallium pour le sol indique qu’une CESE identique à la recommandation du CCME (Conseil canadien des ministres de l'environnement) de 1999 protège les organismes endogés et les plantes de l’environnement canadien (…) le thallium peut causer des dommages écologiques dans l’environnement aquatique en raison de son rejet par de multiples secteurs sur des sites partout au Canada »[64].
En Europe, les régions minières sont aussi touchées, dont notamment en Pologne (localement très contaminée par la combustion du charbon). Là, dans les années 1990 et au début des années 2000, les eaux fluviales en contiennent de 5 à 17 ng L−1 et l'eau de mer de 10 à 15 ng L−1[145],[146],[118],[147]. Le lac d'Ohrid en contenait en moyenne 0,5 μg L−1, contre 0,3 μg•L−1 pour des échantillons prélevés près de Ljubanista[148]. L'eau du robinet de Skopje (Macédoine du Nord) en contenait 0,8 μg L−1 en moyenne alors que celle de Silésie-Cracovie variait de 0,16 à 3,24 μg L−1[149], pendant qu'outre-atlantique, dans le Michigan, les rivières Huron et Raisin en contenaient (attention : ici échelle en nanogramme et non en microgramme) de 21 jusqu'à 2 621 ng L−1[150],[151].
Une fois dans l'eau, le thallium (III) provenant des déchets miniers tend à se transformer en thallium (I), plus toxique. En 2015, Rickwood et Huntsman-Mapila de CanmetMINING ont étudié l'« IC25 » de ce thallium (IC25 = dose de thallium qui, dans l'eau, diminue de 25 % une mesure biologique non létale (ex. : reproduction, croissance) chez des organismes utilisés pour des tests écotoxicologiques ; en l'occurrence : l'algue Pseudokirchneriella subcapitata, l'invertébré Ceriodaphnia dubia et le vertébré Pimephales promelas). Les IC25 les plus faibles étaient plus de 10 fois supérieurs aux taux le plus élevé détecté dans le milieu dans ce cas (8 μg/L) et plus de 100 fois supérieures à la recommandation actuelle (0,8 μg/L). La teneur de l'eau en certains oligoéléments exacerbe ou diminue la toxicité du thallium ; ainsi, selon les tests sur Ceriodaphnia dubia et Pseudokirchneriella subcapitata, une carence de l'eau en potassium augmente considérablement la toxicité du thallium et la CI25 se trouve alors dans la plage des concentrations signalées dans les environnements récepteurs pour le thallium (I) et (III)[64].
Sans une méthode précise et reproductible d'évaluation de la spéciation du thallium aux faibles concentrations, aucune conclusion définitive ne peut être tirée quant à savoir si les IC25 pour Tl (III) sont pertinentes aux concentrations présentes dans les environnements récepteurs. Sur la base de nouveaux résultats, une étude a recommandé que tout test de toxicité du thallium (III) utilise des solutions fraîches et préparées quotidiennement (pour obtenir une bonne récupération et des résultats précis). Les auteurs ont estimé, au vu des effets et de l'exposition, que la recommandation actuelle de 0,8 μg/L semble protectrice, mais ils ajoutent qu'une attention particulière est à accorder à la concentration de potassium du milieu récepteur lors de l'estimation de la toxicité du thallium[64].
Dans l'air
Le thallium est présent à très faible dose (ng/m3 dans les aérosols et les particules atmosphériques), ou à taux plus élevé dans les zones urbaines, industrialisées (métallurgiques et minières notamment)[14] où le thallium est émis dans l'air sous forme de poussières, de vapeurs ou de liquides, puis retrouvé dans l'air. Ainsi, dans les années 1980, les aérosols du centre-ville de Katowice en contenaient 66 μg m−3 en moyenne, et bien plus à proximité des fonderies de métaux[152],[153],[154] alors que la norme air (seuil à ne pas dépasser) est de 0,1 mg m−3 selon l'OSHA en 2015[155].
On note que depuis l'ère industrielle, les glaciers de haute montagne, qui reflètent la pollution diffuse de l'air, en contiennent de plus en plus[156], mais pas du fait des cimenteries, selon une étude isotopique récente (faite sur les sommets alpins)[157]. De même, les taux de thallium de l'urine et du sang sont en augmentation chez les ouvriers de l'industrie, et dans la population générale[31].
L'utilisation de charbon augmente en Chine et dans quelques pays en développement, mais persiste sans diminuer dans de très nombreux pays ; ainsi, en 2018, la Pologne en a encore consommé 74,2 millions de tonnes, dont 13,5 % (soit 10 millions de tonnes) l'ont été par les seuls ménages individuels[158]. Selon Eurostat, dans l'Union européenne, cette même année 2018, 226 millions de tonnes de charbon et 370 millions de tonnes de lignite ont été brûlées[159].
L'air intérieur n'est pas épargné : outre par les poêles et cuisinières au charbon, il peut être contaminé par la fumée de tabac. Dans les années 2010, l'urine des fumeurs contenaient en moyenne 10,16 ± 1,82 μg/L de thallium, contre 2,39 ± 0,63 μg/L chez les membres de leur famille ou d'amis non-fumeurs-témoins. Et la durée du tabagisme augmente la quantité de thallium urinaire. Les fumeurs qui sont aussi dépendant d'opiacés et opioïdes présentent les taux urinaire moyen de thallium les plus hauts (37,5 ± 13,09 μg/L). Chez le fumeur, l'abus d'opioïdes, l'insomnie et la bronchopneumopathie chronique obstructive (BPCO) sont de puissants prédicteurs des taux de thallium urinaire (sans différence significative chez les fumeurs de narguilé).
Une étude de 2007, faire par les CDC américains, basée sur l'analyse de 21 échantillons de cigarettes issues du trafic de contrefaçons, a montré que toutes ces contrefaçons contenaient plus de thallium que les marques originales.
La teneur de la fumée de cigarettes en thallium peut être prédite par la quantité de goudron libérée par la cigarette (et non par le taux de nicotine du tabac)[160], mais « si le fumeur compense les moindre teneurs en nicotine en fumant plus, il reste alors exposé au thallium et à d'autres métaux lourds toxiques (plomb, cadmium), qu'il fume des cigarettes ultra-légères, légères ou à saveur complète, qui sont donc alors toxicologiquement plus similaires entre elles que ce que conclut la méthode de la Federal Trade Commission américaine. »
Dans les lieux enfumés, les fumeurs passifs sont aussi concernés (des études ont mis en évidence des taux importants de métaux lourds dans l'air intérieur des cafés fumeurs (cigarette, narguilés…), ces métaux sont retrouvés en quantité bien plus élevée dans l'urine des employés de cafés exposés à la fumée, et en outre « une association positive et significative a été trouvée entre les métaux urinaires et les niveaux urinaires de 8-OHdG (un marqueur de la dégradation de l'ADN par le stress oxydatif). Les travailleurs des cafés de pipe à eau/cigarettes peuvent donc être classés comme des personnes à haut risque en termes de dommages oxydatifs à l'ADN ».
Dans les roches mères (et les nodules polymétalliques)
- Le thallium est présent dans les minéraux et les roches ignées où il prend la place du potassium[47]. Ces roches ont un taux de thallium variant de 0,05 à 1,7 mg kg−1 (selon Lin et Nriagu en 1998)[127], grimpant à 1,7 à 55 mg kg−1 dans les calcaire, marne ou granite d'après Tremel et al. en 1997[161] et jusqu'à environ 1 000 mg kg−1 dans des ardoises organiques et du charbon jurassique[105] (Yang et al., 2005).
C'est un élément hautement incompatible (au sens géologique du terme), ce qui implique qu'il ne s'intègre dans la roche qu'aux dernières étapes de la différenciation magmatique (stade de formation de roches felsiques telles que les granites ou les pegmatites, expliquant que les roches ignées alcalines et acides en contiennent bien plus que celles qui sont mafiques et ultramafiques ; ainsi trouve-t-on en moyenne de 0,75 mg/kg de thallium dans le granite, contre environ 0,1 mg/kg dans le basalte[35]. Le rayon ionique de Tl+ est semblable à celui des rayons K+, Rb+ et Cs+, ce qui explique qu'on le trouve dans les minéraux à base de potassium (K-feldspath, biotite, muscovite ou sylvite… ainsi une analyse d'échantillons de feldspath et de mica a trouvé plus de 20 mg/kg de thallium (Rader et al. 2018). Inversement, les rayons de Tl+ et Tl3+ sont trop grands pour que ces formes du thallium remplacent Mg2+ et Fe2+ dans les réseaux des deux minéraux mafiques dominants du manteau terrestre, l'olivine (Mg,Fe)2SiO4 et le pyroxène (Mg,Fe)2Si2O6, expliquant que ces derniers soient pauvres en thallium (3 à 45 µg/kg selon Jović (1993)[162]. Mais, bien qu'« incompatible », le thallium peut être redistribué lors de certains événements ignés et/ou hydrothermaux (ex. : la déshydratation minérale et l'altération hydrothermale à basse température peuvent être responsables de certaines concentrations élevées de ce métal)[163].
En zone de subduction, il subit des interactions fluide-roche intenses, sous très haute température et très haute pression (300 à 550 °C et de 1,5 à 3,0 GPa) qui expliqueraient son intégration dans certaines roches métamorphiques (par exemple observées dans les Alpes)[163].
Il est probable que thallium soit largement retenu dans les roches profondes proches de celles de la génération de magma d'arc, mais les hôtes minéralogiques de thallium changent au cours de la dévolatilisation prograde lors de séparations fluide-minéral. Le métamorphisme progressif entraîne la décomposition des chlorites à base de magnésium (minéraux proches du mica) et d'autres constituants minéralogiques mineurs, libérant du thallium porté par la chlorite, pouvant ensuite être partiellement incorporé dans la phengite et pour le reste entrainé ailleurs par des fluides[163]. L'historique des réactions minérales progrades semble important pour comprendre la rétention ou le remariage d'éléments rares tels que le thallium[163].
Le thallium se comporte géochimiquement presque comme le rubidium, faisant qu'il se concentre dans les magmas résiduels, puis retrouvé « en quantités notables dans les minéraux potassiques pegmatitiques »[47].
- Certains sulfures concentrent aussi le thallium[47], avec des taux atteignant localement 0,77 % dans la pyrite (FeS2), 5 % dans la chalcopyrite (CuFeS2), 20 mg/kg dans la galène (PbS), 1 000 mg/kg dans la sphalérite (ZnS), et associées à une métalogenèse effectuée à moins de 200 °C[164],[165],[166],[167],[30]. Dans la pyrite, par exemple, le thallium peut être incorporé dans la structure cristalline en remplacement du Fe ou en y formant des inclusions minérales nanométriques ou micrométriques. Dans un même minéral au sein d'un même gisement, le taux de thallium peut grandement varier (par exemple de 0,064 à 0,266 % en poids pour des grains de sphalérite à El Losar del Barco (Ávila, Espagne)[168] ou de 26,3 à 289 mg/kg pour la galène du gisement de Fe–Zn–Pb–Cu de Bleikvassli en Norvège[169].
- Les minéraux recherchés comme minerai de thallium sont la lorandite (TlAsS2, qui contient en moyenne 4 400 mg/kg (100 à 35 000 mg/kg) à Lanmuchang en Chine où elle est exploitée)[170] et l'avicennite (Tl2O3, exploitée à Luolong, au Tibet par exemple[171]. La crookesite (Cu,Tl,Ag)2Se, l'ellisite Tl3AsS3 et la hutchinsonite (Pb,Tl)2As2S9 sont trop rares pour être exploitées. Parfois, le thallium peut être un sous-produit (ex. : un gisement d'antimoine de Krstov Dol en Macédoine du Nord, produit de la stibine (Sb2S3) et de la berthiérite (FeSb2S4) contenant jusqu'à 0,3 % de thallium[172].
La Chine dispose des plus grandes réserves prouvées de thallium (16 000 t environ, réparties dans différentes provinces)[171], mais le gisement le plus « riche » (minerai de sulfure Sb–As–Tl) semble être celui d'Allchar (Alsar ou Alšar, en Macédoine du Nord) où on a déjà identifié 45 minéraux rares contenant du thallium (lorandite ; jankovicite Tl5Sb9(As,Sb)4S22 ; picotpaulite (TlFe2S3) ; rébulite (Tl5Sb5As8S22) et simonite (TlHgAs3S6)[173].
Dans les sols
De nombreux contextes miniers, industriels et d'utilisation intense de combustibles fossiles sont sources de pollution du sol et de l'eau du sol par le thallium.
Par exemple en Pologne, la terre végétale échantillonnée sur terrils en contient des quantités parfois très élevées (valeur médiane de 22,9 mg kg−1)[11].
En Corée du Sud, en 2015, les sols analysés près de cimenteries en contenaient 1,20 à 12,91 mg kg−1 (soit plus que dans les sols proches des mines et des fonderies, qui n'en contenaient, eux, « que » de 0,18 à 1,09 mg kg−1)[174].
Près d'Olkusz, dans le sol, sous un tas de déchets miniers vieux de 100 ans, on trouvait en 2004 un taux moyen de thallium de 43 mg kg-1, atteignant localement 78 mg kg-1[175].
La situation est pire en Chine. Par exemple dans le district de Lanmuchang[note 3], on trouve des taux atteignant 330 mg/kg dans les calcaires et les argilites. Cette région recèle aussi un important gisement de minerai de mercure-thallium-arsenic, présentant des taux de 100 à 35000 mg kg−1 dans les minerais sulfurés. Enfin, des taux de thallium de 12 à 46 mg kg−1 sont relevés dans les charbons de la région[101] (soit jusqu'à 15 fois plus que la teneur moyenne du charbon en thallium, estimée à 3 mg/kg par Koljonen en 1992[176].
Là, les minéraux secondaires issus du lessivage de sols pollués (lessivage par les pluies) en contiennent de 25 à 1100 mg kg−1, et de 32 2600 mg kg−1 dans les stériles de mines.
Les roche-hôtes altérées en contiennent de 39 à 490 mg kg−1, et 6 à 330 mg kg−1 dans les roches affleurantes.
Le sol en contient de 40 à 124 mg kg-1 dans la zone minière, de 20 à 28 mg kg-1 dans les matériaux de lessivage des pentes naturelles et de 14 à 62 mg kg-1 dans les dépôts alluviaux (en aval et à distance) contre 1,5 à 6,9 mg kg−1 dans les sols naturels non perturbés de la région (Xiao et al., 2004)[101]. Les pyrites d'origine hydrothermales peuvent contenir beaucoup de thallium (ex. : 188 mg kg-1 de thallium dans la pyrite des roches dolomitiques situées le long de sources thermales fossiles de la région de Lodares au centre de l'Espagne)[177]. Certaines plantes rares, dites « dolomitiques » (ex. : Pterocephalus spathulatus), peuvent bioaccumuler le thallium, et d'autres métaux[178].
En région calcaire, la minéralisation du substrat géologique carbonaté (minéralisation qui croît avec la température, l'acidification des sols et l'acidification des pluies, trois facteurs en hausse en raison du réchauffement climatique) est une source significative, voire très importante, de thallium dans la couche arable (0–20 cm) : à titre d'exemple, on en a retrouvé de 100–1000 mg/kg dans la zone la plus touchée, là où les concentrations dans le sous-sol montaient jusqu'à 6 000 mg de thallium par kg de roche carbonatée minéralisée, dans les horizons de sol contenant de la roche altérée (de la jarosite et l'avicennite partiellement substituées par Tl(I) (Tl2O3) ont été identifiés comme formes minérales secondaires du thallium issus d'une altération par minéralisation sulfurée Tl–As–Fe encaissée dans la roche carbonatée à partir de laquelle le sol s'est développé)[131].
Certains minéraux carbonatés sont une source longtemps sous-estimée de thallium. Par exemple, une étude de 2022 a trouvé en Chine qu'un minerai carbonaté de PbZn[179] contenait plus de 65,7 %, en moyenne, de thallium (surtout dans la fraction oxydable)[180]. Autour de cette mine, le sol s'est avéré hautement contaminé par le thallium (et par d'autres métaux lourds et métalloïdes toxiques) : avec des taux moyens de 3 655 mg/kg de plomb, 7 820 mg/kg de zinc, 100,1 mg/kg d'arsenic, 27,3 mg/kg de cadmium et 29,9 mg/kg d'antimoine (en moyenne) rendant ces sols dangereux pour les adultes et les enfants ; d'autant plus que ce thallium, avec le plomb, le zinc, le manganèse, le cobalt et le cadmium, y sont présents principalement dans leurs formes mobiles et biodisponibles[180].
Cinétique environnementale et cycle géochimique du thallium
Ils sont encore mal cernés, mais on sait que sur les terres émergées, les minéraux argileux (illite principalement) jouent un rôle majeur dans son cycle environnemental du thallium, en concurrence avec un piégeage sur des oxydes de manganèse (en mer notamment).
Dans les années 2010, diverses études ont montré que les oxydes de fer n'ont que peu d'affinité pour le thallium (Liu et al., 2011 ; Casiot et al., 2011 ; Coup et Swedlund, 2015), mais on a montré que :
- sous forme thallium(I), le thallium peut être séquestré sur certaines phases minérales[181],[130],[131],[182] selon l’ordre suivant (d'après Martin et al. en 2018)[183] : MnO2 > illite > smectite ~ ferrihydrite ~> Al2O3 ~ goethite > SiO2.
La sorbtion par une argile (illite notamment, qui le capte mieux que la smectite) serait le mécanisme dominant de « puits de thallium » dans les matériaux de la couche arable, « probablement parce que les charges de Tl du sol dépassaient la capacité de ce mécanisme d'absorption »[131]. Comparées aux autres phases minérales porteuses de thallium, les argiles se classent comme suit :
MnO2 > illite > smectite ∼ ferrihydrite ≥ Al2O3 ∼ goethite > SiO2.
Cependant, « les interactions échangeables et réversibles entre Tl+ et les sites réactifs des argiles suggèrent que dans des conditions changeantes, ce thallium pourrait être libéré en solution »[183] ;
- sous forme Tl(III), le thallium est surtout immobilisé dans les oxydes de manganèse[183].
Le taux de thallium dans les échantillons de CaCl2 10 mM croissent avec l'augmentation du taux de thallium dans le sol et avec la diminution du pH du sol (acidification), mais sans variations drastiques selon la Spéciation chimique du thallium[131].
Certaines catastrophes naturelles (éruptions, séismes, ouragans, raz de marée, inondations) sont aussi des sources d'apports supplémentaires de métaux toxiques dans les sols (ainsi, à la Nouvelle-Orléans en Louisiane, 43 % (9/21) des sols de cours d'école échantillonnés avant l'ouragan Katrina présentaient plus de 400 mg par kg de plomb ; après l'ouragan Rita, deux de ces sols dépassaient 1 700 mg par kg. Et les seuils de l'USEPA-RSL pour le thallium étaient dépassés dans tous les échantillons prélevés dans cinq cours d'école après l'ouragan Rita[184].
Les sols forestiers et de prairies ne sont pas épargnés (par exemple en République tchèque où en 2009 Vanek et al. y ont trouvé de 0,56 à 1,65 et de 1,1 à 2,06 mg kg−1 respectivement en forêt et en prairie)[185].
L'agriculture industrielle et intensive, ainsi que le labour et l'érosion qui lui est associée, ont causé d'énormes pertes de matière organique (M.O) dans les sols du monde entier, avec parfois des effets de salinisation ou de désertification.
Or, on a montré en 2012, en Chine, que dans les sols rouges et plus encore dans les lœss (sols très recherchés pour leur haute productivité agricole), cette perte de M.O induit une désorption du Tl+ qui était antérieurement inerté dans la M.O. Le relargage de thallium est proportionnellement plus important dans le sols qui en contenaient le plus[186]. En détruisant artificiellement la M.O d'un sol rouge, il relargue 24,7 % du thallium qu'il contenait (et 28,2 % dans le cas d'un lœss) ; le lœss perd alors jusqu'à environ 20 % de sa capacité à fixer le thallium[186]. « La contribution de la MO à l'adsorption de Tl+ par le lœss et le sol rouge était de 39,2 % et 32,8 %, respectivement. (…) Quand la concentration initiale de Tl+ était de 20 mg/L, le taux de désorption augmentait à 60,8 % et 65,5 % pour le sol rouge et le lœss, respectivement »[186]. Les phénomènes d'acidification des pluies et des sols facilitent en outre la désorption du thallium, le rendant plus biodisponible (comme pour les autres métaux et métalloïdes).
Toxicité, écotoxicité

Un toxique longtemps ignoré
Le thallium est particulièrement toxique sous forme de sulfate, d'acétate, de carbonate, de nitrate/nitrite, et moins sous forme de sulfite ou d'iodure qui sont bien moins solubles et donc moins biodisponibles[187].
Vers 1920, le groupe Bayer crée un puissant rodenticide (« pâte Zelio », « granulés Zelio ») contenant environ 2 % de sulfate de thallium[188].
Outre-atlantique, on s'en inspire en créant un autre rodenticide contenant deux fois moins de thallium (1 % de sulfate de thallium), mais tout aussi efficace. Baptisé « Thalgrain », il est préparé et délivré par des agences officielles dans dix comtés de Californie, dans le cadre d'un programme d'éradication des spermophiles de Californie[189] (Otospermophilus beecheyi, écureuil terrestre jugé par le département de l'Agriculture indésirable dans les champs, où il se montrait étonnamment résistant à la strychnine)[36]. Il est aussi utilisé pour lutter contre le Chien de prairie[36].
Cette campagne induit alors une épidémie d'empoisonnements humains par ce rodenticide[36].
Des patients ayant utilisé des produits pharmaceutiques ou cosmétiques thalliés (ex. : crème dépilatoire[190]) ou ayant été en contact avec le Thalgrain présentent, à divers degrés, tout ou partie de ces symptômes.
La production de Thalgrain était faible en 1925. Elle croît jusqu'en 1928, puis diminue après la mise sur le marché d'une alternative plus sûre : le coumaphène (= warfarine ; C19H16O4), et après qu'il soit devenu évident que ce poison tuait de nombreuses espèces non-cibles. Il tuait aussi des animaux d'élevage comme le mouton[36], ainsi que des oiseaux sauvages, et des espèces-gibier[191]. Les animaux nécrophages et décomposeurs peuvent eux-mêmes ensuite être mortellement empoisonnés par le thallium (qui n'est pas dégradable).
Les pesticides au thallium sont aussi de plus en plus impliqués dans des cas de suicides et d'homicides, involontaires ou volontaires[187].
En 1924, une première étude pharmacologique poussée du thallium est donc lancée par le Bureau of Biological Survey, sur le modèle animal. Elle permet de commencer à comprendre le mécanisme toxique du thallium, et lui trouve même un antidote. Plusieurs autres études sur la thallotoxicose sont publiées dans les années 1930 par la revue JAMA[192],[193].
Au XIXe siècle, Marme, puis Swain et Bateman, avaient déjà prouvé que le thallium est aussi un toxique cumulatif (ex. : plusieurs petites doses fractionnées sur 13 jours ont un effet similaire à la même dose distribuée en jours)[194].
Ses usages médicaux et cosmétiques (crèmes ou onguents dépilatoires) ont par ailleurs tué au moins 600 personnes (pour ne citer que les cas scientifiquement documentés) et empoisonné un grand nombre d'autres personnes, dont certaines ont conservé de graves séquelles physiques et/ou mentales[36]. Durant les années 1920, le principal usage médical, qui s'est rapidement développé pour devenir courant, était l'épilation générale d'enfants pré-pubères, bien nourris et en bonne santé, dans le cadre de procédures de traitement de teignes et d'autres dermatophytoses[187]. Durant un certain temps, les médecins estimaient qu'à raison de 8 mg/kg (délivrés sous forme de tablettes à ingérer, contenant de l'acétate ou du nitrate de thallium soigneusement dosé, sous contrôle médical[195], et avant la puberté), ce traitement était justifié et assez bien toléré par l'enfant pré-pubère. Mais une revue d'étude publiée en 1947 n'a pas validé cette assertion[36].
Le thallium est présent dans le charbon (et ses cendres), dans les déchets miniers, comme dans de nombreux effluents industriels, généralement associé à d'autres métaux très toxiques (plomb, arsenic, mercure et cadmium notamment). Or, dans une grande partie du monde :
- des millions de familles et d'individus se chauffent encore au charbon dans des habitations mal ventilées, et cuisent parfois leurs aliments directement sur un foyer alimenté par du charbon ; et il n'est pas rare que les cendres soient utilisées comme amendement au potager. Ceci expose les habitants à un cocktail délétère plomb-cadmium-arsenic-thallium (« effet cocktail »). Ce danger semble être passé inaperçu durant plus d'un siècle ; il faut attendre 2018 puis 2021 pour que soient publiées deux études polonaises, la première détectant en moyenne 500 µg de thallium par kilogramme de cendre[196], et la seconde, pour 52 échantillons de cendres provenant de différentes qualités de charbons utilisés par des ménages chez eux, montrant, dans tous les cas, des taux élevés d'arsenic, de cadmium, de plomb et de thallium, ainsi que des corrélations entre les taux de ces éléments toxiques, le pH et la qualité du charbon. Les taux atteignaient 50 900 µg/kg de cendre pour l'arsenic ; 43 500 µg/kg pour le cadmium ; 128 900 µg/kg pour le plomb et 6 660 µg/kg pour le thallium l'ont été par les seuls ménages individuels… ces taux sont à mettre en relation avec la quantité de charbon encore utilisée pour les cuisinières et chaudières individuelles en Pologne en 2018 (environ 10,0 millions de t/an)[158]. Ils sont en outre comparables à ceux de certains déchets industriels dangereux[197].
- Les déchets de crassiers (terrils) de charbon et de cendres volantes issues de la combustion du charbon ont été très largement utilisés comme matériau de remblai, de terrassement ou auxiliaire (dont dans la construction de routes et la production de béton)[198],[199].
On sait par contre qu'un antagoniste du thallium est le potassium[200] (ainsi, en présence de potassium dans le sol, le thallium est moins bioassimilé par les plantes)[201].
Effets toxiques ; Symptômes de la « thallotoxicose »
Chez l'Homme
À faible dose, le thallium produit un groupe de symptômes : alopécie (2 à 3 semaines après l'intoxication aigüe), stomatite, gastro-entérite avec vomissement, diarrhée et constipation avec anorexie, perte de poids ; névrite périphérique, névrite rétrobulbaire ; douleurs et crampes dans les jambes, paresthésies douloureuses des mains et des pieds, souvent accompagnées de faiblesse musculaire et d'une perte du réflexe du tendon d'Achille ; troubles endocrinologiques ; trouble du sommeil et fatigue, dépression ; rire hystérique et délire parfois, cyanose, hypertension avec tachycardie, bradycardie, convulsions, coma et éventuellement mort[202],[36],[203]. On signale parfois aussi une salivation anormale. Après quelques jours, on peut aussi observer une « pigmentation cutanée »[204]. Plusieurs études l'ont aussi associé à certains types de diabète[205]. De nouvelles études de 2020, tendent à montrer son lien avec les troubles du déficit de l'attention ou TDAH, une dérégulation de la dopamine.
Chez l'animal
Les mammifères semblent présenter globalement les mêmes effets (stress oxydant, apoptose et inflammation…) que l'humain, attribués aux mêmes mécanismes.
Comme le plomb, à très faible dose, le thallium semble pouvoir induire une agressivité : une étude publiée en 2022 a exposé la perche du Nil à un niveau très faible (sublétal) de thallium (41,9 μg/L, soit un dixième de la CL50 à 96 h) durant deux mois. Cela a « augmenté le comportement agressif des poissons, en lien avec la réduction des niveaux cérébraux de sérotonine, de GABA et de neurotransmetteurs, (…) a réduit les activités de la Na+/K+-ATPase et des acétylcholinestérases (AchE) ». L'activité de la catalase (CAT) a diminué dans le cerveau, pendant que les marqueurs de stress oxydatif (protéine carbonyle ; PC et malondialdhyde ; MDA) augmentaient, de même que l'expression des gènes liés au stress (P53, Caspase-3 et HSP70), dans le cerveau des poissons. On a montré à cette occasion qu'une co-supplémentation d'extraits d'astragale (plante très utilisée en médecine traditionnelle chinoise, à 0,30 % de l'alimentation des poissons) a significativement diminué les effets toxiques du thallium[206].
Cas particulier de l'intoxication chronique
Dans les années 2010, les effets de l'intoxication chronique du corps humain par de faibles doses de thallium (cas de plus en plus fréquent, en Chine notamment) sont encore mal documentés et mal compris.
Mais comme pour le plomb, les enfants y semblent plus vulnérables, avec des effets systémiques se manifestant par des dégâts sur diverses fonctions (hépatique, rénale et cardiaque), même à un niveau d'exposition « subclinique »[207].
Chez des enfants suivis durant quatre ans après un traitement ayant fait chuter leur taux de thallium urinaire (initialement de 13,4 μg/L à 60,1 μg/L) sous les 5 μg/L, ces effets indésirables s'étaient atténués pour le foie et les reins (mais ces deux organes n'étaient toujours pas complètement rétablis). Par contre, les effets perduraient, voire s'étaient aggravés avec le temps pour le cœur[207]. Jusqu'en 2020, l'OMS estimait manquer de données pour évaluer avec certitude le risque pour l'enfant dans la plage de 5 à 500 μg/L de thallium dans l'urine ; les auteurs de cette étude estiment que chez l'enfant, même 5 μg/L n'est pas un seuil sécuritaire pour la santé, et qu'au vu de l'accroissement de l'exposition de la population au thallium dans le monde, « il est urgent d'établir des limites de sécurité plus strictes pour ce métal » ; ils appellent l'OMS à « accorder plus d'attention aux effets néfastes du thallium sur la santé des enfants »[207].
Séquelles
Parmi les séquelles décrites :
- chez les survivants (adultes) d'intoxications tardivement traitées en hôpital figurent dans certains cas un engourdissement chronique des jambes, et dans un cas, l'apparition d'une thrombose veineuse profonde de la jambe[204]. Quelques cas de séquelles mentales (schizophrénie) ont été évoqués.
- Si l'intoxication s'est produite in utero, les séquelles pour le futur enfant seront neurocomportementales, comparables à celles d'une intoxication embryonnaire ou fœtale par le plomb[208], et plus marquées chez les garçons[208],[209] ;
- Si l'intoxication a touché l'enfant : le foie et les reins, mais surtout le cœur pourraient conserver des séquelles[207]. Une étude in vitro avait en 1978 conclu que l'ion Tl+ est toxique pour les muscles squelettiques (blocage préférentiel du nerf phrénique ou de la jonction neuromusculaire sur la fibre musculaire) et pour le cœur avec des effets « probablement irréversibles » selon l'auteur[210].
Enjeu de santé environnementale

Les suivis environnementaux montrent que le thallium est de plus en plus présent dans l'air et la biosphère, avec des pics locaux préoccupants (par exemple dans les aliments cultivés près des cimenteries allemandes). Dans les régions industrielles, certains aliments approchent ou dépassent déjà des seuils de toxicité ; par exemple, dans le lac Michigan où l'on trouvait en 2001 de 5,9 à 70 ppm de thallium[62], les truites grises (Salvelinus namaycush) en présentaient des taux (~0,6 nmol g-l de poids humide) potentiellement dangereux pour ceux qui en consomment souvent[211].
La combustion du charbon et de carburants fossiles est l'une des sources majeures de ce thallium.
Or, le thallium est un élément non-essentiel, encore plus toxique pour l'homme que le mercure, le cadmium ou le plomb. Sa DL 50 orale varie beaucoup selon l'espèce (de 5 à 150 mg/kg), et elle serait de 8 mg/kg pour l'Homme[212].
Sa concentration maximale admissible a été fixée à 0,1 mg/ml)[213],[31].
Il a une affinité pour les fonctionnalités sulfhydryle dans les protéines[214], et il perturbe notamment la formation de l'adénosine triphosphate (ATP), une molécule vitale pour toutes les espèces animales connues[10]. Il cause de nombreuses intoxications accidentelles, professionnelles, criminelles ou thérapeutiques depuis sa découverte (1861)[31]. Comme ses voisins chimiques (mercure et plomb), il fait partie des métaux lourds et, comme eux, c'est notamment un neurotoxique cumulatif du système nerveux central des mammifères. Selon le modèle animal, même à faible dose (sub-toxique), il perturbe aussi le fonctionnement musculaire[215], et il se montre hépatotoxique chez l'être humain[216], reprotoxique (facteur de délétion de la spermatogenèse)[65] et cardiotoxique[217].
In vitro, il interagit négativement avec les phospholipides membranaires de liposomes, ce qui laisse penser qu'il peut altérer les qualités physiques de membranes cellulaires. Et ceci pourrait contribuer à ses effets neurotoxiques[218].
Il se comporte chimiquement comme le plomb et l'argent, mais aussi comme certains métaux alcalins tels que K, Rb, et Cs ; dans les organismes, l'ion thallium(I) (Tl+) se substitue facilement au potassium ionique K+[65]. Sa toxicité et celle de tous ses composés semble principalement liée à la similitude des rayons ioniques de K+ et de Tl+[219] faisant qu'il perturbe ou bloque des processus métaboliques vitaux dépendants du potassium[220], induisant notamment une peroxydation des lipides[221] et un dysfonctionnement mitochondrial[222]. Le thallium induit aussi un important stress oxydatif[208].
Dans les eaux naturelles, il est surtout présent sous forme de cation monovalent très soluble. Le thallium et ses composés « présentent une solubilité dans l'eau plus élevée que les autres métaux lourds »[11], ce pourquoi les poissons, notamment, y sont très vulnérables[223]. Ces cations sont donc facilement et communément transportés dans les différents compartiments de l'environnement et de la chaine alimentaire par l'eau (notamment à partir d'effluents de mines de métaux de base, mais il est pas ou mal éliminé par les méthodes traditionnelles de traitement des métaux lourds dans les eaux usées[31] (de nouvelles techniques d'épuration du thallium sont recherchées et testées)[224]. Certains le considèrent comme l'un des risques cachés mais préoccupants pour l'environnement et la santé[101].
| - | Seuil de sécurité pour le thallium environnemental | Source |
|---|---|---|
| Eau potable | 2 μg par L | USEPA (2015)[226], Xiao et al. (2004) |
| Sol arable | 1 kg−1 | CCME (2003), Xiao et al. (2004)[101] |
| Végétal | 0.008–1.0 kg−1 | Kabata Pendias et Pendias (1992)[118] |
| Plantes alimentaires | 0.03–0.3 mg kg−1 | Kabata Pendias et Pendias (1992)[118] |
| ADI (average daily intake) | 2 μg jour−1 | Sabbioni et al. (1984)[227], Xiao et al. (2004)[101]. |
| seuil oral (Oral reference dose) | 0.056 mg jour−1 | Risk Assessment Information System (RAIS, 2003[228] (2003) Toxicity profiles ; Xiao et al. (2004)[101] |
Selon F.F Heyroth (1947), comme cet élément n'est pas normalement présent dans les tissus sains, le fait d'en détecter aussi peu que 0,5 mg pour 100 g doit faire penser à une intoxication au thallium. Entre 0,5 et 10,0 mg pour 100 g de tissus, on parle d'intoxication subaiguë à mortelle[36].
Plus récemment, l’Agence fédérale allemande de l'environnement a produit une « valeur guide » (à ne pas dépasser pour la santé humaine, valeur utilisée pour la biosurveillance humaine) : 6,4 µg/g de créatinine[64].
Chez l'Humain
À titre d'exemple issu de la littérature médico-légale (publié en 2020), un couple hospitalisé à Milan s'est avéré contaminé par du thallium ; une enquête judiciaire a conclu qu'au domicile, seule le dessous des chaussures du père présentait des traces de poudre de thallium (utilisé illégalement par le fils dans une parcelle cultivée où le père allait quotidiennement aider son fils) ; le père aurait ainsi accidentellement contaminé son environnement intérieur, s'intoxiquant lui-même ainsi que son épouse[229].
Il a été utilisé comme poison car, réduit en poudre, ses sels sont pour la plupart inodores, incolores et avec une dose létale très basse (moins de 5 mmol ; un peu plus de 1,5 milligrammes de thallium par kg de masse corporelle suffit à tuer un humain[11]. Les usages du thallium comme insecticide[230], et comme formicide (pâtes et sirops contenant du thallium utilisés dans les années 1920 pour tenter d'éradiquer certaines espèces de fourmis dans le sud-ouest des États-Unis)[231] ou mort aux rats tendent à disparaître, notamment depuis que son effet toxique pour l'homme est démontré, mais ce métal est encore localement utilisé pour cela et continue à s'accumuler dans l'environnement alors qu'il est ni biodégradable ni dégradable.
Chez l'Humain, le thallium « cible » principalement les os, les reins, le foie et le système nerveux, en y perturbant notamment le métabolisme des acides gras, les fonctions de plusieurs enzymes vitaux, avec comme conséquences les plus communes des ulcères gastriques et intestinaux, l'alopécie, des polyneuropathies, ou encore des troubles « astraux », insomnies, paralysies, amaigrissement, hémorragies internes, lésions myocardiques pouvant conduire à la mort[31],[232],[112].
L'élévation des taux de thallium chez la femme enceinte s'accompagne d'un risque accru de faible poids à la naissance[233] et de risques de dégâts irréversibles en termes de fonctions intellectuelles (mémoire[234] et intelligence cognitive en particulier)[235].
En médecine nucléaire, une accumulation de thallium-201 a été notée dans tous les sites d'ossification hétérotopique dans les cas de myosite ossifiante et de sarcome ostéogénique extra-osseux[236].
Perturbateur endocrinien, reprotoxique
Aux niveaux environnementaux actuellement mesurés dans les régions industrialisées, le thallium affecte le système endocrinien et la santé reproductive. Ainsi :
- chez la femme, dans la province du Zhejiang, en Chine, un taux de thallium urinaire élevé a été significativement associé à un risque accru de ménopause prématurée (ou 'insuffisance ovarienne prématurée') ; ainsi qu'à une augmentation des taux sériques d'hormone folliculo-stimulante et d'hormone lutéinisante, pendant qu'inversement, l'hormone anti-mullérienne et l'estradiol diminuent[237] ;
- on a montré dans les années 1980 qu'il est aussi reprotoxique chez le rat mâle (induisant une atrophie et une toxicité testiculaire)[238],[239], aboutissant à une délétion de la spermatogenèse, selon A. Buschke en 1922[240].
Élément mutagène, génotoxique, cancérogène ?
À la fin des années 1990, très peu de données étaient disponibles sur ces aspects pour les divers composés du thallium et le thallium-métal, ou ces données ne permettaient pas une évaluation fiable de ces trois risques (risques peut-être peu étudiés car éclipsés par la haute toxicité du thallium et de ses sels).
- Mutagénicité : Le potentiel mutagène de Tl et de ses composés est controversé. Cependant, ce métal a des propriétés tératogènes identifiées, dont sur la formation de cartilage et de l'os (achondroplasies observées chez le poussin[241] pour des doses de 0,4 à 1,2 mg de sulfate de thallium chez des embryons de poulet aux jours 4 à 11 d'incubation, plus que chez les mammifères[242] ; la cause semble être « lié à une inhibition de la synthèse des mucopolysaccharides »). En 2022, les études in vivo et in vitro déjà réalisées confirment un effet mutagène, mais faible. Les composés du Tl modifient la progression du cycle cellulaire, mais (à cette époque) sans preuve forte de dommages primaires et irréversibles à l'ADN, ou de dommages chromosomiques[243]. On n'a pas signalé d'effets mutagènes dans les lymphocytes de patients exposés au thallium-201 par la médecine nucléaire[244].
- Génotoxicité : En 2012, Rodríguez-Mercado et Agustín avaient montré que les différentes formes de thallium ont des effets sur le génome des cellules eucaryotes et procaryotes, mais encore à explorer[243].
En 2017, ces chercheurs ont exposés cette fois (in vitro) des lymphocytes humains à diverses concentrations de thallium I et III ; Les tests d'anomalie chromosomique montrent que le sulfate de thallium(I) « réduit l'indice mitotique à toutes les concentrations testées (0,5, 1, 5, 50 et 100 μg/mL), tandis que le chlorure de thallium(III) est toxique à des concentrations ≥1 μg/mL. Le traitement au thallium (I) et au thallium (III) a augmenté de manière significative les aberrations chromosomiques structurelles, avec et sans lacunes, et a augmenté le pourcentage de cellules aberrantes sans lacunes »[245]. Les deux états d'oxydation du thallium ont donc effectivement des effets cyto/génotoxiques (clastogènes et aneuploïdogènes, c'est-à-dire provoquant respectivement des cassures de l'ADN et un nombre anormal de chromosomes dans la cellule)[245], ce qui peut éventuellement faire évoquer un effet également cancérigène. En 2021, des tests ont montré une génotoxicité de l'acétate de Tl (TlCH3COO) et du sulfate de Tl (Tl2SO4) sur le modèle animal Drosophila melanogaster, mais uniquement pour des expositions à des doses élevées [600 μM] de Tl2SO4 (avec alors 87,6 % de recombinaison somatique) ; ces deux sels ont perturbé la division cellulaire, confirmant les effets cytotoxiques attendus[246]. « Les risques génotoxiques dus à des niveaux élevés de métaux par bioaccumulation de Tl+1 ou de ses composés nécessitent une évaluation plus approfondie avec d'autres tests in vivo et in vitro »[246].
- Cancérogénicité : Le thallium ne pouvait pas être classifiable en termes de cancérogénicité, faute d'études pertinentes sur l'homme ou l'animal de laboratoire. Quelques expériences évoquent que le trichlorure de thallium, seul sel trivalent stable de thallium, pourrait même avoir une activité antitumorale[245].
Quelques statistiques
En moyenne :
- ingestion : au XXIe siècle, un adulte moyen ingère environ 2 ppb de thallium par jour selon Wallace (2015)[247], et moins de 5 μg/j (venant surtout des aliments) selon R. Blain (2022)[9] ;
- teneur corporelle : le corps d'un américain moyen en contient environ 0,1 mg, selon Lansdown (2013, ou en moyenne 0,051 mg par kg de masse corporelle[248].
Taux de thallium dans quelques organes : 0,42–1,5 ng/g (cerveau) < 1,5 ng/g (foie) < 6,1 ng/g (rein) < 7–650 ng/g (cheveux, pilosité) < 0,6 μg/g (squelette) < 1,2 μg/g (ongles)[147].
Le thallium s'accumule préférentiellement dans les organes périphériques[249],[250] (dont les phanères qui, comme pour d'autres métaux toxiques (plomb, mercure), peuvent continuer à éliminer une partie du Tl ingéré) ; - excrétion : la majorité du thallium non-fixé dans le corps est excrétée via l'urine et, moindrement, via les fèces ; les analyses d'urines sont donc considérées comme utiles pour évaluer le degré de contamination d'un corps humain. Le thallium urinaire est normalement inférieur à 1 μg/g de créatinine[247]. Chez l'Homme, les taux urinaires médians et pour le 95e centile de thallium sont de 0,21 et 0,55 µg/g de créatinine chez les Canadiens. Le thallium est détecté dans l'urine après 1 h et jusqu'à 2 mois après l'exposition[247]. Chez le rat de laboratoire sain, la demi-vie biologique du 204Tl a été évaluée à 3 à 4 jours. Chez l'homme, il est retrouvé dans l'urine et les matières fécales durant plusieurs semaines après l'absorption[9] ;
- taux sanguin de thallium : en 1994, Sabbioni et al. ont proposé comme intervalle de référence provisoire pour le thallium sanguin : 0,014–0,190 μg/l[251]. Il y a toxicité à partir de 100 μg/l (Lansdown 2013) ; Le taux sanguin atteint 3 μg/l, pour des valeurs de référence calculées comme comprises entre 0,15 et 0,63 μg/l dans le sang et 0,02–0,34 μg/l dans le sérum ; le sang d'un européen moyen en contient 0,063 μg/l[252] ;
- taux urinaire de thallium : c'est un des moyens rapides et courants d'évaluer l'exposition humaine récente ou chronique[253]. La collecte d'urine de 24 heures est recommandée pour tenir compte de la variation diurne, et du fait que le pic d'excrétion varie en fonction des habitudes/moments d'hydratation et de consommation[252]. Au-dessus de 20 μg/l, il y a exposition excessive[254], et au-dessus de 200 μg/l, il y a empoisonnement [254],[255]. L'urine d'un Européen moyen en contient 0,066 μg/l[252]. En 1994, Sabbioni et al. ont proposé comme intervalle de référence provisoire pour le thallium urinaire : 0,019–0,170 μg/l[251] ;
- phanères (ongles, griffes, cornes, poils et cheveux): chez une personne dite non exposée, on trouve trois fois plus de thallium dans ses ongles que dans ses cheveux[248] (cheveux qui sont moins bon indicateur d'une contamination en cours que l'urine)[252]. Le taux de Tl des phanères reflète celui de l'environnement et/ou de l'alimentation de la personne[57], mais celui des cheveux peut être difficile à mesurer dans les cas de très faibles doses d'exposition de l'organisme[252]. Selon le manuel de toxicologie de Robyn Blain (ed. 2022), les cheveux, « chez les sujets non exposés, contiennent la plus forte concentration de thallium de tous les tissus (...). Chez le rat, 21 jours après l'administration par voie parentérale ou orale, jusqu'à 60 % de la charge corporelle restante a été retrouvée dans les poils »[9] ;
- dans l'air : le taux « habituel » de thallium dans l'air inhalé se situe entre 5 et 10 ng/g[256] ;
- en 2015, Ghaderi et ses collègues constatent une nette augmentation du thallium dans le corps des consommateurs d'opioïdes : en moyenne 21 μg/l, contre 1 μg/l chez le groupe témoin[257].
Absorption, distribution et excrétion
Le phosphate de thallium est 50 fois plus soluble que le phosphate de calcium, mais contrairement au plomb, le thallium n'a pas une grande affinité pour l'os[36].
La peau et les muqueuses digestive et respiratoires sont rapidement et très facilement traversées par plusieurs sels de thallium (sulfate de thallium notamment pour lequel Bonani et Marino ont montré dès 1906 (sur des lapins et chiens) qu'il commence à être absorbé dès le niveau de l'œsophage[258]. Et il y a plus de 100 ans, en 1869 Jones avait noté qu'on le retrouvait dans l'urine dans les 2 heures après ingestion[259] ; et en 1890) le médecin californien J. Blake, le retrouvait dans les poumons du lapin expérimentalement exposé à du sulfate de thallium par intraveineuse, dès les premières minutes suivant l'exposition[260].
Gettler et Weiss ont estimé à partir de six chiens et un cas humain étudié, que par unité de poids, les reins, le pancréas, la rate et les muscles contenaient plus de thallium que le foie ou d'autres organes[36].
Chez l'homme comme chez l'animal, la totalité du thallium n'est cependant que lentement évacuée (ainsi lors de l'épidémie d'intoxication en Californie, l'urine des patients en contenait encore 3 semaines après l'intoxication bien que chez deux d'entre eux, le taux urinaire de thallium a atteint 2,39 mg/litre. L'urine d'intoxiqués chroniques en contient durant 2 mois environ.
Chez des humains mortellement empoisonnés, on retrouve des concentrations de 3 à 11 parties par million dans les reins, le foie, les poumons, le cœur, la rate, les intestins et les os[36].
Chez un homme, on a mesuré 3,3 mg de thallium pour 100 g de foie ; 1,6 mg pour 98 g de rein, contre 5 mg pour 100 g d'urine.
Olmer et Tian ont mesuré (spectroscopiquement) 1 partie par 50 millions de thallium dans le liquide céphalorachidien d'un homme gravement empoisonné par du thallium ; et après avoir retiré de l'échantillon les cellules par centrifugation, la quantité a été réduite à un dixième de sa valeur antérieure. Le métal s'accumule aussi en petites quantités dans la peau et les cheveux[36].
Shaw et Lansbury ont estimé que les rats ayant reçu des doses sublétales répétées excrètent quotidiennement environ 0,4 mg. de thallium par kilogramme de poids corporel ; et le lait de femelles rates allaitantes intoxiquées par une dose létale de thallium en contient assez pour retarder ou arrêter la croissance des poils et pour inhiber la croissance et le développement des petits, (mais pas pour les tuer)[36]. Shaw, chez des oies empoisonnées (par ingestion de 20 mg/kg de poids corporel de thallium), mortes en 15 jours, leurs tisssus contenaient encore 35 à 70 % du thallium ingéré. Chez le chien, il faut 36 jours pour que l'urine évacue environ 60% de la quantité ingérée[36].
Teneurs dans l'environnement, cinétiques environnementales et tendances
Le thallium pur est à priori rarissime à la surface de la Terre, car il s'oxyde très facilement et réagit avec l'eau, mais il a été signalé pour la première fois dans des sublimés d'émissions gazeuses volcaniques (ceux du volcan Momotombo) par Quisefit et al. en 1989[261].
On le trouve par contre sous forme de nombreux composés inorganiques (hydrures, fluorures, chlorures, bromures, iodures ou halogénures mixtes tels que le dichlorofluorure de thallium(III) (TlFCl2•3H2O), des oxyhalogénures, des oxydes, des hydroxydes, des chalcogénures, des sels avec des oxoanions, etc.)[262], Jones et Stasch 2011).
De nombreux composés organothalliens existent aussi, dont les dérivés bisubstitués (R2TlX) qui sont les plus stables selon Haiduc et Zuckerman (2011)[263].
Le thallium peut être localement trouvé à des teneurs élevées dans les mines de charbon, les météorites, ou des affleurements géologiques particuliers (granite, roches volcaniques, argile détritique…)[11]. Par exemple, en France, les sols de l'Auxois en Bourgogne, constitués d'un calcaire marin du Sinémurien ont été minéralisés par des éléments traces (thallium, mais aussi arsenic, cadmium, cuivre, cobalt, nickel, plomb, zinc) apportés par les remontées hydrothermales via des failles liées à un ancien horst hercynien[264].
Cycle biogéochmique et source-puits de thallium
Dans l'océan profond, certains des sédiments (notamment les futurs schistes, issus de l'altération continentale) ainsi que les nodules sous-marins de manganèse sont les principaux « puits naturels » du thallium, mais le comportement de ce métal (qui se substitue volontiers au potassium) reste énigmatique dans la frange littorale, et dans les eaux océaniques ouvertes. Des indices récents plaident pour l'implication importante de bactéries du sédiment dans le cycle marin aqueux du thallium[265].
Son cycle biogéochmique est très lié au pH : dans l'eau le thallium reste libre en condition très acide (pH < 3), mais s'adsorbe facilement à un pH de ∼6,5 ; plus ou moins facilement selon son état d'oxydation[266].
1 à 5 % du thallium marin total est sous forme de Tl3+. Dans une gamme de pH allant de 2 à 12 et en contexte de potentiel redox élevé, Tl3+ forme Tl(OH)3 insoluble. Rehkämper et Nielsen (2004) montrent aussi l'existence d'une oxydation réversible de Tl+ en Tl3+ sous l'effet de la lumière (couplée à une photoréduction de Fe3+ en Fe2+ selon Karlsson et al. en 2006). L'état redox du thallium dans les systèmes d'eau douce semble donc contrôlé par le cycle du fer (souvent lié à des bactéries).
Ce métal non (bio)essentiel et « hautement toxique »[267] dans le milieu marin a longtemps été considéré comme stable dans ce milieu. Mais dans les années 2010, des universitaires allemands ont montré que ce n'est pas du tout le cas[265]. Ainsi, aux abords de Spiekeroog dans les eaux côtières allemandes, dans toutes les zones testées de la baie de Jade, de l'estuaire et de la région offshore adjacente, les taux de thallium dissous (« Tldiss ») fluctuent fortement (∼25–60 pM) dans la colonne d'eau en fonction des zones et du rythme des marées et des saisons (corrélativement au Mo et Mn dans la colonne d'eau) et sans rapport avec la salinité[265]. En termes de bilan massique, Tldiss diminue généralement à marée basse (jusqu'à 50 % de moins) et de manière inversement proportionnel au manganèse dissous (Mndiss), sauf en été. Cette « anomalie » est détectée jusqu'à plus de 40 km du trait de côte, jusqu'à Heligoland[265].
Ces variations traduisent un phénomène d'absorption/désorption rythmique du thallium des eaux interstitielles du sédiment, lié à la chimie redox du thallium encore mal comprise (les sédiments anoxiques, estuaires par exemple) pourraient être un puits pour le thallium dissous qui s'y incorporerait dans le sulfure de fer ; on a d'abord suggéré qu'il existerait une réduction du thallium dans les eaux interstitielles uniquement en conditions anoxiques/sulfuriques, mais une étude plus récente laisse penser que le cycle du thallium est déjà modifié par des conditions légèrement réductrices (et suboxiques), probablement en lien avec des phases de réduction microbienne du manganèse dans les sédiments[265] ; on a montré en 2021, en mésocosme que la saisonnalité du phénomène de forte diminution du thallium dissous peut être due à une complexation temporaire du thallium par la matière organique issue des blooms planctoniques saisonniers. Le thallium est alors extrait de la colonne d'eau et provisoirement immobilisé par des phases porteuses organiques (bactéries, algues-détritus, ligands…) et inorganiques (aluminosilicates), avant son dépôt et sa fixation potentielle dans les sédiments sulfurés là où il y en a[268]. Ce phénomène ôterait périodiquement mais temporairement 4 à 20 % du total de thallium dissous de la colonne d'eau[267]. En mésocosme, les Diatomées ne semblent pas jour de rôle dans ce phénomène, alors les blooms de Phaeocystis sp. (notamment au stade colonial de formation d'hydrogel) induisent des déplétions significatives de thallium dissous (jusqu'à ~27 % d-1)[267].
Une étude[269] allemande, en 2021, observe des enrichissements élevés (multiplication par six) en thallium dans l'eau interstitielle de divers sédiments, corrélés à la dégradation aérobie de la matière organique (MO)[269]. Inversement, le thallium disparait de la colonne d'eau interstitielle quand elle est faiblement réductrice (caractérisée par plus de 1 µM de manganèse ou de fer)[269]. La distribution spatiale du thallium dans les eaux intertidales répond au niveau de manganèse et de fer dissous, qui varie spatialement, et selon la saison. Les auteurs suggèrent que libération rapide et cyclique de thallium dans l'eau soit due à un ensemble de phénomènes impliquant la dégradation de la MO, la désorption du thallium provisoirement adsorbé sur les particules dédimentées ou à la réoxydation ; et inversement la disparition cyclique du thallium de l'eau serait « probablement liée à la présence de traces de sulfure dissous »[269].
In fine : « Bien que les sédiments intertidaux sont globalement un puits pour le thallium (ainsi que pour l'uranium et le rhénium), notamment en conditions principalement anoxiques en été, les sédiments se transforment en une source nette de Tl en hiver, quand les sédiments sont plus oxygénés ». Selon les auteurs, ces métaux quand ils disparaissent de l'eau interstitielle le font dans l'ordre d'élimination suivant : « Tl > Re > U > Mo. Le comportement d'élimination ainsi que les enrichissements élevés de Tl dans les eaux interstitielles impliquent que les puits et les sources dans le milieu marin ne sont pas encore entièrement compris (…) ces estimations de flux de Tl pourraient ne pas être applicables dans les sédiments perméables des plages de sable et dans de nombreux autres types de sédiments, qui hébergent des conditions légèrement sulfurées »[269] (de plus, des expériences ex-situ montrent que dans les eaux interstitielles des grain de sable des plages, les cinétique de réaction du thallium sont rapides)[269]. Dans le contexte du dérèglement climatique qui affecte la température, l'érosion et l'oxygénation de l'eau, dans le contexte des bouchons vaseux estuariens notamment, ces données nouvelles doivent être, autant que possible, prises en compte dans les modèles océanographiques[269].
Sur les terres émergées, les sources naturelles connues de thallium sont essentiellement le volcanisme, les geysers et certains systèmes hydrothermaux (associés à des sulfures, tels que la pyrite, la sphalérite ou la marcassite)[11], l'érosion de roches riches en thallium et la proximité de certains affleurements géologiques riches en métaux lourds[65].
Dans les années 2020, les scientifiques cherchent à modéliser et prédire le comportement du thallium dans l'environnement, dont en prédisant ses liaison dynamique aux interfaces solide-eau, en fonction des conditions de température, pH, dureté, oxygénation, biotique/abiotique, etc.[270].
Tendances
Dans les eaux
Eaux de surface
À titre d'exemple, en 2011, dans le sud-ouest de l'Angleterre, le thallium (Tl) a été dosé dans des échantillons (filtrés et non filtrés) d'eau de pluie, d'eau du robinet, de rivière, d'estuaire, d'eaux usées et d'effluents de décharges[271]. Dans cette région, Tl dissous était le moins présent (<20 ng L−1) dans l'eau du robinet, l'eau de pluie, les eaux usées traitées et les effluents de décharges, les eaux estuariennes et de rivières drainant les bassins versants de grès et de schistes. Mais des concentrations allant jusqu'à environ 450 ng L−1 ont été dans les eaux de bassins versants en partie minéralisés et là où ont existé des mines (jusqu'à 1 400 ng L−1 ont été trouvés dans l'eau d'une mine abandonnée)[271]. Comparé à d'autres éléments trace métalliques mesurés par cette étude (ex. : As, Cd, Co, Cr, Cu, Ni, Pb, Zn), le thallium montrait une faible affinité pour les particules en suspension. L'étude a aussi montré qu'il échappe aux traitements conventionnels des eaux minières (précipitation d'hydroxyde)[271].
À Trzebinia, dans une région houillère de Pologne, des échantillons d'eau, de sédiments de fond et de sol de terrasse de plaine inondable des ruisseaux Wodna et Luszowka présentaient en 2010 des niveaux de thallium 20 à 30 fois plus élevé que dans les eaux typiques de surface du pays[272].
En surface ce thallium est plutôt sous une forme piégé dans les matières en suspension, qui présente des concentrations alarmantes (dépassant de dix fois environ celle des minerais de Zinc-Plomb[273] ; « la médiane du thallium (Tl) soluble des eaux colorées du Miocène est 10 fois plus élevée que celle des eaux de surface », constituant « une grave source de préoccupation », car « même un faible pourcentage de Tl soluble crée une concentration élevée de l'élément dans l'eau [médiane 0,11 μg L−1)], qui est environ 10 fois plus élevée que dans les eaux de surface de la rivière Warta. La concentration de Tl dans SS est très élevée (médiane de 15 μg g − 1) et dépasse d'un ordre de grandeur la concentration de l'élément dans les minerais bruts de Zn – Pb »[273].
Eaux souterraines
Globalement, la quantité de thallium dissous dans les eaux souterraines augmente avec la profondeur, et en fonction du contexte géologique.
Elle est généralement comprise entre 20 et 24 μg L−1, et peut atteint au moins 1 100 μg L−1 plus en profondeur (ex. : en Pologne dans des eaux de forage remontées de grande profondeur ou contaminées par exemple par des eaux colorées du Miocène issues du lignite). Ces eaux sont une source importante de pollution par le thallium (avec des concentrations atteignant en Pologne de 2 à 3 ordres de grandeur supérieures à celles des eaux de surface)[273].
Dans le quartier de Valdicastello Carducci, en périphérie de Pietrasanta, en Toscane (Italie), la nappe, naturellement acide, a été polluée par d'anciennes mine de pyrites (où dans les galeries l'eau contient jusqu'à 9 000 μg/L de thallium)[57]. En 2014, l'eau du robinet contenait de 2 à 10 μg/L de thallium. L'analyse de centaines d'échantillons de cheveux et d'urine d'habitants de la région a montré, en 2016, des valeurs dépassant les seuils de référence européens. Les cheveux et l'urine des personnes-témoins (a priori non exposées à cette eau) en contenait de 0,1 à 6 ng/g, contre 1 à 498 ng/g chez les sujets exposés, et les taux de Tl étant là corrélés à ceux de l'eau du robinet de la zone de vie des personnes concernées, ainsi qu'avec leurs habitudes de vie[57].
Et alors que le seuil de référence européen pour l'urine est 0,006 μg/L, près de Valdicastello Carducci, l'urine en contenaient et de 0,046 à 5,44 μg/L respectivement. L'ordre a été donnée à la population de ne plus boire cette eau[57].
Dans les sédiments
Les sédiments de ruisseaux nés de des sols lessivés naturels contiennent très peu de thallium (ex. : 0,02 à 0,17 mg kg−1 dans les sédiments de ruisseaux traversant des sables et des graviers fluvioglaciaires de Pologne.
Inversement les sédiments de régions industrielles en contiennent des quantités préoccupantes. Par exemple, dans le sud de la Chine une étude (2022) a porté sur la nature et la quantité des isotopes ε205Tl du Tl trouvés dans les sédiments d'une rivière, en aval d'une grande fonderie de Pb-Zn. Cet isotope (dissous et dans les particules ultrafines [~ μm] y augmentait fortement en aval de l'usine (avec des valeurs proches de celles trouvées dans les déchets de la fonderie) ; les auteurs en ont déduit que la fonderie était responsable d'environ 80 % de la contamination en Tl de la rivière et de ses sédiments[274].
Chez les microbes
Autour de gisements géologique ex. : mines de pyrites)[275],[63] contenant naturellement au thallium (Tl), les organismes vivants y sont chroniquement exposés. Là, certaines communautés bactériennes s'y sont adaptées (plus ou moins, selon les teneurs en thallium et selon des paramètres géochimiques de type pH, S, Fe et TOM). Les chercheurs constatent que le thallium conditionne et façonne là la distribution verticale de ces communautés. Là les assemblages microbiens sont surtout dominés par les bactéries réductrices du fer (FeRB), des bactéries oxydantes du Fe (FeOB), des bactéries oxydantes du S et ces bactéries réductrices de Mn ; les cycles des éléments Fe, Mn et S dans le sol sont étroitement impliqués dans le cycle biogéochimique du Tl ; ceci fait évoquer une possible bioremédiation de sols contaminés par Tl en utilisant des microbes indigènes[276].
Chez les végétaux
Les végétaux absorbent le thallium à partir du sol, de l'eau du sol, et des dépôts humides (pluies, rosées, neige, givre…) et secs (retombées atmosphérique de nanoparticules, microparticules, particules et poussières)[219],[147].
Dans le phytoplancton
Le phytoplancton d'eau douce, comme chez les macrophytes terrestres, les teneurs en thallium varient beaucoup, selon le type d'organisme[134], mais aussi selon sa durée d'exposition[277], et du taux environnemental de Tl[278], le taux d'ions K+ dans le milieu d'exposition[134],[279] ainsi que le pH ambiant.
Dans les plantes (macrophytes terrestres, hors arbres)
En Pologne, au début du XXIe siècle, les plantes en contiennent habituellement 0,05 mg kg−1[280], mais avec d'implorantes variations (ex. : de 0,008 à 0,01 mg kg−1 pour des trèfles de régions réputés non-contaminés ; et de 0,02 à 0,6 mg kg−1 pour les graminées ; 0,02–0,3 mg kg− 1 pour les légumes… mais jusqu'à 5,5 mg kg−1 (soit près de 20 fois plus que dans les légumes les plus contaminés) pour les champignons[120],[118],[147] [pour rappel, le groupe taxonomique des champignons est bien connu pour bioaccumuler les métaux toxiques]).
Les plus fortes contaminations mesurées l'ont été entre Katowice et Cracovie dans la région de Bukovno-Olkusz, autour d'un complexe d'extraction et fusion de Zinc-Plomb. Là les bourgeons de bouleau contenaient de 9,4 à 12,6 mg kg−1 de thallium, et les feuilles en contenait en moyenne 18,5 mg kg−1 ; les graminées en contenaient encore plus (25,5 mg kg−1). La sève de bouleau (consommée par l'homme) contenait de 89 à 145 μg L−1 de thallium. Le genre brassica bioaccumule Tl, surtout le chou, le chou frisé mais aussi le colza alertaient Asami et ses collègues en 1996)[281]. D'autres auteurs[111] ont montré que (comme pour d'autres métaux toxiques) l'absorption du thallium par la plante augmente avec l'acidité du sol ; or, beaucoup de régions industrielles ont été ou sont encore exposées à des pluies acides et beaucoup de régions minières sont exposées au processus auto-entretenu dit drainage minier acide.
Des chercheurs chinois ont confirmé que le potassium (K) rapidement disponible, et le potassium total du sol sont les deux facteurs qui affectent le plus la biodisponibilité du Tl dans les sols cultivés, mais que l'altération du sol aggrave aussi l'accumulation de Tl dans les légumes[137]. Et curieusement, le taux de matière organique du sol ne semble pas significativement affecter la mobilité de Tl dans la plupart des sols à laitues ; de même, les oxydes de Fe et de manganèse (Mn) ont dans ce cas peu contribué à rendre le thallium plus biodisponibile[137]. Selon cette étude, les risques d'ingérer une dose préoccupante de thallium via le chou fleuri ou la laitue semblent minimes[137].
Dans les arbres (résineux surtout)
Le thallium est également bioconcentré et bioaccumulé par certains végétaux, et notamment par les arbres résineux[282].
La composition isotopique du thallium, Zn, Cd, Pb, K, Ca, Mg et Mn et leur répartition dans les cernes du pin sylvestre (Pinus sylvestris L.) ont été mesurées autour d'une usine de première fusion du zinc à Olkusz (Sud-Pologne)[282] ; les cernes des pins en contenaient jusqu'à 0,8 mg/kg, confirmant la tendance des conifères à bioaccumuler ce métal, au point que ces cernes pourraient être un bio-indicateur alternatif d'une pollution chronique par le thallium, mais ils ne permettent pas le suivi temporel précis d'une telle contamination[63]. En effet, dans le bois de pin, le thallium a un comportement atypique (par rapport aux autres éléments trace métalliques) : le zinc et le cadmium des cernes sont significativement corrélés aux dépôts au sol, ce qui est moins vrai pour le thallium, qui reflétaient mal l'anamnèse (évolution temporelle) des dépôts (rétrospectivement modélisés). Ceci pourrait être expliqué par d'autres apports (via les feuilles ou l'écorce) que par les racines, par des capacités d'absorption racinaire variant dans le temps (selon météo, activité mycorhizienne…) ou par des effets inégaux de translocation latérale du thallium de l'aubier vers le bois (hypothèse retenue par les chercheurs). Des effets similaires sont signalés chez plusieurs essences d'arbres avec l'arsenic qui est un homologue chimique du phosphore (Le thallium étant, lui, un homologue du potassium). Dans ce cas, la composition isotopique du plomb () des arbres et du sol sous-jacent montrait que la fonderie était l'origine prédominante de la contamination(). Par ailleurs, l'analyse des taux d'éléments nutritifs (Ca, Mg et Mn) du bois a reflété les changements environnementaux liés aux dépôts acides[282]. Le suivi dendrométrique thallium dans les cernes (comme pour l'arsenic) ne semble donc pas pertinent car ils ne sont pas une archive fidèle de la chronologie des dépôts de Tl dans l'environnement de l'arbre.
La forte affinité du thallium pour les bois résineux a plusieurs conséquences :
- les feux de forêts de résineux réinjectent du thallium piégé par les arbres, via les fumées de feux de forêt[64] ;
- Le bois en décomposition réinjecte dans le réseau trophique le thallium qu'il a stocké durant sa vie, ou dans l'air via son utilisation en « bois énergie »[131], expliquant qu'on en trouve des doses très élevées dans certains champignons ;
- Les effluents gazeux, solides et liquides d'usine de fabrication de pâte à papier et de papier ou carton faits à partir de fibres cellulosiques de pins ou d'autres résineux (les données manquent pour les feuillus) peuvent être très contaminées par le thallium
:Ainsi dans 27 usines (papeteries) surveillées en Ontario durant un an (en 1990), les effluents contenaient de 890 à 70 000 ng/L les 6 premiers mois[283], puis de 6 920 à 230 000 ng/L les 6 mois suivants[284]. Les effluents d'une fabrique de carton ondulé en contenaient aussi (de 52 780 ng/L à 230 000 ng/L, bien au-delà des 200 ng/L à ne pas dépasser pour l'eau potable) ; ceci alors que dans ces mêmes usines, les concentrations moyennes n'étaient « que » de 400 ng/L pour le mercure (Hg), 20 800 ng/L pour le cadmium (Cd) et 130 000 ng/L pour le plomb (Pb).
Jusqu'à la fin des années 1980, dans le suivi des effluents gazeux, liquides ou solides de tous les secteurs de l'aciérie et de la papeterie, le thallium a été oublié et/ou très sous-estimé, alors que, selon une étude ayant comparé les taux de ce polluant avec ceux de plomb, cadmium et mercure (polluants prioritaires systématiquement recherchés depuis des décennies) : les concentrations dans les effluents variaient systématiquement comme suit : Tl ≥ Pb > Cd > Hg.
Dans les effluents aqueux du secteur fer/acier, pour sept usines suivies en Ontario[285], les concentrations se comptent en kilogrammes par jour, variant de 10,1 à 23,6 à kg/jour de thallium (18,7 kg/jour en moyenne), soit bien plus que la charge moyenne de mercure (0,05 kg/jour), de cadmium (4,0 kg/jour) et de plomb (21 kg/jour). Dans la plupart des usines les effluents en contenaient de 0,0 à 60 000 ng/L, et dans une usine spécialisée, ce taux variant de 10 000 à 220 000 ng/L. Ces taux dépassent souvent, et de loin, le seuil pour la qualité de l'eau de l'Ontario (200 ng/L)[285], confirmant qu'au début du XXIe siècle, le thallium est un polluant environnemental majeur, plus qu'émergeant, et sous-estimé en concluaient Cheam et al. en 2000[286].
Chez les animaux
Chez les animaux à sang chaud (dont l'Homme) et à sang froid, le thallium est très bioassimilé et hautement toxique, même à très faible dose[13] ; et à l'état métallique, un simple contact est déjà dangereux. Pour cette raison, des sels de thallium ont été ou sont encore présents dans certains insecticides ; ils ont aussi été utilisés dans la mort aux rats.
Poissons
Des salmonidés (Salvelinus namaycush) migrant entre le lac Michigan et le centre de l'océan Pacifique contenaient de 0,2 à 12 nmol g−1 de thallium[287],[288]. Des truites alpines (Salvelinus alpinus) du lac Hazen (île d'Ellesmere, Nunavut, Canada) présentaient des taux allant de 0,07 à 0,61 nmol g−1)[289]. Dans des lacs recevant des eaux usées de traitement de l'uranium, le tissu musculaire du grand brochet (Esox lucius) contenait quatre à cinq fois plus de thallium que celui de poissons vivant dans des lacs non contaminés de la même région[290],[289].
Dans des zones contaminées par le thallium étudiées, le muscle de poissons en contenait de 470 dans les années 1950[291] à 575 nmol g−1 dans les années 1970[292]. Et le plus faible taux de thallium dissous pour lequel des effets toxiques ont été signalés est de 0,15 μmol L−1 pour le saumon atlantique juvénile[292]. 50 % des poissons meurent à partir de 20,9 à 294 μmol L−1 selon les espèces (gardon, perche et truite arc-en-ciel) selon Pickard et al. en 2001[293].
Amphibiens
Dans la région de Bukovno-Olkusz, entre les villes de Katowice et Cracovie (Pologne), le frai des amphibiens peut être une source très importante de contamination au thallium pour les prédateurs. De même pour les amphibiens eux-mêmes (ex. : chez les crapauds adultes de Bukowno, les foies accumulent le plus de thallium ; 3,98 mg kg-1 (en poids sec) en moyenne et jusqu'à 18,63 mg kg-1 ; et plus de 96,5 % des foies contenaient plus de 1,0 mg kg−1 de thallium, niveau correspondant à un empoisonnement[110].
Oiseaux
Au Japon, Mochizuki et al. en 2005 dont dosé le thallium dans le foie et les reins de 5 espèces de canards barboteurs et de trois espèces de canards plongeurs. Les taux de thallium variaient de 0,0049 à 0,14 μmol g−1 en poids sec, et étaient 4 fois plus élevés chez les canards de surface (par rapport aux plongeurs)[294], probablement en raison de comportements alimentaires très différents dans un même plan d'eau[288].
Animaux chassés, pêchés ou élevés et mangés, risques pour les consommateurs
En 1906; W. Luck a empoisonné une poule avec du thallium et a donné à manger sa chair à des rats ; cela a suffi à tuer onze rats. Des prédateurs ou espèces nécrophages (le sanglier par exemple, volontiers nécrophage) sont parfois à leur tour mortellement empoisonnés[9] ; ainsi que des espèces gibier ayant mangé des granulés raticides, qui peuvent être dangereusement contaminés, et menacer la santé de leurs consommateurs[295]. Un autre auteur (P.G Shaw, en 1932) déduit d'observations des taux de thallium retenus dans les tissus, qu'il est effectivement probable que la chair de gibier à plumes ayant eu accès à un appât rodenticide au thallium provoquerait une intoxication secondaire chez les consommateurs de gibier[296]. Une autre étude a montré que le fœtus d'animaux gravides empoisonnés peut également en contenir des quantités significatives[297].
Des études plus récentes donnent quelques fourchettes de teneurs typiques des tissus musculaires d'autres animaux[249],[298],[147], également chassés, pêchés ou élevés et consommés par l'Homme :
En 2015 une étude de l'INRA publiée dans la revue Production animale, conclut qu'on manque de données concernant le risque de contamination d'animaux sauvages ou de gibier puis de la chaîne alimentaire via l’épandage de matières fertilisantes d’origine résiduaire (MAFOR) contenant du thallium[299].
En 2015 paraissait une étude polonaise ayant utilisé le chevreuil (herbivore) et le sanglier (omnivore et nécrophage) pour un essai de biomonitoring de la contamination du réseau trophique par le plomb (Pb), le cadmium (Cd) et le mercure (Hg) dans deux régions industrielles de Pologne avec différents niveaux de pollution par les métaux toxiques, comparées au district des lacs de Mazurie, considéré comme épargné par l'industrie. Les taux de Pb, Cd et Hg étaient préoccupants pour la santé des consommateurs dans les échantillons de foie, de rein et moindrement de muscle ; les auteurs ont aussi calculé les facteurs de concentration moyens dans les tissus animaux par rapport à leur concentration dans le contenu gastrique ou ruminal. L'étude montre que le secteur pollué par la fusion des métaux était plus contaminé que la zone d'extraction de lignite et que le site de référence. Des niveaux élevés de ces métaux dans les abats de gibier peuvent constituer une menace pour les consommateurs de venaison[300].
Dans les agrosystèmes
On le retrouve aussi dans les agroécosystèmes, dont en France selon des études faites par l'INRA dans les années 1990[301],[302].
Toxicologie
Ce produit étant toxique à très faible dose et difficile à doser, l'empoisonnement par le thallium ou thallotoxicose est resté longtemps méconnu. Il a commencé à être décrit dans les années 1930[193],[303].
Dégradation de la fonction hépatique par Tl(I) et Tl(III) : le foie est l'un des principaux organes de détoxication (avec le rein) et il contrôle l'homéostasie des acides gras et des lipides de l'organisme. Il a besoin pour cela d'un grand nombre de mitochondries fonctionnelles. On a récemment (2022) montré, chez la souris, que si une expositions à seulement 10 ppm de Tl(I) ou de Tl(III) durant 15 jours ne changent pas significativement son poids ni son comportement alimentaire ; pendant qu'une partie du thallium se fixe dans son foie, il induit une congestion des sinus hépatiques, une nécrose des hépatocytes et bouleverse le métabolisme et les taux d'acides gras. Tl(I) suractive dans le foie les gènes liés à l'antioxydation (HO-1, GPX1 et GPX4), à la synthèse des acides gras (FADS2 et Elovl2) et à la voie d'oxydation des acides gras (PPARα, ACADM, ACADVL, ACAA2 et CPT1A)[304]. Tl(III) quant à lui suractive plutôt les gènes liés à la voie d'oxydation des acides gras (CYP4A10 et CPT1A). En perturbant le métabolisme des acides gras, le thallium cause un épuisement énergétique du foie[304].
Au stade fœtal et embryonnaire humain
Les effets de l'exposition prénatale précoce au thallium sont encore mal documentés, mais on sait que bien qu'à très faible dose en général, le thallium est de plus en plus largement présent dans l'environnement il est retrouvé jusque dans les glaciers et les neiges de l'Antarctique, ce qui laisse supposer une large contamination des chaînes alimentaires)[305] (niveau de fond « naturel » de thallium pour l'Arctique : estimé en 2001 entre 0,02 et 0,03 pg/g)[306], et il est bioassimilable. Très soluble dans le sang, il traverse aisément les barrières pulmonaire, intestinale et un peu moins bien la barrière placentaire (quand la mère est contaminée, on le retrouve rapidement dans le sang de cordon et dans le liquide amniotique)[65] ; chez les mammifères, les sels de thallium peuvent traverser le placenta et pénétrer dans le fœtus, mais les concentrations chez l'embryon et le fœtus restent « bien inférieures à celles du plasma maternel, probablement parce que le placenta limite le passage des ions thalliu »[307],[242] ;
une étude chinoise récente (2016), basée sur 816 personnes, a confirmé que l'augmentation du taux urinaire de thallium chez la femme enceinte est associé à un risque significativement plus élevé de faible poids du bébé à la naissance[308].
À la différence du mercure, le thallium ne semble pas causer de malformations congénitales[84], mais comme pour le plomb, l'exposition in utero affecte l'intelligence du futur enfant avec, curieusement, un effet « genré » :
- Selon une étude (2020) basée sur une cohorte[309] de 2 851 paires mère-nouveau-né dont le sang de cordon a été testé lors des premier, deuxième et troisième trimestres de la grossesse : en cas d'exposition prénatale au thallium au second trimestre de grossesse, le risque de troubles neurocomportementaux de type trouble déficitaire de l'attention/hyperactivité (TDAH) augmente chez les jeunes enfants observés à l'âge de 36 mois[208]. Ce risque est plus marqué chez les garçons (qui au stade fœtus semblent nettement plus sensibles à la neurotoxicité de ce métal que les filles)[208] ;
- Par ailleurs, une autre étude (chinoise) publiée en 2022 a évalué de la même manière l'exposition prénatale au thallium et a modélisé les fenêtres critiques de la neurotoxicité du thallium ; elle conclut que des taux de thallium plus élevés au premier trimestre de grossesse sont associés à des scores VSI plus faibles et que si la « contamination » se fait au troisième trimestre, les scores aux tests du WISC sont d'autant plus mauvais pour les aspects VSI (Visual Spatial Index), FRI (fluid reasoning index) et PSI que le degré de contamination a été important in utero. Cette équipe infère que l'exposition in utero au thallium est « très probablement associée à un développement cognitif moins bon chez les garçons »[209].
Exemples d'empoisonnements connus au thallium
- Cet élément chimique a été utilisé par William Bechtel réserviste du SDECE pour empoisonner le combattant nationaliste camerounais Félix Moumié à Genève en 1960[310]. L'agent (ancien combattant parachutiste Franco-Suisse et réserviste du SDECE, alors sexagénaire, qui s'est fait passer pour un journaliste) aurait versé une première dose mortelle dans son apéritif (un Pernod[311]), que Moumié n'a pas bu en début de repas trouvant qu'il avait mauvais goût, incitant l'agent à en verser une seconde dans un verre de vin. Moumié, à la fin du repas, finit par boire le verre de vin et le pastis empoisonné en disant : « On va pas leur laisser l'apéritif qu'on n'a pas bu », prenant ainsi une double dose de thallium. Il aurait ensuite compris rapidement qu'il avait été empoisonné ;
- Selon l'ex-ministre des Affaires étrangères irakien Hamed Jabori, Boumédiène a également été empoisonné par les services irakiens avec du thallium.
- Lors de l'empoisonnement supposé d'Alexandre Litvinenko en 2006, on a d'abord soupçonné le thallium (Litvinenko avait notamment perdu ses cheveux)[312],[313] avant de trouver des traces de polonium 210 dans ses urines.
Traitement des intoxications au thallium
Face à un patient empoisonné par le thallium, après le diagnostic, le médecin cherche à provoquer une excrétion forcée du poison.
- le bleu de Prusse pris par voie orale absorbe le césium et le thallium dans le tube digestif. Le césium et le thallium ainsi complexés par le bleu de Prusse sont alors rendus insolubles et non disponibles pour l'organisme, puis éliminés dans les selles (qu’il colore en bleu très foncé). Même dans les selles, le thallium sera ensuite non-biodisponible pour les plantes et les autres organismes vivants ;
- d'autres chélateurs (ex. : dimercaptosulfonate de sodium) sont parfois associés[204],[314] ;
- La métallothionéine est une protéine soufrée de faible poids moléculaire, connue pour jouer un rôle de piégeage de métaux et de radicaux libres chez tous les animaux[315]. Deux universitaires turcs (publication 2010) en ont injectée (1 ou 2,5 mg/kg de poids corporel) à des rats mâles Wistar de laboratoire, avant qu'ils soient empoisonnés par de l'acétate de thallium par voie intrapéritonéale (32 mg/kg, soit la DL50 pour cette espèce). Par rapport aux rats non-traités, chez les rats ainsi traités, « l'accumulation de Tl dans le foie a diminué en fonction de la dose de métallothionéine, les niveaux d'antioxydants ont été restaurés, les niveaux de H2O2 et la peroxydation lipidique ont diminué, et l'intégrité des hépatocytes et des structures membraneuses à l'intérieur des cellules a été préservée »[315]. D'autres études, en 2020 et 2021 ont confirmé l'efficacité de cette molécule, seule ou combinée au bleu de Prusse pour atténuer le stress oxydatif induit par le thallium[316] et pour atténuer la toxicité systémique du thallium (toujours chez le rat)[317] ;
- une hémodialyse est parfois associée à ces traitements[204].
Une difficulté est que les traitements sont d'autant plus efficace que mis en œuvre tôt, mais les sels de ce métal n'ayant généralement ni goût, ni couleur, ni odeur caractéristique, le diagnostic est souvent tardif[202] (au moment de l'alopécie qui en est le symptôme le plus typique par exemple).
Écotoxicologie
On suppose que son écotoxicité est liée à sa toxicité intrinsèque, et à son comportement géochimique et à sa mobilité qui « miment » ceux du potassium[14].
Au début des années 2020, l'écotoxicologie du thallium est encore très lacunaire. Ceci s'explique par la rareté des études sur les effets d'expositions diffuses et chroniques aux faibles doses ; sur les mécanismes dynamiques de migration, transformation, bioaccumulation et biomagnification du thallium dans les divers habitats et écosystèmes et par le fait que c'est un élément souvent présent à très faible dose (< 1 ppm dans la croûte terrestre et < 1 μg/L en eau douce non contaminée, et moins de 20 nanogrammes par litre d'eau de mer, en général). Son dosage et son suivi impliquent des outils efficaces de microextraction et, s'il est présent à très faible dose, une phase de pré-concentration[318],[319] et/ou de mesure très sensibles, en particulier pour le doser dans des matrices complexes[14]. De plus, dans l'environnement aquatique, « la technologie de séparation du Tl(III) et du Tl(I) est encore immature, en particulier il est difficile de séparer efficacement Tl(III) et Tl(I) dans l'eau de mer »[27].
Les taux de thallium dans le phytoplancton et les macrophytes varient selon le type d'organisme[134], la durée d'exposition[277], la concentration du milieu en thallium (Kwan et Smith, 1988) et le taux de K+ dans le milieu d'exposition[134],[279]. Le pH joue aussi un rôle majeur (ex. : chez Lemna minor, Chlorella kessleri et Scenedesmus obliquus (Stary et al. 1983[277]) le thallium bien qu'alors très biodisponibile, est moins absorbé à faible pH (peut être à cause d'un métabolisme réduit ou d'une inhibition de l'absorption par les protons), mais il est bien absorbé pour les pH de 6 à 10[320].
L'accumulation de thallium chez les végétaux n'est pas (ou peu) un phénomène de diffusion passive[320] ; en effet, elle augmente avec le métabolisme de l'organisme, et Kwan et Smith (1991) ont montré que Lemna minor exposée à 0,1 à 100 μmol L-1 de thallium présente un seuil de saturation, et que dans l'obscurité l'absorption de thallium chutait de 91 %[277] ; un phénomène de même type a été constaté en 1991 chez l'algue Chlorella et chez la diatomée Stephanodiscus hantzschii exposées au Diméthylthallium (DMT). Le thallium empreinte les systèmes de transport de K+, d'autant plus facilement qu'il y a carence de potassium dans le milieu. Et Tl+ inhibe l'absorption de K+ chez la cyanobactérie Synechocystis[321].
Julie Dumas a conclu en 2007 que « le transfert trophique du nickel et du thallium est plutôt facile et que ces deux métaux pourraient se retrouver facilement en haut de la chaîne alimentaire » ; elle a montré qu'une partie au moins du thallium « stocké » dans les granules intracellulaires et dans les débris cellulaires de tubifex et de larves de chironomes est également assimilable par le Sialis (un de leurs prédateurs)[322].
Caenorhabditis elegans est un invertébré couramment utilisée en écotoxicologie, représentatif de nombreux nématodes et organismes vivant dans le sol. On a montré en 2021 que sa larve absorbe facilement l'acétate de thallium, qui tue, à faible dose, une partie des larves et inhibe le développement des autres (aux doses testées de 100 à 1 000 μM). Même après une brève exposition, le thallium se montre reprotoxique pour ce vers (forte inhibition de la formation d'œufs dans l'utérus). Il modifie le comportement du vers. Il active les voies antioxydantes[323].
Dépollution de milieux contaminés par le thallium
Épuration d'effluents gazeux
Elle se fait par des moyens similaires à ceux utilisés pour d'autres métaux lourds toxiques (plomb, mercure, cadmium….), et les scientifiques cherchent à améliorer leur efficacité[324].
Potabilisation de l'eau
Selon Xiaoliu Huangfu et ses collègues (du laboratoire éco-environnemental du réservoir/Barrage des trois gorges et du laboratoire d'Etat chinois chargé des ressources en eau pour les villes), dans le monde et en Chine « Il est urgent de développer des stratégies appropriées pour l'élimination des traces de Tl dans les usines de traitement de l'eau potable »[325]. Selon les données disponibles vers 2020, l'adsorption semble être le mécanisme le plus sélectivement capable de capter le thallium pour l'éliminer des eaux contaminées (y compris pour un potabilisation), et c'est le plus utilisé à échelle industrielle[325]. Pour cela, de nouveaux adsorbants sont recherchés (des analogues du bleu de Prusse, de nouveaux biosorbants ainsi que les oxydes métalliques ont été testés) mais au début des années 2020, éliminer Tl(I) des milieux solides ou aqueux reste un défi, car il est dangereux et présent à des doses souvent extrêmement faible dans les eaux usées, et son extraction est « perturbée par nombreux ions d'impuretés qui l'accompagnent »[326] (cations qui « entraînent une faible efficacité d'élimination de Tl(I) »[327]
Divers composés organiques macrocycliques ont aussi un fort potentiel de fixation du thallium(I)[27], ainsi que certains déchets liquides riches en certains nanomatériaux non agglomérés et à grande surface spécifique d'échange[328]. Une étude (2022) a par exemple expérimentalement testé avec succès l'utilisation de pyrolusite de mauvaise qualité et de résidu de pyrolyse de boues huileuse pour épurer de l'eau polluée par du thallium[329].
D'autres pistes sont explorées. En voici quelques exemples :
- En 2014, on a montré, en Chine, que dans certaines conditions de pH (acide), quelques oxydes métalliques modifiés peuvent efficacement capter et même rendre inerte Tl(I) dissous en l'adsorbant et en l'oxydant en Tl(III) : c'est le cas du dioxyde de manganèse hydraté amorphe (HMO, déjà connu comme bon sorbant pour la rétention d'autres métaux toxique). En laboratoire, sur une « eau simulée », ce matériau montre une grande sélectivité de sorption pour de Tl(I), même en présence de Ca(II) concurrent présent à des niveaux beaucoup plus élevés[325]. Xiaoliu Huangfu et al. ont montré que l'ajout de dioxyde de manganèse nanométrique amorphe (nMnO2) peut ainsi améliorer l'efficacité de l'épuration de traces (0,5 μg/L) de Tl, dans de l'eau simulée, mais moindrement dans des eaux de surface représentatives (rivière, et réservoir de barrage) ; si dans l'eau simulée, le taux de thallium chute de 0,5 μg/L à 0,1 μg/L résiduel, ce n'est pas le cas dans les eaux de surface naturelles testées, en raison probablement de la présence de cations compétitifs Ca2+ pour l'adsorption de Tl sur nMnO2. Ajuster le pH de l'eau aux conditions alcalines et la préoxyder Tl(I) en Tl(III) peut alors améliorer l'extraction du Tl[325] qui une fois adsorbé sur nMnO2 pourra être éliminé en décharge (après décantation du nMnO2).
Une fois saturées, les particules HMO semblent en outre pouvoir être régénérées dans une « solution binaire NaOH - NaOCl d'alcalinité à 7,8 % et de chlore actif à 5,0 % »[330].
Un problème est que l'acide humique, naturellement présent dans de nombreux types d'eaux de surface, pourrait contrer l'efficacité de cette coagulation améliorés par nMnO2[325] ;
- En 2015, on a montré que du Florisil (Silicate de magnésium synthétique) imprégné sous ultrasons de liquides ioniques (LI) permet d'extraire du Tl(I) d'un milieux aqueux en contenant[331]. Des liquides ioniques « fonctionnalisés » ont pu capter efficacement d'autres métaux lourds[332] et semblent être de bons candidats pour capter les ions thallium présents à faible dose[333]. Parmi ceux qui ont été aussi testés pour Tl, ceux à base de phosphonium en adsorbaient plus que ceux à base d'imidazolium. Les ultrasons permettent de rapidement préparer l'adsorbant, en conservant et associant les atouts des liquides ioniques et ceux du support solide, tout en économisant la quantité de liquide ionique utilisée, et sans perdre d'extractant dans la phase aqueuse[331] ;
En laboratoire (Université de Montpellier), dans le cadre d'une thèse, un consortium de bactéries sulfato-réductrices dominées par des bactéries Fe-oxydantes (consortium prélevé dans l'eau d'un drainage minier acide ou DMA), a été placé dans un bioréacteur aérobie en colonne, alimenté en continu avec de l'eau de ce DMA. Le système a capté presque tout le thallium, l’As et le Sb de cette eau[335].
- En 2021, López et al. ont proposé un matériau composite adsorbant, facile à préparer, peu coûteux, réutilisable et jugé par eux « respectueux de l'environnement », associant un dérivé du bleu de Prusse à des nanoparticules de magnétite[336]. Ce composite magnétique est aisément récupérable au moyen d'un électro-aimant. En laboratoire, il a permis de récupérer jusqu'à 117 mg de Tl(I) par gramme de composite après 21 h d'interaction. IL a pu abaisser le taux de Tl dans le milieu jusqu'à 28 fois sous le seuil autorisé pour les eaux usées, et sans pâtir des variations de pH, mais avec « de légères interférences des ions typiques contenus dans les eaux usées de l'industrie minière ». En outre, ce sorbant est réutilisable, permettant d'encore récupérer 97% du thallium éliminé sous traitement de désorption en solution KCl. Et enfin, il semble pouvoir aussi adsorber d'autres métaux indésirables (Cu) ou hautement toxiques (Pb) fréquents dans les eaux usées.
- En 2022,
- des oxydes de manganèse biogéniques (BMnOx) ont été étudiés comme adsorbeurs de Tl. Préparés en oxydant le Mn(II) par une bactérie mise en présence de Mn(II) dans une solution de 4,0 à 28 mg/L de manganèse, ce BMnOx a efficacement piégé le thallium par chimisorption principalement, et via des interactions synergiques d'oxydation-précipitation, d'attraction électrostatique, d'échange d'ions et de complexation en surface du BMnOx : Et en outre, après l'adsorption, 19,46 % du Tl(I) hautement toxique a été transformé en Tl2O3 bien moins toxique. oxydes de manganèse biogéniques. La captation de thallium était efficace dans une large fourchette de pH (3,0 à 9,0) même en présence de 40 mg/L[337].
- une technique oxydation avancée du Tl(I) par du fer à valence nulle (Fe0) couplé avec du persulfate a permis, en laboratoire, d'épurer des eaux contenant du Tl(I), sans que les ions coexistants et ni la matière organique (NO3−, SO42−, Cl− et HA) n'aient trop perturbé le processus, et ce dans une large gamme de pH et de température. (plus de 98 % du Tl(I) extrait pour une concentration de Tl(I) ≤ 0,250 mM, avec le radical•OH actif dans l'élimination du Tl(I), oxydé et récupéré par co-précipitation pendant que Fe0 catalyse la réaction en tant que source d'ions Fe2+. Le Fe0 résiduel est récupérable grâce à son magnétisme, et réutilisable comme réactif[338] ;
- le biochar est un matériau synthétique, souvent encore plus adsorbant que le charbon activé.
En 2022, on a réussi à utiliser de la paille de blé pré-traitée, puis pyrolysée à l'azote, puis exfoliée à la chaleur éclair pour créer un biochar dont les nanofeuilles en couches minces extraient très efficacement le thallium(I) d'eaux contaminées ; grâce à ses pores ouverts de 3,98 nm, et une surface BET de 421,24 m²g⁻¹ (très supérieure aux pores de 2,05 nm et aux 3,81 m²g⁻¹ d'un biochar de paille vierge). À pH 7,0, il capte jusqu'à 382,38 mg g⁻¹ de thallium (9 fois plus qu'un biochar normal de paille), y compris en présence d'ions concurrents (Ca²⁺, Mg²⁺, K⁺, Cu²⁺, Zn²⁺) et/ou d'acide humique et/ou d'acide fulvique. De plus, après 5 cycles de régénération (adsorption-désorption), et il conserve encore 93 % de sa capacité initiale. En laboratoire, il a pu éliminer 90 % du Tl (I) d'une eau de rivière contaminée pour les besoins de l'expérience[339].
En 2022, également, on a pu conjointement et synergiquement adsorber 98,33 % du thallium (Tl) et 89,14 % de l'antimoine d'une eau polluée, ceci grâce à un composite associant un biochar à des nanoparticules de manganèse-ferrite (MnFe2O4) assez facile à fabriquer en condition hydrothermale[340]. Ici : « OH• et SO•–4 jouent un rôle critique dans l'élimination de la pollution par les composés Tl–Sb », via un mécanisme d'oxydation, d'adsorption, de complexation et d'échange d'ions[340].
La plupart, voire tous ces procédés impliquent des moyens technologiques, énergétiques et/ou financiers qui ne sont pas à la portée de nombreux Pay et communautés.
Dépollution de sols


- Certains microbes présentent un potentiel pour la dépollution de sols ou de substrats de culture contaminés[276] ;
- Quelques plante métallophytes peuvent bioaccumuler et bioconcentrer des quantités importantes de thallium sans en mourir[343] comme on l'a par exemple montré autour d'Olkusz en Pologne[175] (ex. : plantes des genres Iberis et Biscutella), ce qui leur donne un intérêt pour le phytominage ou a phytoremédiation[341], mais on ne peut raisonnablement les utiliser à ce jour que sur de petites surfaces, dont par exemple dans le sud de la France avec :
- Iberis intermedia : jusqu'à 0,4 % de thallium (4 000 mg/kg) dans la matière sèche de la plante entière)[341] ;
- Biscutella laevigata (Brassicaceae) : plus de 1,5 % de la biomasse[341], ce qui en fait la plante la plus hyperaccumulatrice de thallium connue ; on a montré en 2022 que même la graine le tolère (il y est principalement localisé dans l'endosperme et les cotylédons). Dans la plante mature, le thallium est stocké dans le limbe foliaire et notamment dans les marges des limbes, et essentiellement dans les feuilles intermédiaires (16 100 μg g−1 !)… alors que ce taux est inférieur d'un ordre de grandeur dans la tige et les racines. Et curieusement, alors que c'est le cas chez de nombreuses autres espèces, le potassium n'y inhibe pas (ni n'augmente) l'absorption de thallium ; cette non compétition entre thallium et potassium invite à penser que le thallium n'y est pas absorbé via les canaux du potassium, mais par un ou plusieurs transporteurs de haute affinité du thallium (encore inconnus en 2022)[342].
Décontamination de déchets
De très nombreux types d'effluents industriels, aqueux notamment, sont contaminés par le thallium (généralement conjointement à d'autres métaux ou polluants dont certains peuvent avoir une certaine valeur). Pour être recyclables ou évacué sans danger dans un « milieu récepteur » (cours d'eau, mer), ou dans le contexte du traitement de séquelles industrielles, ces déchets doivent être décontaminés de ce métal, ce qui ne peut être fait par les technologies classiques d'épuration[344].
De nouvelles méthodes de traitement sont explorées, qui ont toutes leurs avantages, limites et inconvénients : elles sont généralement basées sur des adsorbants multifonctionnels, des d'extractants non toxiques, l'oxydo-réduction, l'échange d'ions avec une résine échangeuse d'ions permettant une récupération facile et non polluante du thallium, des technologies de séparation membranaire, l'absorption/extraction par solvants, la précipitation/co-précipitation chimique, la coagulation-floculation, la flottation et la bioremédiation[344],[345]. Généralement, une seule de ces techniques ne suffit pas à éliminer le thallium pour descendre à un niveau sûr (quelques microgrammes par litre) ; il faut donc combiner plusieurs de ces technologies pour obtenir l'efficacité nécessaire et un rendement soutenable à grande échelle ; et il faudra ensuite inerter et gérer de manière sûre le thallium ainsi « extrait » et pour les matériaux d'adsorption épuisés ou les boues ou stériles ne pouvant être traitées dans les conditions économiques et techniques du moment[344],[345]. En 2020, la plupart de ces méthodes impliquent encore un long passage dans le process épuratoire ; elles ne conviennent pas aux besoins de « technologies d'urgence potentielles » nécessaires en cas d'accident technologique ou industriel impliquant une pollution thalliée[345].
On cherche aussi à récupérer ce métal sous des formes réutilisables et/ou peu encombrantes (précipité solide insoluble idéalement), pour améliorer la soutenabilité et la rentabilité des processus de dépollution[344].
Une étude de l'INERIS a montré que le thallium présent dans des déchets organique papetiers, des boues de STEP ou des déchets ménagers ne contamine pratiquement pas le biogaz fait à partir de ces déchets[346].
Mesure des concentrations de thallium
Selon matrices étudiées (eau, air, sol, sédiment, échantillons minéraux, végétaux, fongiques ou animaux), avec ou sans recherche isotopique, divers techniques analytiques sont utilisées, dont :
- spectrométrie de fluorescence atomique excitée par laser (LEAFS)[11],[306] ;
- spectrométrie de masse à plasma à couplage inductif (ICP-MS)[11] ;
- voltampérométrie à impulsions différentielles par décapage anodique (DPASV ou FI-DP-ASV)[11], ultra-sensible, dosant Tl jusqu'à la picomole par litre (pg/L)[272],[347] ;
- spectrométrie de masse à plasma à couplage inductif haute résolution (HR-ICP-MS)[11] ;
- spectrométrie de masse à plasma à couplage inductif par vaporisation électrothermique (ETV-ICP-MS)[11] ;
- spectrométrie d'absorption atomique : spectrométrie d'absorption atomique à flamme (FAAS) ou spectrométrie d'absorption atomique à four graphite (GFAAS)[11]. Par exemple, pour analyser le thallium dans le pétrole de schiste ou ses sous-produits (boue ou matériaux secs), après pyrolyse et atomisation à 900 et 1 800 °C respectivement, les limites de détection obtenues pour l'analyse des échantillons de solides et de boues étaient en 2014 de 11 et 36 ng/g respectivement[348] ;
- Un nouvel instrument portable de détermination rapide du thallium dans l'eau a été proposé et testé (en 2017), basée sur un déchargeur luminescent à cathode associé à un spectromètre à fibre optique, en conditions optimisées, sa limite de détection (LOD) pour le thallium était de 11,8 ng mL−1 (écart type : 3,2 %)[349].
Sources d'exposition humaine
Le thallium est un poison cumulatif et qui peut-être bioaccumulé dans le réseau trophique[350]. Ses apports pour l'organisme sont surtout ;
- l'air inhalé (dans les régions industrielles notamment, ou en aval de feux de forêt, ou là où le charbon sert encore à se chauffer ou cuire des aliments…)
- l'alimentation, dont l'eau et d'autres boissons facilement contaminés par ce métal. Par exemple, une étude récente (2021) a montré que les vignes poussant dans une région minière abandonnée de Turquie contenait jusqu'à 2,34 mg/kg de thallium dans leurs racines, et un peu moins dans leurs feuilles mais assez pour exposer les enfants à 1,10E-02 mg/kg par jour, ce qui implique des risques sanitaires[351] (déjà signalé en Toscane dans un même contexte de séquelles minières)[57]. Il est possible de doser le thallium dans le raisin et le vin[352], mais peu de données semblent disponibles à ce sujet.
Géographie et cartographie de la pollution par le thallium
La pollution diffuse touche toute la planète, mais on connait quelques hot-spots de pollution thalliée, dont :
- les zones actuelles et historiques d'extraction de minerai de type sulfure métallique, par exemple au nord de la République de Macédoine (Allchar), en Italie du Nord (Toscane), aux États-Unis (Iron Mountain), en Suisse, en France ou au sud de la Pologne (Bukowno–Olkusz), et plus encore au sud de la Chine dont à Xiangquan et particulièrement à Lanmuchang où après 400 ans d'exploitation de ce district minier, le mercure, le thallium et l'arsenic sont encore cause d'empoisonnement chronique au thallium se manifestant par des anorexies, alopécie, cécité conduisant parfois à la mort. Dans l'année 1960 ce district a enregistré 87 cas d'intoxication au thallium[353].
Nota : « La présence d'impuretés Tl variables dans la structure cristalline du sulfure tend à diminuer la résistance du minéral aux intempéries (oxydation) »[354] ; - des fonderie, certaines usines et incinérateurs, et surtout des zones associant des fonderies de métaux non-ferreux à un bassin minier important (ex. : dans le bassin houiller du Nord-Pas-de-Calais, les deux grandes fonderies de Métaleurop-Nord (fermée) et de Nyrstar sur le bord de la Deûle, rivière canalisée très polluée par le thallium[355] avec selon une étude datant de 2007 des taux de 1.8 à 1111 μmol par kg de sédiment[356]).
Les données de terrain, si elles sont assez précise et nombreuses peuvent être intégrées dans une cartographie de distribution du thallium. Par exemple, au Canada, la première carte à grande échelle de ce type a été produite en 2001[306].
Le thallium fait partie des métaux suivis par l'étude ESTEBAN en France métropolitaine.
Règlementation
Concernant les appâts empoisonnés utilisés par les chasseurs ou les agriculteurs ou les syndicats ou personnes chargés de lutter contre les rongeurs ou d'autres animaux jugés indésirables, les interdictions ont tardé à se mettre en place. Par exemple en Suisse il a fallu attendre 1973 pour interdire cet usage du thallium. Mais près des frontières, des cas d'empoisonnement humains ont persisté des années après, car ces poisons pouvaient encore être facilement achetés en Allemagne, en France ou en Italie où ils étaient encore mis sur le marché.
En 1970, ces poisons étaient encore utilisés dans tous le pays européens. Et en 1980, ils l'étaient encore en Amérique du Sud, en Asie, et même encore un peu dans certains États du Sud des États-Unis, alors que c'est en Californie qu'on a pris conscience, bien plus tôt, de leur grande dangerosité pour l'Homme et les animaux domestiques et d'élevage[187].
Notes et références
Notes
- ↑ WDC pour water-based drilling cuttings.
- ↑ Les isotopes du thallium révèlent une excursion isotopique négative transitoire du thallium au moment de cette extinction, et qu'il y a eu une première phase de début de désoxygénation bien avant l'EPME, plus d'un million d'années avant ce qu'on pensait être le début de la désoxygénation (telle qu'enregistrée par d'autres proxy).
- ↑ Sud-ouest de la province du Guizhou.
Références
- 1 2 3 4 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0).
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203.
- 1 2 3 4 5 (en) F. Aitken et F. Volino, « New equations of state describing both the dynamic viscosity and self-diffusion coefficient for potassium and thallium in their fluid phases », Physics of Fluids, vol. 34, no 1, , p. 017112 (ISSN 1070-6631 et 1089-7666, DOI 10.1063/5.0079944, lire en ligne, consulté le ).
- ↑ (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0-8031-2066-4, lire en ligne), p. 73.
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche).
- 1 2 Entrée « Thallium, powder » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 juin 2018 (JavaScript nécessaire).
- ↑ « Thallium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- 1 2 3 4 5 (en) Robyn Blain, « Thallium », dans Handbook on the Toxicology of Metals, Elsevier, (ISBN 978-0-12-822946-0, DOI 10.1016/b978-0-12-822946-0.00028-3, lire en ligne), p. 795–806.
- 1 2 (en) M. Sager, « Thallium », Toxicological & Environmental Chemistry, vol. 45, nos 1-2, , p. 11–32 (ISSN 0277-2248 et 1029-0486, DOI 10.1080/02772249409358067, lire en ligne, consulté le ).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 (en) Bozena Karbowska, « Presence of thallium in the environment: sources of contaminations, distribution and monitoring methods », Environmental Monitoring and Assessment, vol. 188, no 11, , p. 640 (ISSN 0167-6369 et 1573-2959, PMID 27783348, PMCID PMC5080298, DOI 10.1007/s10661-016-5647-y, lire en ligne, consulté le ).
- 1 2 3 4 (en) Zdzisław M. Migaszewski et Agnieszka Gałuszka, « Abundance and fate of thallium and its stable isotopes in the environment », Reviews in Environmental Science and Bio/Technology, vol. 20, no 1, , p. 5–30 (ISSN 1569-1705 et 1572-9826, DOI 10.1007/s11157-020-09564-8, lire en ligne, consulté le ).
- 1 2 (en) « The roof of the Alps yields clues to a toxic-pollutant puzzle », Nature, (DOI 10.1038/d41586-022-01944-0, lire en ligne, consulté le ).
- 1 2 3 4 (en) Nelson Belzile et Yu-Wei Chen, « Thallium in the environment : A critical review focused on natural waters, soils, sediments and airborne particles », Applied Geochemistry, vol. 84, , p. 218–243 (DOI 10.1016/j.apgeochem.2017.06.013, lire en ligne, consulté le ).
- 1 2 3 « Rapport sur un mémoire de M. Lamy, relatif au thallium », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 55, , p. 866 (ISSN 0001-4036, e-ISSN 2419-6304, BNF 34348108, SUDOC 03743201X, lire en ligne sur Gallica).
- ↑ (en) William Mahoney, « From depilatory cream : Report of three cases », Journal of the American Medical Association, vol. 98, no 8, , p. 618 (ISSN 0002-9955, DOI 10.1001/jama.1932.02730340026006, lire en ligne, consulté le ).
- ↑ (de) William Crookes, « Ueber die Opacität der gelben Natronflamme für Licht von ihrer eigenen Farbe », Annalen der Physik und Chemie, vol. 188, no 2, , p. 344–346 (ISSN 0003-3804 et 1521-3889, DOI 10.1002/andp.18611880210, lire en ligne, consulté le ).
- ↑ (en) William Crookes, « VIII. Preliminary researches on thallium », Proceedings of the Royal Society of London, vol. 12, , p. 150–159 (ISSN 0370-1662 et 2053-9126, DOI 10.1098/rspl.1862.0030, lire en ligne, consulté le ).
- ↑ (en) William Crookes et George Gabriel Stokes, « VIII. Preliminary researches on thallium », Proceedings of the Royal Society of London, vol. 12, , p. 150–159 (DOI 10.1098/rspl.1862.0030, lire en ligne, consulté le ).
- ↑ (en) William Crookes et George Gabriel Stokes, « IX. On thallium », Philosophical Transactions of the Royal Society of London, vol. 153, , p. 173–192 (DOI 10.1098/rstl.1863.0009, lire en ligne, consulté le ).
- 1 2 Claude-Auguste Lamy, « Sur les effets toxiques du thallium », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 57, , p. 442 (ISSN 0001-4036, e-ISSN 2419-6304, BNF 34348108, SUDOC 03743201X, lire en ligne sur Gallica).
- ↑ (de) H. Ludwig, « Ueber das Thallium, nach Lamy », Archiv der Pharmazie, vol. 166, no 3, , p. 253–256 (ISSN 0365-6233 et 1521-4184, DOI 10.1002/ardp.18631660331, lire en ligne, consulté le ).
- ↑ Claude-Auguste Lamy, « De l'existence d'un nouveau métal, le thallium », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 54, , p. 1255-1258 (ISSN 0001-4036, e-ISSN 2419-6304, BNF 34348108, SUDOC 03743201X, lire en ligne sur Gallica).
- ↑ M. Paulet, « Expériences sur l’action physiologique des sels de thallium », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 57, , p. 494-495 (ISSN 0001-4036, e-ISSN 2419-6304, BNF 34348108, SUDOC 03743201X, lire en ligne sur Gallica).
- ↑ Grandeau, L.: Jahresber, Chem., 1863: 256.
- 1 2 Louis Grandeau, « Des sels de potassium », Journal de l'anatomie et de la physiologie normales et pathologiques de l'homme et des animaux, t. 1, , p. 384 (ISSN 0368-3788, e-ISSN 2391-131X, BNF 34378291, SUDOC 037927620, lire en ligne sur Gallica).
- 1 2 3 (en) Wen Zhuang et Jinming Song, « Thallium in aquatic environments and the factors controlling Tl behavior », Environmental Science and Pollution Research, vol. 28, no 27, , p. 35472–35487 (ISSN 0944-1344 et 1614-7499, DOI 10.1007/s11356-021-14388-2, lire en ligne, consulté le ).
- ↑ P. Jaulmes et G. Hamelle, « Présence et taux des oligo-Éléments dans les aliments et les boissons de l'homme », Annales de la nutrition et de l'alimentation, vol. 25, , B133–B201 (ISSN 0003-4037, lire en ligne, consulté le )
- ↑ (en) Wen Zhuang, Min Liu, Jinming Song et Samantha C. Ying, « Retention of thallium by natural minerals: A review », Science of The Total Environment, vol. 777, , p. 146074 (DOI 10.1016/j.scitotenv.2021.146074, lire en ligne, consulté le ).
- 1 2 3 4 (en) A.L. John Peter et T. Viraraghavan, « Thallium: a review of public health and environmental concerns », Environment International, vol. 31, no 4, , p. 493–501 (DOI 10.1016/j.envint.2004.09.003, lire en ligne, consulté le ).
- 1 2 3 4 5 6 (en) A.L. John Peter et T. Viraraghavan, « Thallium: a review of public health and environmental concerns », Environment International, vol. 31, no 4, , p. 493–501 (ISSN 0160-4120, DOI 10.1016/j.envint.2004.09.003, lire en ligne, consulté le ).
- 1 2 3 Agence régionale de santé Normandie, Le thallium dans les eaux destinées à la consommation humaine : bilan 2011-2018 en Normandie (rapport), , 24 p. (lire en ligne [PDF]).
- 1 2 3 (en) Jerome O. Nriagu, « Thallium », Chemical & Engineering News, vol. 81, no 36, , p. 153 (ISSN 0009-2347, e-ISSN 1520-605X, DOI 10.1021/cen-v081n036.p153).
- ↑ (en) Marc J. Assael, Ivi J. Armyra, Juergen Brillo et Sergei V. Stankus, « Reference Data for the Density and Viscosity of Liquid Cadmium, Cobalt, Gallium, Indium, Mercury, Silicon, Thallium, and Zinc », Journal of Physical and Chemical Reference Data, vol. 41, no 3, , p. 033101 (ISSN 0047-2689 et 1529-7845, DOI 10.1063/1.4729873, lire en ligne, consulté le ).
- 1 2 (en) Alfred A. Levinson, Introduction to exploration geochemistry, Wilmette, Applied Publishing Ltd., , 2e éd., 924 p. (ISBN 0-915834-01-4 et 0-915834-04-9, OCLC 681433165, LCCN 79054677, SUDOC 019643993, présentation en ligne, disponible sur Internet Archive
 ).
). - 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 (en) Francis F. Heyroth, Thallium, a review and summary of medical literature, Washington, Bureau d'impression du gouvernement des États-Unis, (BNF 33896438, présentation en ligne, lire en ligne [PDF]).
- 1 2 3 (en) Kateřina Vejvodová, Aleš Vaněk, Ondřej Drábek et Marko Spasić, « Understanding stable Tl isotopes in industrial processes and the environment : A review », Journal of Environmental Management, vol. 315, , p. 115151 (DOI 10.1016/j.jenvman.2022.115151, lire en ligne, consulté le ).
- ↑ Anne Tremel, Transfert du thallium du sol vers la plante : caractérisation du risque dans les agrosystèmes (thèse de doctorat en sciences agronomiques), (HAL tel-01776387, lire en ligne [PDF]).
- ↑ (en) Jeffrey J. Polovina, Evan A. Howell et Melanie Abecassis, « Ocean's least productive waters are expanding », Geophysical Research Letters, vol. 35, no 3, (ISSN 0094-8276, DOI 10.1029/2007gl031745, lire en ligne, consulté le ).
- ↑ (en) « Thallium », dans Van Nostrand's Scientific Encyclopedia, John Wiley & Sons, (ISBN 978-0-471-74398-9, DOI 10.1002/0471743984.vse6990.pub2, lire en ligne).
- 1 2 3 (en) Oliver F. Schedlbauer et Klaus G. Heumann, « Biomethylation of thallium by bacteria and first determination of biogenic dimethylthallium in the ocean », Applied Organometallic Chemistry, vol. 14, no 6, , p. 330–340 (ISSN 0268-2605 et 1099-0739, DOI 10.1002/(sici)1099-0739(200006)14:6<330::aid-aoc994>3.0.co;2-y, <330::aid-aoc994>3.0.co;2-y lire en ligne, consulté le ).
- ↑ (en) E. Sabbioni, L. Goetz, E. Marafante et C. Gregotti, « Metabolic fate of different inorganic and organic species of thallium in the rat », Science of The Total Environment, vol. 15, no 2, , p. 123–135 (DOI 10.1016/0048-9697(80)90003-0, lire en ligne, consulté le ).
- ↑ (en) John A.C. Fortescue, « Landscape geochemistry: retrospect and prospect—1990 », Applied Geochemistry, vol. 7, no 1, , p. 1–53 (DOI 10.1016/0883-2927(92)90012-R, lire en ligne, consulté le ).
- ↑ (en) Peter C. Rickwood, « Crustal Abundance, Distribution, and Crystal Chemistry of the Elements », dans Handbook of Exploration Geochemistry, vol. 3 : Rock Geochemistry in Mineral Exploration, Amsterdam, Elsevier, (ISBN 0-444-42021-5, ISSN 0168-6275, DOI 10.1016/B978-0-444-42021-3.50019-7, SUDOC 004940555, lire en ligne), p. 347-387.
- ↑ (en) K. Hans Wedepohl, chap. 7 « The composition of the continental crust », dans Geochimica et Cosmochimica Acta, vol. 59, (DOI 10.1016/0016-7037(95)00038-2, lire en ligne), p. 1217–1232.
- ↑ (en) Alina Kabata-Pendiana et Henryk Pendias, Trace elements in soils and plants, Boca Raton, CRC Press, , 3e éd. (ISBN 0-8493-1575-1, BNF 37734514, SUDOC 061067857, lire en ligne [PDF]), table 82.
- 1 2 3 4 5 6 (en) Denis M. Shaw, « The geochemistry of thallium », Geochimica et Cosmochimica Acta, vol. 2, no 2, , p. 118–154 (DOI 10.1016/0016-7037(52)90003-3, lire en ligne, consulté le ).
- ↑ Présentation des nodules polymétalliques
- ↑ (en) « fly_ash », sur glossary.slb.com (consulté le ).
- ↑ (en) Chao-qiang Wang, Ke Liu et De-ming Huang, « Property of concrete made of recycled shale gas drilling cuttings », Environmental Science and Pollution Research, vol. 29, no 2, , p. 2098–2106 (ISSN 1614-7499, DOI 10.1007/s11356-021-15817-y, lire en ligne, consulté le ).
- ↑ (en) Bamdad Ayati, Chloe Molineux, Darryl Newport et Christopher Cheeseman, « Manufacture and performance of lightweight aggregate from waste drill cuttings », Journal of Cleaner Production, vol. 208, , p. 252–260 (ISSN 0959-6526, DOI 10.1016/j.jclepro.2018.10.134, lire en ligne, consulté le ).
- ↑ (en) V. Zitko, « Toxicity and pollution potential of thallium », Science of The Total Environment, vol. 4, no 2, , p. 185–192 (ISSN 0048-9697, DOI 10.1016/0048-9697(75)90039-X, lire en ligne, consulté le ).
- ↑ (en) Tangfu Xiao, Dan Boyle, Jayanta Guha et Alain Rouleau, « Groundwater-related thallium transfer processes and their impacts on the ecosystem: southwest Guizhou Province, China », Applied Geochemistry, vol. 18, no 5, , p. 675–691 (DOI 10.1016/S0883-2927(02)00154-3, lire en ligne, consulté le ).
- ↑ (en) N.J. Fortey, « J.L. Jambor, D.W. Blowes and A.I.M. Ritchie (Eds) Environmental Aspects of Mine Wastes. Mineralogical Association of Canada, Short Course Series Volume 31, 2003, 430 pp. (ISBN 0-921294-31-X). », Mineralogical Magazine, vol. 68, no 2, , p. 415–417 (ISSN 0026-461X et 1471-8022, DOI 10.1180/s0026461x00032497, lire en ligne, consulté le ).
- ↑ (en) Corinne Casiot, Marion Egal, Odile Bruneel et Neelam Verma, « Predominance of Aqueous Tl(I) Species in the River System Downstream from the Abandoned Carnoulès Mine (Southern France) », Environmental Science & Technology, vol. 45, no 6, , p. 2056–2064 (ISSN 0013-936X et 1520-5851, DOI 10.1021/es102064r, lire en ligne, consulté le ).
- ↑ (en) Riccardo Petrini, Rosa Cidu et Francesca F. Slejko, « Thallium Contamination in the Raibl Mine Site Stream Drainage System (Eastern Alps, Italy) », Mine Water and the Environment, vol. 35, no 1, , p. 55–63 (ISSN 1025-9112 et 1616-1068, DOI 10.1007/s10230-015-0346-4, lire en ligne, consulté le ).
- 1 2 3 4 5 6 (en) Beatrice Campanella, Massimo Onor, Alessandro D'Ulivo et Roberto Giannecchini, « Human exposure to thallium through tap water: A study from Valdicastello Carducci and Pietrasanta (northern Tuscany, Italy) », Science of The Total Environment, vol. 548-549, , p. 33–42 (DOI 10.1016/j.scitotenv.2016.01.010, lire en ligne, consulté le ) (voir notamment le graphique du résumé)
- ↑ (en) Martina Perotti, Riccardo Petrini, Massimo D’Orazio et Lisa Ghezzi, « Thallium and Other Potentially Toxic Elements in the Baccatoio Stream Catchment (Northern Tuscany, Italy) Receiving Drainages from Abandoned Mines », Mine Water and the Environment, vol. 37, no 3, , p. 431–441 (ISSN 1025-9112 et 1616-1068, DOI 10.1007/s10230-017-0485-x, lire en ligne, consulté le ).
- 1 2 (en) Juan Liu, Xuwen Luo, Yuqing Sun et Daniel C.W. Tsang, « Thallium pollution in China and removal technologies for waters: A review », Environment International, vol. 126, , p. 771–790 (DOI 10.1016/j.envint.2019.01.076, lire en ligne, consulté le ).
- ↑ (en) Jerome O. Nriagu, Thallium in the environment, New York, John Wiley & Sons, coll. « Wiley series in advances in environmental science and technology » (no 29), , 284 p. (ISBN 0-471-17755-5, BNF 37531419, SUDOC 008129614).
- ↑ (en) Programme international sur la sécurité des substances chimiques, Thallium (rapport), Genève, Organisation mondiale de la santé, coll. « Environmental health criteria » (no 182), , 274 p. (ISBN 92-4-157182-9, BNF 35831273, SUDOC 005323665, lire en ligne).
- 1 2 (en) Ven Cheam, « Thallium Contamination of Water in Canada », Water Quality Research Journal, vol. 36, no 4, , p. 851–877 (ISSN 1201-3080 et 2408-9443, DOI 10.2166/wqrj.2001.046, lire en ligne, consulté le ).
- 1 2 3 (en) Jin Wang, Yeliang Huang, Jingzi Beiyuan et Xudong Wei, « Thallium and potentially toxic elements distribution in pine needles, tree rings and soils around a pyrite mine and indication for environmental pollution », Science of The Total Environment, vol. 828, , p. 154346 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2022.154346, lire en ligne, consulté le ).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Santé Canada et Environnement et Changement climatique Canada, « Ébauche d’évaluation préalable Le thallium et ses composés (PDF, 1,34 Mo) », sur canada.ca, (consulté le ).
- 1 2 3 4 5 (en) Lucila Álvarez-Barrera, Juan. J. Rodríguez-Mercado, Rodrigo A. Mateos-Nava et Yazmín Vázquez-Martínez, « Effect on the offspring of pregnant females CD-1 mice treated with a single thallium(I) application », Reproductive Toxicology, vol. 90, , p. 1–7 (ISSN 0890-6238, DOI 10.1016/j.reprotox.2019.07.022, lire en ligne, consulté le ).
- ↑ (en) Patrice de Caritat et Clemens Reimann, « Publicly available datasets on thallium (Tl) in the environment—a comment on “Presence of thallium in the environment: sources of contaminations, distribution and monitoring methods” by Bozena Karbowska, Environ Monit Assess (2016) 188:640 (DOI 10.1007/s10661-016-5647-y) », Environmental Monitoring and Assessment, vol. 189, no 5, , p. 232 (ISSN 0167-6369 et 1573-2959, PMID 28444610, PMCID PMC5405092, DOI 10.1007/s10661-017-5945-z, lire en ligne, consulté le ).
- ↑ (en) Minerals Yearbook, 1942, p. 829 ; 1943, p. 829-830 ; 1944, p. 820-1 ; 1945, p. 824-5 ; 1946, p. 1281. Cité par H. E. Howe et A. A. Smith Jr., « Properties and Uses of Thallium », Journal of the Electrochemical Society, vol. 97, no 8, , p. 167C, 169C (ISSN 0013-4651, e-ISSN 1945-7111, OCLC 4657503092, DOI 10.1149/1.2778000, S2CID 97623122, CiteSeerx 10.1.1.918.4831, lire en ligne [PDF]).
- ↑ (en) Department of Public Health and Environment, « Asarco Inc. — Globe Plant » (fiche) (consulté le ).
- ↑ (de) G. Zartner-Nyilas, H. Valentin, K. H. Schaller et R. Schiele, Thallium - ecological, environmental, medical and industrial significance. Thallium - oekologische, umweltmedizinische und industrielle Bedeutung, (lire en ligne).
- ↑ Jean-Paul Hebert, « Le commerce des armes : le minimum mortel pour tous », Hommes et Libertés, no 25, (ISSN 0180-8524, e-ISSN 1777-5590, lire en ligne [PDF]).
- 1 2 Kevin Jiang, « Identification des importations canadiennes vulnérables » (étude), sur international.gc.ca, (consulté le ).
- ↑ (en) Halliburton, U.S. Shale Gas : An Unconventional Resource. Unconventional Challenges (livre blanc), Halliburton, , 8 p. (présentation en ligne, lire en ligne [PDF]), p. 5, paragraphe intitulé « The Marcellus Shale – Appalachian Basin ».
- 1 2 3 (en) Noura Abualfaraj, Patrick L. Gurian et Mira S. Olson, « Characterization of Marcellus Shale Flowback Water », Environmental Engineering Science, vol. 31, no 9, , p. 514–524 (ISSN 1092-8758 et 1557-9018, DOI 10.1089/ees.2014.0001, lire en ligne, consulté le ).
- ↑ (en) Anna Stamp, Daniel J. Lang et Patrick A. Wäger, « Environmental impacts of a transition toward e-mobility: the present and future role of lithium carbonate production », Journal of Cleaner Production, vol. 23, no 1, , p. 104–112 (ISSN 0959-6526, DOI 10.1016/j.jclepro.2011.10.026, lire en ligne, consulté le ).
- 1 2 (en) Thai T. Phan, Leah Fulton, John Ulkem et Steve Aiken, « Lepidolite extraction solid by-product: Mitigation of thallium leaching and utilization of radiogenic strontium isotopes as a tracer », Environmental Advances, vol. 3, , p. 100035 (DOI 10.1016/j.envadv.2021.100035, lire en ligne, consulté le ).
- ↑ (en) Riccardo Petrini, Rosa Cidu et Francesca F. Slejko, « Thallium Contamination in the Raibl Mine Site Stream Drainage System (Eastern Alps, Italy) », Mine Water and the Environment, vol. 35, no 1, , p. 55–63 (ISSN 1025-9112 et 1616-1068, DOI 10.1007/s10230-015-0346-4, lire en ligne, consulté le ).
- ↑ (en) Musah Salifu, Thomas Aiglsperger, Lina Hällström et Olof Martinsson, « Strontium (87Sr/86Sr) isotopes: A tracer for geochemical processes in mineralogically-complex mine wastes », Applied Geochemistry, vol. 99, , p. 42–54 (ISSN 0883-2927, DOI 10.1016/j.apgeochem.2018.10.022, lire en ligne, consulté le ).
- 1 2 3 4 Manuel sur l'environnement, vol. 3 : Catalogue des normes antipollution, Brunswick, Vieweg, , 663 p. (ISBN 3-528-02312-0, lire en ligne), chap. 5 (« Substances chimiques et groupes de substances/registre des substances »), « 5.4.4 Fiches d'information classées selon les substances chimiques et groupes de substances - par ordre alphabétique », « Thallium ».
- ↑ (en) J. Wilke, « Nickel in the environment. Herausgegeben von J. O. NRIAGU. 833 Seiten, 81 Abb., 130 Tab. John Wiley and Sons, New York, Chichester, Brisbane, Toronto 1980. », Food / Nahrung, vol. 26, no 9, , p. 847–848 (ISSN 0027-769X et 1521-3803, DOI 10.1002/food.19820260991, lire en ligne, consulté le ).
- ↑ (en) Kenneth T. Douglas, Marlene A. Bunni et Swati R. Baindur, « Thallium in biochemistry », International Journal of Biochemistry, vol. 22, no 5, , p. 429–438 (DOI 10.1016/0020-711X(90)90254-Z, lire en ligne, consulté le ).
- ↑ (en) C. David Weaver, « Thallium Flux Assay for Measuring the Activity of Monovalent Cation Channels and Transporters », dans Potassium Channels, vol. 1684, Springer New York, , 105–114 p. (ISBN 978-1-4939-7361-3, DOI 10.1007/978-1-4939-7362-0_9, lire en ligne).
- ↑ (en) Bożena Muszyńska, Jacek Rojowski, Konrad Dobosz et Włodzimierz Opoka, « Biological and physico-chemical properties of thallium », Medicina Internacia Revuo, vol. 105, no 26, , p. 180–185 (ISSN 0465-5453 (édité erroné) et 0465-5435, lire en ligne, consulté le ).
- ↑ White Dr., « The Dermatergoses or Occupational Affections of the Skin », Archives of Dermatology and Syphilology, vol. 19, no 5, , p. 858–859 (ISSN 0096-6029, DOI 10.1001/archderm.1929.02380230148018, lire en ligne, consulté le ).
- 1 2 (en) Robert S. Hoffman et Robert Hoffman, « Thallium Poisoning During Pregnancy: A Case Report and Comprehensive Literature Review », Journal of Toxicology: Clinical Toxicology, vol. 38, no 7, , p. 767–775 (ISSN 0731-3810, PMID 11192464, DOI 10.1081/CLT-100102390, lire en ligne, consulté le ).
- ↑ « Le traitement des teignes par l'acétate de thallium », Archives of Dermatology, vol. 19, no 5, , p. 858 (ISSN 0003-987X, DOI 10.1001/archderm.1929.02380230148017, lire en ligne, consulté le ).
- ↑ Bureau Y, Jarry A & Barrière A (1957) L'acétate de thallium dans le traitement des teignes scolaires. Bull. Soc. Fr. Derm. Syph., 64, 105-6.
- ↑ Lecocq J (1939) Contribution à l'étude de la prophylaxie des teignes par l'acétate de thallium (Doctoral dissertation, Faculté de médecine de Paris).
- ↑ (en) C. W. Hewlet, « High Sensitivity Photo-Conductive Cell », General Electric review, vol. 50, no 4, , p. 22 (ISSN 0095-9480).
- ↑ (en) L. V. Zhukova, A. E. Lvov, A. S. Korsakov et D. D. Salimgareev, « Domestic Developments of IR Optical Materials Based on Solid Solutions of Silver Halogenides and Monovalent Thallium », Optics and Spectroscopy, vol. 125, no 6, , p. 933–943 (ISSN 1562-6911, DOI 10.1134/S0030400X18120238, lire en ligne, consulté le ).
- ↑ Howe H.E & Smith A.A (1950) Properties and uses of thallium. Journal of The Electrochemical Society, 97(8), 167C. |URL=https://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.918.4831&rep=rep1&type=pdf
- ↑ (en) S. C. Speller, « Thallium based high temperature superconductors for microwave device applications », Materials Science and Technology, vol. 19, no 3, , p. 269–282 (ISSN 0267-0836, DOI 10.1179/026708303225009724, lire en ligne, consulté le ).
- ↑ (en) Terry L. Aselage, Jim A. Voigt et Keith D. Keefer, « Instability of Thallium-Containing Superconductor Phases in Isothermal Equilibrium with Thallium Oxide », Journal of the American Ceramic Society, vol. 73, no 11, , p. 3345–3350 (ISSN 0002-7820 et 1551-2916, DOI 10.1111/j.1151-2916.1990.tb06459.x, lire en ligne, consulté le ).
- ↑ (en) Y. Hwu, M. Marsi, A. Terrasi et M. Onellion, « Photoemission search for an RVB state in novel thallium‐compound high‐temperature superconductors », AIP Conference Proceedings, vol. 200, no 1, , p. 49–52 (ISSN 0094-243X, DOI 10.1063/1.39057, lire en ligne, consulté le ).
- ↑ (en) J. Brynestad, M. Paranthaman, A. Goyal et D.E. Heatherly, « Formation of thallium based high temperature superconductors using aerosol flow reacted precursor powders », Harold A. Oeye international symposium (conférence), (lire en ligne, consulté le ).
- ↑ « Thallium », sur universalis.fr.
- ↑ (en) Asiatic Petroleum Company et Alfred C. Egerton, « Use of Thallium and its Compounds to Prevent Knocking in Internal Combustion Engines », présentation en ligne sur Google Livres. Brevet GB 279560 demandé le 29 juillet 1926.
- ↑ (en) Alice V. Petar, Thallium, Washington, United States Bureau of Mine, coll. « Information circular » (no 6453), , 6 p. (OCLC 681511982, présentation en ligne, lire en ligne).
- ↑ (en) Joaquim Sanz, Oriol Tomasa, Abigail Jimenez-Franco et Nor Sidki-Rius, « Thallium (Tl) [Z = 81] », Elements and Mineral Resources, Springer International Publishing, , p. 223–225 (ISBN 978-3-030-85889-6, DOI 10.1007/978-3-030-85889-6_56, lire en ligne, consulté le ).
- ↑ (en) Zijian Li, Devon B. Cole, Sean M. Newby et Jeremy D. Owens, « New constraints on mid-Proterozoic ocean redox from stable thallium isotope systematics of black shales », Geochimica et Cosmochimica Acta, vol. 315, , p. 185–206 (DOI 10.1016/j.gca.2021.09.006, lire en ligne, consulté le ).
- ↑ (en) M. Antonia López Antón, D. Alan Spears, Mercedes Díaz Somoano et M. Rosa Martínez Tarazona, « Thallium in coal: Analysis and environmental implications », Fuel, vol. 105, , p. 13–18 (DOI 10.1016/j.fuel.2012.08.004, lire en ligne, consulté le ).
- 1 2 3 4 5 6 7 (en) Tangfu Xiao, Jayanta Guha, Dan Boyle et Cong-Qiang Liu, « Naturally occurring thallium: a hidden geoenvironmental health hazard? », Environment International, vol. 30, no 4, , p. 501–507 (ISSN 0160-4120, DOI 10.1016/j.envint.2003.10.004, lire en ligne, consulté le ).
- ↑ (en) Aleš Vaněk, Zuzana Grösslová, Martin Mihaljevič et Vojtěch Ettler, « Thallium contamination of soils/vegetation as affected by sphalerite weathering: A model rhizospheric experiment », Journal of Hazardous Materials, vol. 283, , p. 148–156 (DOI 10.1016/j.jhazmat.2014.09.018, lire en ligne, consulté le ).
- ↑ MISA (1989) MISA (Municipal/Industrial Strategy for Abatement), preliminary report for the first six months of monitoring in the petroleum refining sector (December 1, 1988, to May 31, 1989). Environment Ontario, Ontario, Canada
- ↑ (en) Juan Liu et Meiling Yin, « Thallium isotopic fractionation in industrial process of pyrite smelting and environmental implications », sur Journal of Hazardous Materials, (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2019.121378, consulté le ), p. 121378.
- 1 2 (en) Chunxia Yang, Yongheng Chen, Ping'an Peng et Chao Li, « Distribution of natural and anthropogenic thallium in the soils in an industrial pyrite slag disposing area », Science of The Total Environment, vol. 341, nos 1-3, , p. 159–172 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2004.09.024, lire en ligne, consulté le ).
- ↑ (en) Juan Liu et Nuo Li, « Thallium contamination in farmlands and common vegetables in a pyrite mining city and potential health risks », sur Environmental Pollution, (ISSN 0269-7491, DOI 10.1016/j.envpol.2019.02.092, consulté le ), p. 906–915.
- ↑ (en) YongHeng Chen et ChunLin Wang, « Environmental exposure and flux of thallium by industrial activities utilizing thallium-bearing pyrite », sur Science China Earth Sciences, (ISSN 1869-1897, DOI 10.1007/s11430-013-4621-6, consulté le ), p. 1502–1509.
- 1 2 (en) Luke L. George et Cristian Biagioni, « The speciation of thallium in (Tl,Sb,As)-rich pyrite », sur Ore Geology Reviews, (DOI 10.1016/j.oregeorev.2019.02.031, consulté le ), p. 364–380.
- ↑ (en) A. Brockhaus, R. Dolgner, U. Ewers et U. Kramer, « Intake and health effects of thallium among a population living in the vicinity of a cement plant emitting thallium containing dust », International Archives of Occupational and Environmental Health, vol. 48, no 4, , p. 375–389 (ISSN 0340-0131 et 1432-1246, DOI 10.1007/bf00378686, lire en ligne, consulté le ).
- 1 2 (en) Krzysztof Dmowski, Monika Rossa, Joanna Kowalska et Beata Krasnodębska-Ostręga, « Thallium in spawn, juveniles, and adult common toads (Bufo bufo) living in the vicinity of a zinc-mining complex, Poland », Environmental Monitoring and Assessment, vol. 187, no 1, , p. 4141 (ISSN 0167-6369 et 1573-2959, DOI 10.1007/s10661-014-4141-7, lire en ligne, consulté le ).
- 1 2 (pl) Krzysztof Dmowski, Anna Kozakiewicz et Michał Kozakiewicz, « Bioindykacyjne poszukiwania talu na terenach południowej Polski », Kosmos, vol. 51, no 2, , p. 151–163 (ISSN 2658-1132, lire en ligne, consulté le ).
- 1 2 (en) Sonia Galván-Arzate et Abel Santamarı́a, « Thallium toxicity », Toxicology Letters, vol. 99, no 1, , p. 1–13 (ISSN 0378-4274, DOI 10.1016/s0378-4274(98)00126-x, lire en ligne, consulté le ).
- 1 2 (en) Xavier Querol, JoséLuis Fernández-Turiel et Angel López-Soler, « Trace elements in coal and their behaviour during combustion in a large power station », Fuel, vol. 74, no 3, , p. 331–343 (ISSN 0016-2361, DOI 10.1016/0016-2361(95)93464-o, lire en ligne, consulté le ).
- ↑ B. Karbowska (2004) Woltamperometryczne oznaczanie talu w roztworach otrzymanych po sekwencyjnej ekstrakcji gleby. Poznań: Praca doktorska. Politechnika Poznańska.
- ↑ (en) Petra Cvjetko, Ivan Cvjetko et Mirjana Pavlica, « Thallium Toxicity in Humans », Archives of Industrial Hygiene and Toxicology, vol. 61, no 1, , p. 111–119 (ISSN 0004-1254, DOI 10.2478/10004-1254-61-2010-1976, lire en ligne, consulté le ).
- ↑ Galba J (1982) Analysis of trace concentrations of phytotoxic elements in solid emissions from the thermal power plant ENO in soil and plants. Pol’nohospodàrstvo 28:293–306, (Cité par le GIEC en 1996)
- 1 2 (en) Robert B. Finkelman, « Trace elements in coal », Biological Trace Element Research, vol. 67, no 3, , p. 197–204 (ISSN 0163-4984 et 1559-0720, DOI 10.1007/bf02784420, lire en ligne, consulté le ).
- 1 2 3 4 5 Pendias H & Pendias-Kabata A (1999) Biogeochemia pierwiastków śladowych. Wydawnictwo Naukowe PWN, Varsovie
- ↑ Sarc R, Pomberger R et Lorber K.E (2017) Innovative Technical Solutions for Reduction of Waste Fuel Specific Emissions in Cement Plants. In Waste Management (pp. 475-497).
- 1 2 (pl) A. Kicińska, « Arsen i tal w glebach i roślinach rejonu Bukowna », Ochrona Środowiska i Zasobów Naturalnych, no 40, , p. 199–208.
- ↑ (en) Marçal Pires et Xavier Querol, « Characterization of Candiota (South Brazil) coal and combustion by-product », sur International Journal of Coal Geology, (DOI 10.1016/j.coal.2004.04.003, consulté le ), p. 57–72.
- ↑ (en) Janaina Levandowski et Wolfgang Kalkreuth, « Chemical and petrographical characterization of feed coal, fly ash and bottom ash from the Figueira Power Plant, Paraná, Brazil », sur International Journal of Coal Geology, (DOI 10.1016/j.coal.2008.05.005, consulté le ), p. 269–281.
- ↑ (en) Astrid R. Jacobson, Murray B. McBride, Philippe Baveye et Tammo S. Steenhuis, « Environmental factors determining the trace-level sorption of silver and thallium to soils », Science of The Total Environment, vol. 345, no 1, , p. 191–205 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2004.10.027, lire en ligne, consulté le ).
- ↑ Liu, M et al. (2022) |Titre=Document details - Microplastics as a Vehicle of Thallium in Aquatic Environments: Mechanisms and Adsorption Factors |date=21 juin 2022 (prépublication) |éditeur=SSRN | (ISSN 1556-5068) |URL=https://www.scopus.com/record/display.uri?eid=2-s2.0-85132862359&origin=inward&txGid=864f27862748ea2b43c84f19bfc1d203&featureToggles=FEATURE_NEW_DOC_DETAILS_EXPORT:1,FEATURE_EXPORT_REDESIGN:0
- ↑ Loic Martin, Mobilité du thallium et du radium dans l'environnement, Institut de Physique du Globe de Paris (IPGP), France, (lire en ligne).
- 1 2 (en) A.G. Lee, « The coordination chemistry of thallium(I) », Coordination Chemistry Reviews, vol. 8, no 4, , p. 289–349 (DOI 10.1016/S0010-8545(00)80001-6, lire en ligne, consulté le ).
- 1 2 (en) Tser-Sheng Lin et Jerome O. Nriagu, « Speciation of Thallium in Natural Waters », dans Jerome O. Nriagu, Thallium in the environment, New York, John Wiley & Sons, (ISBN 0-471-17755-5), p. 31-34.
- ↑ (en) Yongliang Xiong et Yongliang Xiong, « The aqueous geochemistry of thallium: speciation and solubility of thallium in low temperature systems », Environmental Chemistry, vol. 6, no 5, , p. 441–451 (ISSN 1449-8979 et 1449-8979, DOI 10.1071/EN08086, lire en ligne, consulté le ).
- ↑ Lin, T. S., & Nriagu, J. (1999). Thallium speciation in the Great Lakes. Environmental science & technology, 33(19), 3394-3397 URL=https://pubs.acs.org/doi/abs/10.1021/es981096o
- 1 2 (en) Caroline L. Peacock et Ellen M. Moon, « Oxidative scavenging of thallium by birnessite: Explanation for thallium enrichment and stable isotope fractionation in marine ferromanganese precipitates », Geochimica et Cosmochimica Acta, vol. 84, , p. 297–313 (ISSN 0016-7037, DOI 10.1016/j.gca.2012.01.036, lire en ligne, consulté le ).
- 1 2 3 4 5 6 (en) Andreas Voegelin, Numa Pfenninger, Julia Petrikis et Juraj Majzlan, « Thallium Speciation and Extractability in a Thallium- and Arsenic-Rich Soil Developed from Mineralized Carbonate Rock », Environmental Science & Technology, vol. 49, no 9, , p. 5390–5398 (ISSN 0013-936X et 1520-5851, DOI 10.1021/acs.est.5b00629, lire en ligne, consulté le ).
- ↑ (en) Beatrice Campanella, Corinne Casiot, Massimo Onor et Martina Perotti, « Thallium release from acid mine drainages: Speciation in river and tap water from Valdicastello mining district (northwest Tuscany) », Talanta, vol. 171, , p. 255–261 (ISSN 0039-9140, DOI 10.1016/j.talanta.2017.05.009, lire en ligne, consulté le ).
- ↑ (en) G. E. Batley et T. M. Florence, « Determination of thallium in natural waters by anodic stripping voltammetry », Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, vol. 61, no 2, , p. 205–211 (ISSN 0022-0728, DOI 10.1016/S0022-0728(75)80251-8, lire en ligne, consulté le ).
- 1 2 3 4 5 (en) Michael R. Twiss, Benjamin S. Twining et Nicholas S. Fisher, « Bioconcentration of inorganic and organic thallium by freshwater phytoplankton », Environmental Toxicology and Chemistry, vol. 23, no 4, , p. 968 (ISSN 0730-7268 et 1552-8618, DOI 10.1897/02-643, lire en ligne, consulté le ).
- ↑ (en) Michael R. Twiss, Benjamin S. Twining et Nicholas S. Fisher, « Bioconcentration of inorganic and organic thallium by freshwater phytoplankton », Environmental Toxicology and Chemistry, vol. 23, no 4, , p. 968 (ISSN 0730-7268 et 1552-8618, DOI 10.1897/02-643, lire en ligne, consulté le ).
- ↑ (en) Tangfu Xiao, Fei Yang, Shehong Li et Baoshan Zheng, « Thallium pollution in China: A geo-environmental perspective », Science of The Total Environment, special Section: Reviews of Trace Metal Pollution in China, vol. 421-422, , p. 51–58 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2011.04.008, lire en ligne, consulté le ).
- 1 2 3 4 (en) Huan-Yun Yu, Chunying Chang, Fangbai Li et Qi Wang, « Thallium in flowering cabbage and lettuce: Potential health risks for local residents of the Pearl River Delta, South China », Environmental Pollution, vol. 241, , p. 626–635 (DOI 10.1016/j.envpol.2018.05.090, lire en ligne, consulté le ).
- ↑ (en) Yanjun Jiang, Xudong Wei, Hongping He et Jingye She, « Transformation and fate of thallium and accompanying metal(loid)s in paddy soils and rice: A case study from a large-scale industrial area in China », Journal of Hazardous Materials, vol. 423, , p. 126997 (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2021.126997, lire en ligne, consulté le ).
- ↑ (en) Tangfu Xiao, Fei Yang, Shehong Li et Baoshan Zheng, « Thallium pollution in China: A geo-environmental perspective », Science of The Total Environment, special Section: Reviews of Trace Metal Pollution in China, vol. 421-422, , p. 51–58 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2011.04.008, lire en ligne, consulté le ).
- 1 2 3 (en) Qiaohui Zhong, Jianying Qi, Juan Liu et Jin Wang, « Thallium isotopic compositions as tracers in environmental studies: A review », Environment International, vol. 162, , p. 107148 (ISSN 0160-4120, DOI 10.1016/j.envint.2022.107148, lire en ligne, consulté le ).
- ↑ (en) Carlos Ruiz Cánovas, María Dolores Basallote, Francisco Macías et Rémi Freydier, « Thallium distribution in an estuary affected by acid mine drainage (AMD): The Ría de Huelva estuary (SW Spain) », Environmental Pollution, vol. 306, , p. 119448 (ISSN 0269-7491, DOI 10.1016/j.envpol.2022.119448, lire en ligne, consulté le ).
- ↑ (en) Javier Aguilar-Carrillo, Lidya Herrera, Emmanuel J. Gutiérrez et Iván A. Reyes-Domínguez, « Solid-phase distribution and mobility of thallium in mining-metallurgical residues: Environmental hazard implications », Environmental Pollution, vol. 243, , p. 1833–1845 (ISSN 0269-7491, DOI 10.1016/j.envpol.2018.10.014, lire en ligne, consulté le ).
- ↑ (en) Nuo Li, Yuchen Zhou, Juan Liu et Daniel C.W. Tsang, « Persistent thallium contamination in river sediments, source apportionment and environmental implications », Ecotoxicology and Environmental Safety, vol. 202, , p. 110874 (DOI 10.1016/j.ecoenv.2020.110874, lire en ligne, consulté le ).
- ↑ Lucie Laforte, « Thallium et indium dans les sédiments de deux lacs du bouclier canadien: sources, géochimie et potentiel comme traceurs. », (consulté le ).
- ↑ Łukaszewski Z, Zembrzuski W & Piela A (1996). Direct determination of ultratraces of thallium in water by flow-injection-differential-pulse anodic stripping voltammetry. Analytica Chimica Acta, 318, 159–165.
- ↑ (en) Jozef Lis, Anna Pasieczna, Bozena Karbowska et Wlodzimierz Zembrzuski, « Thallium in Soils and Stream Sediments of a Zn−Pb Mining and Smelting Area », Environmental Science & Technology, vol. 37, no 20, , p. 4569–4572 (ISSN 0013-936X et 1520-5851, DOI 10.1021/es0346936, lire en ligne, consulté le ).
- 1 2 3 4 5 (en) M. Małuszyński, « Thallium in environment », Ochrona Środowiska i Zasobów Naturalnych, no 40, , p. 31–38.
- ↑ (en) Trajče Stafilov et Katarina Čundeva, « Determination of total thallium in fresh water by electrothermal atomic absorption spectrometry after colloid precipitate flotation », Talanta, vol. 46, no 6, , p. 1321–1328 (ISSN 0039-9140, DOI 10.1016/s0039-9140(97)00420-7, lire en ligne, consulté le ).
- ↑ (pl) A. Paulo, J. Lis et A. Pasieczna, « Tal pod koniec XX wieku », Przegląd Geologiczny, Varsovie, no 5, , p. 403–407.
- ↑ (en) V. Cheam, G. Garbai, J. Lechner et J. Rajkumar, « Local impacts of coal mines and power plants across Canada. I. Thallium in waters and sediments », Water Quality Research Journal, vol. 35, no 4, , p. 581–608 (ISSN 1201-3080 et 2408-9443, DOI 10.2166/wqrj.2000.034, lire en ligne, consulté le ).
- ↑ (en) Ulrika Karlsson, Environmental levels of thallium : influence of redox properties and anthropogenic sources (thèse), Örebro, Örebro universitetsbibliotek, coll. « Örebro studies in chemistry » (no 5), , 44 p. (ISBN 91-7668-474-1, ISSN 1651-4270, OCLC 185276729, S2CID 91840130, présentation en ligne, lire en ligne [PDF]).
- ↑ (en) A. Manecki, M. Schejbal Chwastek et J. Tarkowski, « Mineralogical and chemical characteristics of dust air pollutants from areas affected by short- and long-range industrial emissions », Prace Mineralogiczne, Kraków, no 78, .
- ↑ (pl) M. Schejbal-Chwastek et J Tarkowski, « Mineralogia przemysłowych pyłów atmosferycznych i ich wpływ na zmiany geochemii środowiska w Parkach Narodowych Południowej Polski », Prace Mineralogiczne, Kraków, no 80, .
- ↑ (en) U. Tomza, « Trace element patterns in atmospheric aerosols at Katowice », Prace Naukowe, Uniwersytet Śląski, no 924, , p. 120.
- ↑ (en) « chemicalsampling/data », sur le site de l'Occupational Safety and Health Administration [OSHA], .
- ↑ (en) Michel Legrand, Joseph R. McConnell, Susanne Preunkert et Gilles Bergametti, « Thallium Pollution in Europe Over the Twentieth Century Recorded in Alpine Ice: Contributions From Coal Burning and Cement Production », Geophysical Research Letters, vol. 49, no 13, (ISSN 0094-8276 et 1944-8007, DOI 10.1029/2022GL098688, lire en ligne, consulté le ).
- ↑ (en) « The roof of the Alps yields clues to a toxic-pollutant puzzle », Nature, , d41586–022–01944-0 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-022-01944-0, lire en ligne, consulté le ).
- 1 2 Główny Urząd Statystyczny (Statistiques Polonaises) (2019) Zużycie paliw i nośników energii w 2018 r. (Consumption of fuels and energy carriers in 2018)
- ↑ (en) « Chemicals production and consumption statistics », sur ec.europa.eu (consulté le ).
- ↑ (en) R.S. Pappas, G.M. Polzin, L. Zhang et C.H. Watson, « Cadmium, lead, and thallium in mainstream tobacco smoke particulate », Food and Chemical Toxicology, vol. 44, no 5, , p. 714–723 (DOI 10.1016/j.fct.2005.10.004, lire en ligne, consulté le ).
- ↑ (en) A. Tremel, P. Masson, T. Sterckeman et D. Baize, « Thallium in French agrosystems—I. Thallium contents in arable soils », Environmental Pollution, vol. 95, no 3, , p. 293–302 (ISSN 0269-7491, DOI 10.1016/s0269-7491(96)00145-5, lire en ligne, consulté le ).
- ↑ Jović V (1993) Thallium in rocks, soils and plants. past progress and future needs. Neues Jahrbuch für Mineralogie. Abhandlungen, 166(1), 43-52.
- 1 2 3 4 (en) Shelby T. Rader, Richard M. Gaschnig, Sean M. Newby et Gray E. Bebout, « Thallium behavior during high-pressure metamorphism in the Western Alps, Europe », Chemical Geology, vol. 579, , p. 120349 (ISSN 0009-2541, DOI 10.1016/j.chemgeo.2021.120349, lire en ligne, consulté le ).
- ↑ (en) D. L. Leach et J.G. Viets, « Comparison of the Cracow-Silesian mississippi valley-type district, southern Poland, with mississippi valley-type districts in North America », Open-File Report, (ISSN 2331-1258, DOI 10.3133/ofr92704, lire en ligne, consulté le ).
- ↑ (en) Catherine Williams-Beam et Larry G. Twidwell, « Removal of Thallium from Wastewater », dans Electrometallurgy and Environmental Hydrometallurgy, vol. 2, John Wiley & Sons, Inc., , 1717–1727 p. (ISBN 9781118820605, lire en ligne).
- ↑ (en) Yongliang Xiong, « Hydrothermal thallium mineralization up to 300 °C: A thermodynamic approach », Ore Geology Reviews, vol. 32, nos 1-2, , p. 291–313 (DOI 10.1016/j.oregeorev.2006.10.003, lire en ligne, consulté le ).
- ↑ (en) Taofa Zhou, Yu Fan, Feng Yuan et David Cooke, « A preliminary investigation and evaluation of the thallium environmental impacts of the unmined Xiangquan thallium-only deposit in Hexian, China », Environmental Geology, vol. 54, no 1, , p. 131–145 (ISSN 0943-0105 et 1432-0495, DOI 10.1007/s00254-007-0800-0, lire en ligne, consulté le ).
- ↑ Murciego AM, Ayuso EA, Sa ́nchez AG. Pascual EP (2010) The occurrence of Cd and Tl in the sphalerite from El Losar del Barco Mine (A ́vila, Spain): a potential environmental hazard. Revista de la SEM 13:163–164
- ↑ (en) L. George, N. J. Cook, C. L. Ciobanu et B. P. Wade, « Trace and minor elements in galena: A reconnaissance LA-ICP-MS study », American Mineralogist, vol. 100, nos 2-3, , p. 548–569 (ISSN 0003-004X, DOI 10.2138/am-2015-4862, lire en ligne, consulté le ).
- ↑ Tableau n°1, page 11 : Tl concentrations in selected sediments and soils in (en) Zdzisław M. Migaszewski et Agnieszka Gałuszka, « Abundance and fate of thallium and its stable isotopes in the environment », Reviews in Environmental Science and Bio/Technology, vol. 20, no 1, , p. 5–30 (ISSN 1569-1705 et 1572-9826, DOI 10.1007/s11157-020-09564-8, lire en ligne, consulté le ).
- 1 2 (en) Juan Liu, Xuwen Luo, Yuqing Sun et Daniel C.W. Tsang, « Thallium pollution in China and removal technologies for waters: A review », Environment International, vol. 126, , p. 771–790 (DOI 10.1016/j.envint.2019.01.076, lire en ligne, consulté le ).
- ↑ (en) D. H. M. Alderton, T. Serafimovski, B. Mullen et K. Fairall, « The Chemistry of Waters Associated with Metal Mining in Macedonia », Mine Water and the Environment, vol. 24, no 3, , p. 139–149 (ISSN 1025-9112 et 1616-1068, DOI 10.1007/s10230-005-0085-z, lire en ligne, consulté le ).
- ↑ Boev B, Bermanec V, Serafimovski T, Lepitkova S, Mikulcic S, Soufek M, Jovanovski G, Stafilov T, Najdoski M (2001–2002) Allchar mineral assemblage. Geol Maced 15/16:1–23 |URL=http://eprints.ugd.edu.mk/1399/
- ↑ (en) Jin-Ho Lee, Dong-Jin Kim et Byung-Koo Ahn, « Distributions and Concentrations of Thallium in Korean Soils Determined by Single and Sequential Extraction Procedures », Bulletin of Environmental Contamination and Toxicology, vol. 94, no 6, , p. 756–763 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/s00128-015-1533-5, lire en ligne, consulté le ).
- 1 2 (en) M. Wierzbicka, G. Szarek-Łukaszewska et K. Grodzińska, « Highly toxic thallium in plants from the vicinity of Olkusz (Poland) », Ecotoxicology and Environmental Safety, vol. 59, no 1, , p. 84–88 (ISSN 0147-6513, DOI 10.1016/j.ecoenv.2003.12.009, lire en ligne, consulté le ).
- ↑ Raimo Lahtinen, Hannu Huhma, Laura S. Lauri et Mohammad Sayab, Geochemical and U-Pb and Sm-Nd isotopic constraints on the evolution of the Paleoproterozoic Ylitornio nappe complex, northern Fennoscandia, vol. 91, (ISSN 0367-5211, DOI 10.17741/bgsf/91.1.003, lire en ligne), p. 75–100.
- ↑ (en) Fernando Garrido, Javier Garcia-Guinea, Paula Lopez-Arce et Andreas Voegelin, « Thallium and co-genetic trace elements in hydrothermal Fe-Mn deposits of Central Spain », Science of The Total Environment, vol. 717, , p. 137162 (DOI 10.1016/j.scitotenv.2020.137162, lire en ligne, consulté le ).
- ↑ (en) Encarna Merlo, Antonio J. Mendoza-Fernández, Esteban Salmerón-Sánchez et Fabián Martínez-Hernández, chap. 11 « Elementome of Endemic Dolomitic Flora: Pterocephalus spathulatus (Lag.) Coult », dans Land, vol. 10, (DOI 10.3390/land10111253, lire en ligne), p. 1253.
- ↑ (en) PubChem, « Lead;ZINC », sur pubchem.ncbi.nlm.nih.gov (consulté le ).
- 1 2 (en) Shixing Ren, Xudong Wei, Jin Wang et Juan Liu, « Unexpected enrichment of thallium and its geochemical behaviors in soils impacted by historically industrial activities using lead‑zinc carbonate minerals », Science of The Total Environment, vol. 821, , p. 153399 (DOI 10.1016/j.scitotenv.2022.153399, lire en ligne, consulté le ).
- ↑ (en) Juan Liu, Holger Lippold, Jin Wang et Johanna Lippmann-Pipke, « Sorption of thallium(I) onto geological materials: Influence of pH and humic matter », Chemosphere, vol. 82, no 6, , p. 866–871 (DOI 10.1016/j.chemosphere.2010.10.089, lire en ligne, consulté le ).
- ↑ (en) Katherine M. Coup et Peter J. Swedlund, « Demystifying the interfacial aquatic geochemistry of thallium(I): New and old data reveal just a regular cation », Chemical Geology, vol. 398, , p. 97–103 (ISSN 0009-2541, DOI 10.1016/j.chemgeo.2015.02.003, lire en ligne, consulté le ).
- 1 2 3 (en) Loïc A. Martin, Aubéry Wissocq, M. F. Benedetti et Christelle Latrille, « Thallium (Tl) sorption onto illite and smectite: Implications for Tl mobility in the environment », Geochimica et Cosmochimica Acta, vol. 230, , p. 1–16 (ISSN 0016-7037, DOI 10.1016/j.gca.2018.03.016, lire en ligne, consulté le ).
- ↑ (en) Steven M. Presley, Michael T. Abel, Galen P. Austin et Thomas R. Rainwater, « Metal concentrations in schoolyard soils from New Orleans, Louisiana before and after Hurricanes Katrina and Rita », Chemosphere, vol. 80, no 1, , p. 67–73 (DOI 10.1016/j.chemosphere.2010.03.031, lire en ligne, consulté le ).
- ↑ (en) Aleš Vaněk, Vladislav Chrastný, Martin Mihaljevič et Petr Drahota, « Lithogenic thallium behavior in soils with different land use », Journal of Geochemical Exploration, vol. 102, no 1, , p. 7–12 (ISSN 0375-6742, DOI 10.1016/j.gexplo.2008.10.004, lire en ligne, consulté le ).
- 1 2 3 (zh) Li Xiangping, Zhang Fei, Qi Jianying et Chen Yongheng, « Effects of organic matter on thallium adsorption-desorption in soils », Chinese Journal of Environmental Engineering, vol. 6, no 11, , p. 4245–4250 (ISSN 1673-9108, lire en ligne, consulté le ).
- 1 2 3 4 (en) Sven Moeschlin, « Thallium poisoning », Clinical Toxicology, vol. 17, no 1, , p. 133–146 (ISSN 0009-9309, DOI 10.3109/15563658008985073, lire en ligne, consulté le ).
- ↑ Herfs, A., Nachr. Landew. Abt., Farbenfabriken vorm. Bayer and Company, 3: 29 (1924)
- ↑ Kellogg E.S (1931) The California Ground Squirrel Control Program. Special Publication 109: Department of Agriculture, State of California, 1931
- ↑ (en) William Mahoney, « Retrobulbar Neuritis due to thallium poisoning from depilatory cream : report of three cases », Journal of the American Medical Association, vol. 98, no 8, , p. 618–620 (ISSN 0002-9955, DOI 10.1001/jama.1932.02730340026006, lire en ligne, consulté le ).
- ↑ (en) Jean M. Linsdale, « Facts concerning the Use of Thallium in California to Poison Rodents : Its Destructiveness to Game Birds, Song Birds and Other Valuable Wild Life », The Condor, vol. 33, no 3, , p. 92–106 (ISSN 0010-5422, DOI 10.2307/1363574, lire en ligne, consulté le ).
- ↑ (en) James C. Munch, « The 1932 Thallotoxicoseis outbreak in California », JAMA: The Journal of the American Medical Association, vol. 100, no 17, , p. 1315 (ISSN 0098-7484, DOI 10.1001/jama.1933.02740170013003, lire en ligne, consulté le ).
- 1 2 (en) James C. Munch, « Human thallotoxicosis », JAMA: The Journal of the American Medical Association, vol. 102, no 23, , p. 1929 (ISSN 0098-7484, DOI 10.1001/jama.1934.02750230023007, lire en ligne, consulté le ).
- ↑ (en) Robert E. Swain et W.G. Bateman, « The Toxicity of Thallium Salts », Journal of Biological Chemistry, vol. 7, no 2, , p. 137–151 (ISSN 0021-9258, DOI 10.1016/s0021-9258(18)91580-2, lire en ligne, consulté le ).
- ↑ En 1929, A. Buschke a recommandé que le médicament et l'enfant soient pesés par deux médecins et que la procédure soit supervisée par un troisième pour éviter toute erreur de dosage ; source : voir page 13 in Heyroth F.F (1947) Thallium. A Review and Summary of Medical Literature. Thallium. A Review and Summary of Medical Literature |URL=https://collections.nlm.nih.gov/ext/dw/101530497/PDF/101530497.pdf
- ↑ (en) Danuta Smołka-Danielowska, « Trace elements and mineral composition of waste produced in the process of combustion of solid fuels in individual household furnaces in the Upper Silesian Industrial Region (Poland) », Environmental & Socio-economic Studies, vol. 3, no 4, , p. 30–38 (ISSN 2354-0079, DOI 10.1515/environ-2015-0071, lire en ligne, consulté le ).
- ↑ (en) Krzysztof Kleszcz, Iwona Karoń, Paweł Zagrodzki et Paweł Paśko, « Arsenic, cadmium, lead and thallium in coal ash from individual household furnaces », Journal of Material Cycles and Waste Management, vol. 23, no 5, , p. 1801–1809 (ISSN 1611-8227, DOI 10.1007/s10163-021-01251-2, lire en ligne, consulté le ).
- ↑ (en) Dipak K. Sarkar, « Pulverized Coal-Fired Boilers », dans Thermal Power Plant, Elsevier, (lire en ligne), p. 139–158.
- ↑ (en) « Summary for Policymakers », dans Climate Change 2013 – The Physical Science Basis, Cambridge University Press, (ISBN 978-1-107-05799-9, DOI 10.1017/cbo9781107415324.004, lire en ligne), p. 1–30.
- ↑ Anne Tremel et Michel Mench (2021) Le thallium dans les sols et les végétaux supérieurs. II. Le thallium dans les végétaux supérieurs |date =7 septembre 2021 | URL/résumé =https://hal.inrae.fr/hal-02692994
- ↑ Logan, P. G., Lepp, N. W., & Phipps, D. A. (1984). Potassium nutrition and thallium toxicity in higher plants. In 6. Colloque international pour l'optimisation de la nutrition des plantes. Montpellier (France). 2-8 Sep 1984
- 1 2 (en) William J. Meggs, Robert S. Hoffman, Richard D. Shih et Richard S. Weisman, « Thallium Poisoning from Maliciously Contaminated Food », Journal of Toxicology: Clinical Toxicology, vol. 32, no 6, , p. 723–730 (ISSN 0731-3810, DOI 10.3109/15563659409017979, lire en ligne, consulté le ).
- ↑ Fowler B.A (1983) Indium and thallium in health. In Trace Elem Heal. A Rev. Curr. Issues. Butterworth & Co London, UK. URL=https://books.google.fr/books?hl=fr&lr=&id=YnX-BAAAQBAJ&oi=fnd&pg=PA74&dq=Thallium+chemical+properties&ots=OlYA5HMJEe&sig=46BCexpbB-UQtxfNnBXtsFuLpgA&redir_esc=y#v=onepage&q=Thallium%20chemical%20properties&f=false (voir p 78)
- 1 2 3 4 (en) Tong-Wen Sun, Qing-Yan Xu, Xiao-Juan Zhang et Qiong Wu, « Management of thallium poisoning in patients with delayed hospital admission », Clinical Toxicology, vol. 50, no 1, , p. 65–69 (ISSN 1556-3650 et 1556-9519, DOI 10.3109/15563650.2011.638926, lire en ligne, consulté le ).
- ↑ (en) Qian-Qian Zhang, Jin-Hui Li, Yi-Ding Wang et Xiao-Na Li, « Association between maternal thallium exposure and risk of gestational diabetes mellitus: Evidence from a birth cohort study », Chemosphere, vol. 270, , p. 128637 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2020.128637, lire en ligne, consulté le ).
- ↑ (en) Mayada R. Farag, Youssef A. Attia, Lafi S. Al Solami et Fulvia Bovera, « Behavioral, physiological, and inflammatory responses of Oreochromis niloticus fish exposed to thallium and/or supplementation with Astragalus membranaceus polysaccharides », Aquaculture, vol. 553, , p. 738100 (DOI 10.1016/j.aquaculture.2022.738100, lire en ligne, consulté le ).
- 1 2 3 4 (en) Weixia Duan, Yongyi Wang, Zhiqiang Li et Guanyan Fu, « Thallium exposure at low concentration leads to early damage on multiple organs in children: A case study followed-up for four years », Environmental Pollution, vol. 258, , p. 113319 (ISSN 0269-7491, DOI 10.1016/j.envpol.2019.113319, lire en ligne, consulté le ).
- 1 2 3 4 5 (en) Juan Tong, Chun-Mei Liang, Kung Huang et Hai-Yun Xiang, « Prenatal serum thallium exposure and 36-month-old children’s attention-deficit/hyperactivity disorder symptoms: Ma’anshan birth cohort study », Chemosphere, vol. 244, , p. 125499 (DOI 10.1016/j.chemosphere.2019.125499, lire en ligne, consulté le ).
- 1 2 (en) Juan Tong, Chunmei Liang, Xiaoyan Wu et Kung Huang, « Prenatal serum thallium exposure and cognitive development among preschool-aged children : A prospective cohort study in China », Environmental Pollution, vol. 293, , p. 118545 (DOI 10.1016/j.envpol.2021.118545, lire en ligne, consulté le ).
- ↑ (en) M.N. Hughes, W.K. Man et B.C. Whaler, « The toxicity of thallium(I) to cardiac and skeletal muscle », Chemico-Biological Interactions, vol. 23, no 1, , p. 85–97 (DOI 10.1016/0009-2797(78)90043-1, lire en ligne, consulté le ).
- 1 2 (en) T.-S. Lin, J. Nriagu et X.-Q. Wang, « Thallium Concentration in Lake Trout from Lake Michigan », Bulletin of Environmental Contamination and Toxicology, vol. 67, no 6, , p. 921–925 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/s001280209, lire en ligne, consulté le ).
- ↑ Fowler B.A (1983) Indium and thallium in health. In Trace Elem Heal. A Rev. Curr. Issues. Butterworth & Co London, UK. (voir p 78)
- ↑ (en) Guillermo Repetto et Ana del Peso, « Gallium, Indium, and Thallium », Patty's Toxicology, John Wiley & Sons, Inc., (lire en ligne, consulté le ).
- ↑ (en) Yeisy C. López, Greter A. Ortega et Edilso Reguera, « Hazardous ions decontamination: From the element to the material », Chemical Engineering Journal Advances, vol. 11, , p. 100297 (DOI 10.1016/j.ceja.2022.100297, lire en ligne, consulté le ).
- ↑ (en) M. Méndez-Armenta, C. Nava-Ruiz, F. Fernández-Valverde et A. Sánchez-García, « Histochemical changes in muscle of rats exposed subchronically to low doses of heavy metals », Environmental Toxicology and Pharmacology, vol. 32, no 1, , p. 107–112 (ISSN 1382-6689, DOI 10.1016/j.etap.2011.03.001, lire en ligne, consulté le ).
- ↑ (en) Dong Li, Huan Yao, Lei Du et Xianyin Zeng, « Thallium(I and III) exposure leads to liver damage and disorders of fatty acid metabolism in mice », Chemosphere, vol. 307, , p. 135618 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2022.135618, lire en ligne, consulté le ).
- ↑ (en) Sibo Wang, Jiateng Sun, Chunping Tang et Lingfeng Gu, « Association between urinary thallium exposure and cardiovascular disease in U.S. adult population », Chemosphere, vol. 294, , p. 133669 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2022.133669, lire en ligne, consulté le ).
- ↑ (en) Marcela S Villaverde et Sandra V Verstraeten, « Effects of thallium(I) and thallium(III) on liposome membrane physical properties », Archives of Biochemistry and Biophysics, vol. 417, no 2, , p. 235–243 (DOI 10.1016/S0003-9861(03)00366-7, lire en ligne, consulté le ).
- 1 2 (en) Zuzana Grösslová, Aleš Vaněk, Martin Mihaljevič et Vojtěch Ettler, « Bioaccumulation of thallium in a neutral soil as affected by solid-phase association », Journal of Geochemical Exploration, vol. 159, , p. 208–212 (ISSN 0375-6742, DOI 10.1016/j.gexplo.2015.09.009, lire en ligne, consulté le ).
- ↑ (en) Manfred Sager, « Thallium in Agricultural Practice », dans Jerome O. Nriagu, Thallium in the environment, New York, John Wiley & Sons, (ISBN 0-471-17755-5), p. 59-87.
- ↑ (en) Desmond I. Bannon, « Wildlife Toxicity Assessment for Thallium », dans Wildlife Toxicity Assessments for Chemicals of Military Concern, Elsevier, (ISBN 978-0-12-800020-5, DOI 10.1016/b978-0-12-800020-5.00020-x, lire en ligne), p. 349–363.
- ↑ (en) Emilia Bramanti, Massimo Onor et Laura Colombaioni, « Neurotoxicity Induced by Low Thallium Doses in Living Hippocampal Neurons: Evidence of Early Onset Mitochondrial Dysfunction and Correlation with Ethanol Production », ACS Chemical Neuroscience, vol. 10, no 1, , p. 451–459 (ISSN 1948-7193 et 1948-7193, DOI 10.1021/acschemneuro.8b00343, lire en ligne, consulté le ).
- ↑ (en) V. Zitko, W. V. Carson et W. G. Carson, « Thallium: Occurrence in the environment and toxicity to fish », Bulletin of Environmental Contamination and Toxicology, vol. 13, no 1, , p. 23–30 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/bf01684859, lire en ligne, consulté le ).
- ↑ (en) Juan Liu, Xudong Wei, Shixing Ren et Jianying Qi, « Synergetic removal of thallium and antimony from wastewater with jacobsite-biochar-persulfate system », Environmental Pollution, vol. 304, , p. 119196 (ISSN 0269-7491, DOI 10.1016/j.envpol.2022.119196, lire en ligne, consulté le ).
- ↑ (en) Bozena Karbowska, « Presence of thallium in the environment: sources of contaminations, distribution and monitoring methods », Environmental Monitoring and Assessment, vol. 188, no 11, , p. 640 (ISSN 1573-2959, PMID 27783348, PMCID PMC5080298, DOI 10.1007/s10661-016-5647-y, lire en ligne, consulté le ) ; remarque : ces seuils sont susceptibles de varier au gré des nouvelles données écotoxicologiques et réglementaires
- ↑ (en) « Regulation development for drinking water contaminants » (Recherche sur site), sur search.epa.gov (consulté le ).
- ↑ E. Sabbioni et L. Goetz, « Health and environmental implications of trace metals released from coal-fired power plants: an assessment study of the situation in the European Community », sur Science of The Total Environment, (ISSN 0048-9697, DOI 10.1016/0048-9697(84)90348-6, consulté le ), p. 141–154.
- ↑ http://risk.lsd.ornl.gov/tox/profiles
- ↑ (en) Domenico Di Candia, Lucie Biehler-Gomez, Gaia Giordano et Cristina Cattaneo, « A case of thallium intoxication by walking in a field », Forensic Science International: Reports, vol. 2, , p. 100102 (ISSN 2665-9107, DOI 10.1016/j.fsir.2020.100102, lire en ligne, consulté le ).
- ↑ Popenoe CH (1926), "Thallium as an Insecticide", Science, 64, 525.
- ↑ Popenoe, C. H.: Am. J. Pharm., 98: 693 (1926) cité page 2 in Heyroth F.F (1947) Thallium. A Review and Summary of Medical Literature. Thallium. A Review and Summary of Medical Literature |URL=https://collections.nlm.nih.gov/ext/dw/101530497/PDF/101530497.pdf ; résumé : https://www.cabdirect.org/cabdirect/abstract/19482701017
- ↑ (en) George Kazantzis, « Thallium in the Environment and Health Effects », Environmental Geochemistry and Health, vol. 22, no 4, , p. 275–280 (ISSN 0269-4042, DOI 10.1023/a:1006791514080, lire en ligne, consulté le ).
- ↑ (en) Wei Xia, Xiaofu Du, Tongzhang Zheng et Bin Zhang, « A Case–Control Study of Prenatal Thallium Exposure and Low Birth Weight in China », Environmental Health Perspectives, vol. 124, no 1, , p. 164–169 (ISSN 0091-6765 et 1552-9924, DOI 10.1289/ehp.1409202, lire en ligne, consulté le ).
- ↑ (en) Christopher Thompson, J. Dent et P. Saxby, « Effects of Thallium Poisoning on Intellectual Function », British Journal of Psychiatry, vol. 153, no 3, , p. 396–399 (ISSN 0007-1250 et 1472-1465, DOI 10.1192/bjp.153.3.396, lire en ligne, consulté le ).
- ↑ (en) Christopher Thompson, J. Dent et P. Saxby, « Effects of Thallium Poisoning on Intellectual Function », British Journal of Psychiatry, vol. 153, no 3, , p. 396–399 (ISSN 0007-1250 et 1472-1465, DOI 10.1192/bjp.153.3.396, lire en ligne, consulté le ).
- ↑ Osmanagaoglu, K., Kuyvenhoven, J., Dierckx, R. A., Hamers, J., Cuvelier, C., Uyttendaele, D., & Simons, M. (1995). Thallium-201 accumulation in myositis ossificans and in juxta-articular ossification. Journal of Nuclear Medicine, 36(12), 2239-2242.; URL=https://jnm.snmjournals.org/content/jnumed/36/12/2239.full.pdf
- ↑ (en) Xiaochen Ma, Wuye Pan, Zheying Zhu et Xiaoqing Ye, « A case-control study of thallium exposure with the risk of premature ovarian insufficiency in women », Archives of Environmental & Occupational Health, vol. 77, no 6, , p. 468–477 (ISSN 1933-8244 et 2154-4700, DOI 10.1080/19338244.2021.1931797, lire en ligne, consulté le ).
- ↑ (en) L. Formigli et R. Scelsi, « Thallium-induced testicular toxicity in the rat », sur Environmental Research, (ISSN 0013-9351, DOI 10.1016/S0013-9351(86)80128-1, consulté le ), p. 531–539.
- ↑ Sabbioni, E., Gottiardi, L., & Manz, L. (1986). Thallium-Induced Testicular Toxicity in the Rat.
- ↑ (de) A. Büschke et Bruno Peiser, « Die Wirkung des Thallium Auf das Endokrine System », Klinische Wochenschrift, vol. 1, no 20, , p. 995–995 (ISSN 0023-2173 et 1432-1440, DOI 10.1007/bf01712489, lire en ligne, consulté le ).
- ↑ (en) Brian K. Hall, « Thallium-induced achondroplasia in the embryonic chick », Developmental Biology, vol. 28, no 1, , p. 47–60 (ISSN 0012-1606, DOI 10.1016/0012-1606(72)90125-X, lire en ligne, consulté le ).
- 1 2 (en) A Léonard et G.B Gerber, « Mutagenicity, carcinogenicity and teratogenicity of thallium compounds », Mutation Research/Reviews in Mutation Research, vol. 387, no 1, , p. 47–53 (DOI 10.1016/S1383-5742(97)00022-7, lire en ligne, consulté le ).
- 1 2 (en) Juan José Rodríguez-Mercado et Mario Agustín Altamirano-Lozano, « Genetic toxicology of thallium: a review », Drug and Chemical Toxicology, vol. 36, no 3, , p. 369–383 (ISSN 0148-0545 et 1525-6014, DOI 10.3109/01480545.2012.710633, lire en ligne, consulté le ).
- ↑ (en) Madeleine Bachand, Ana Maria Seifert et Karen Messing, « Nuclear medicine patients do not have higher mutant frequencies after exposure to thallium-201 », Mutation Research Letters, vol. 262, no 1, , p. 1–6 (ISSN 0165-7992, DOI 10.1016/0165-7992(91)90097-N, lire en ligne, consulté le ).
- 1 2 3 (en) Juan José Rodríguez-Mercado, Gabriela Mosqueda-Tapia et Mario Agustín Altamirano-Lozano, « Genotoxicity assessment of human peripheral Lymphocytes induced by thallium(I) and thallium(III) », Toxicological & Environmental Chemistry, vol. 99, nos 5-6, , p. 987–998 (ISSN 0277-2248 et 1029-0486, DOI 10.1080/02772248.2017.1307377, lire en ligne, consulté le ).
- 1 2 (en) María de los Ángeles Reyes-Rodríguez, Luis Felipe Santos-Cruz, Carlos García-Castro et Ángel Durán-Díaz, « Genotoxicity and cytotoxicity evaluation of two thallium compounds using the Drosophila wing somatic mutation and recombination test », Heliyon, vol. 7, no 5, , e07087 (PMID 34136682, PMCID PMC8176319, DOI 10.1016/j.heliyon.2021.e07087, lire en ligne, consulté le ).
- 1 2 3 (en) J.M. Wallace, (2015). Kale and thallium : insights from your nutrition team. Permaculture solutions for healing.
- 1 2 (en) « Chapter 15. Gallium, Indium and Thallium », dans Issues in Toxicology, Royal Society of Chemistry, , 316–330 p. (lire en ligne), p. 316–330.
- 1 2 (en) Emma Engström, Anna Stenberg, Svetlana Senioukh et Roland Edelbro, « Multi-elemental characterization of soft biological tissues by inductively coupled plasma–sector field mass spectrometry », Analytica Chimica Acta, vol. 521, no 2, , p. 123–135 (ISSN 0003-2670, DOI 10.1016/j.aca.2004.06.030, lire en ligne, consulté le ).
- ↑ (en) Arabinda K. Das, Ruma Chakraborty, M. Luisa Cervera et Miguel de la Guardia, chap. 4 « Determination of thallium in biological samples », dans Analytical and Bioanalytical Chemistry, vol. 385, (DOI 10.1007/s00216-006-0411-8, lire en ligne), p. 665–670.
- 1 2 (en) E. Sabbioni, C. Minoia, A. Ronchi et B.G. Hansen, « Trace element reference values in tissues from inhabitants of the European Union. VIII. Thallium in the Italian population », Science of The Total Environment, vol. 158, , p. 227–236 (ISSN 0048-9697, DOI 10.1016/0048-9697(94)90059-0, lire en ligne, consulté le ).
- 1 2 3 4 5 (en) Mario Ćurković, Laszlo Sipos, Dinko Puntarić et Katarina Dodig-Ćurković, « Detection of Thallium and Uranium in Well Water and Biological Specimens of an Eastern Croatian Population », Arhiv za higijenu rada i toksikologiju, vol. 64, no 3, , p. 385–393 (ISSN 0004-1254 et 1848-6312, DOI 10.2478/10004-1254-64-2013-2300, lire en ligne, consulté le ).
- ↑ (en) Tangfu Xiao, Fei Yang, Shehong Li et Baoshan Zheng, « Thallium pollution in China: A geo-environmental perspective », Science of The Total Environment, vol. 421-422, no 17, , p. 51–58 (ISSN 1873-2968, PMID 10, DOI 10.1016/j.scitotenv.2011.04.008, lire en ligne, consulté le ).
- 1 2 Ferguson TJ. Thallium. In: Olson KR, Anderson IB, Benowitz NL, Blanc PD, Clark RF, Kearny TE, Osterloh J, editors. Poisoning and Drug Overdose. 4th ed. Singapore: The McGraw–Hill Companies; 2004. p. 352-4.
- ↑ McMillan TM, Jacobson RR, Gross M (1997) Neuropsychology of thallium poisoning. J Neurol Neurosurg Psychiatry ;63:247-50.
- ↑ (en) U. Emers, « Environmental exposure to thallium », Science of The Total Environment, vol. 71, no 3, , p. 285–292 (DOI 10.1016/0048-9697(88)90199-4, lire en ligne, consulté le ).
- ↑ (en) Amir Ghaderi, Naser Vahdati-Mashhadian, Zohreh Oghabian et Valiallah Moradi, « Thallium exists in opioid poisoned patients », DARU Journal of Pharmaceutical Sciences, vol. 23, no 1, (ISSN 2008-2231, DOI 10.1186/s40199-015-0121-x, lire en ligne, consulté le ).
- ↑ Bonani and Marino: Arch, di farmacol. sper., 3; 97 (1906).
- ↑ Jones, Bence: J. de pharm. et chim., 10: 261 (1869).
- ↑ Blake, J.: Compt. rend. Soc. de biol. (9) 2: 55 (1890), cité par (en) Nelson Belzile et Yu-Wei Chen, « Thallium in the environment : A critical review focused on natural waters, soils, sediments and airborne particles », Applied Geochemistry, vol. 84, , p. 218–243 (DOI 10.1016/j.apgeochem.2017.06.013, lire en ligne, consulté le ).
- ↑ (en) J.P Quisefit, J.P Toutain, G Bergametti et M Javoy, « Evolution versus cooling of gaseous volcanic emissions from Momotombo Volcano, Nicaragua: Thermochemical model and observations », Geochimica et Cosmochimica Acta, vol. 53, no 10, , p. 2591–2608 (DOI 10.1016/0016-7037(89)90131-2, lire en ligne, consulté le ).
- ↑ (en) Simon Aldridge, The Chemistry of the Group 13 Metals in the +3 Oxidation State: Simple Inorganic Compounds, Wiley, (ISBN 978-0-470-68191-6 et 978-0-470-97654-8, DOI 10.1002/9780470976548.ch2, lire en ligne), p. 75–147.
- ↑ (en) Ionel Haiduc et Jerry J. Zuckerman, Basic Organometallic Chemistry, (DOI 10.1515/9783110847888, lire en ligne).
- ↑ D. Baize et J. Chrétien (1994) Les couvertures pédologiques de la plate-forme sinémurienne en Bourgogne. Particularités morphologiques et pédo-géochimiques, Étude et Gestion des Sols, 1, 2, 7-27 |URL pdf== http://www.afes.fr/wp-content/uploads/2017/10/EGS_1_2_BAIZE.pdf
- 1 2 3 4 5 (en) Philipp Böning, Bernhard Schnetger, Melanie Beck et Hans-Jürgen Brumsack, « Thallium dynamics in the southern North Sea », Geochimica et Cosmochimica Acta, vol. 227, , p. 143–155 (DOI 10.1016/j.gca.2018.02.024, lire en ligne, consulté le ).
- ↑ (en) Ulrika Karlsson, Stefan Karlsson et Anders Düker, « The effect of light and iron(ii)/iron(iii) on the distribution of Tl(i)/Tl(iii) in fresh water systems », J. Environ. Monit., vol. 8, no 6, , p. 634–640 (ISSN 1464-0325 et 1464-0333, DOI 10.1039/B516445A, lire en ligne, consulté le ).
- 1 2 3 (en) Corinna Mori, Melanie Beck, Nils H. Hintz et Julian Merder, « Biogeochemical thallium cycling during a mesocosm phytoplankton spring bloom: Biotic versus abiotic drivers », Geochimica et Cosmochimica Acta, vol. 313, , p. 257–276 (ISSN 0016-7037, DOI 10.1016/j.gca.2021.08.002, lire en ligne, consulté le ).
- ↑ (en) Corinna Mori, Melanie Beck, Maren Striebel et Julian Merder, « Biogeochemical cycling of molybdenum and thallium during a phytoplankton summer bloom: A mesocosm study », Marine Chemistry, vol. 229, , p. 103910 (ISSN 0304-4203, DOI 10.1016/j.marchem.2020.103910, lire en ligne, consulté le ).
- 1 2 3 4 5 6 7 (en) Janis Ahrens, Melanie Beck, Philipp Böning et Julius Degenhardt, « Thallium cycling in pore waters of intertidal beach sediments », Geochimica et Cosmochimica Acta, vol. 306, , p. 321–339 (ISSN 0016-7037, DOI 10.1016/j.gca.2021.04.009, lire en ligne, consulté le ).
- ↑ (en) Wanpeng Chen, Jiaming Xiong, Juchao Liu et Hainan Wang, « Thermodynamic and kinetic coupling modeling for thallium(I) sorption at a heterogeneous titanium dioxide interface », Journal of Hazardous Materials, vol. 428, , p. 128230 (DOI 10.1016/j.jhazmat.2022.128230, lire en ligne, consulté le ).
- 1 2 3 (en) Sin Law et Andrew Turner, « Thallium in the hydrosphere of south west England », Environmental Pollution, vol. 159, no 12, , p. 3484–3489 (ISSN 0269-7491, DOI 10.1016/j.envpol.2011.08.029, lire en ligne, consulté le ).
- 1 2 (en) Zenon Lukaszewski, Monika Jakubowska, Wlodzimierz Zembrzuski et Bozena Karbowska, « Flow-Injection Differential-Pulse Anodic Stripping Voltammetry as a Tool for Thallium Monitoring in the Environment », Electroanalysis, vol. 22, nos 17-18, , p. 1963–1966 (ISSN 1040-0397, DOI 10.1002/elan.201000151, lire en ligne, consulté le ).
- 1 2 3 (en) Tomasz Wojtkowiak, Bozena Karbowska, Wlodzimierz Zembrzuski et Marcin Siepak, « Miocene colored waters: A new significant source of thallium in the environment », Journal of Geochemical Exploration, vol. 161, , p. 42–48 (DOI 10.1016/j.gexplo.2015.09.014, lire en ligne, consulté le ).
- ↑ (en) Juan Liu, Qi’en Ouyang, Lulu Wang et Jin Wang, « Quantification of smelter-derived contributions to thallium contamination in river sediments: Novel insights from thallium isotope evidence », Journal of Hazardous Materials, vol. 424, , p. 127594 (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2021.127594, lire en ligne, consulté le ).
- ↑ (en) Chunxia Yang, Yongheng Chen, Ping'an Peng et Chao Li, « Distribution of natural and anthropogenic thallium in the soils in an industrial pyrite slag disposing area », Science of The Total Environment, vol. 341, nos 1-3, , p. 159–172 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2004.09.024, lire en ligne, consulté le ).
- 1 2 (en) Jingye She, Juan Liu, Hongping He et Qiong Zhang, « Microbial response and adaption to thallium contamination in soil profiles », Journal of Hazardous Materials, vol. 423, , p. 127080 (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2021.127080, lire en ligne, consulté le ).
- 1 2 3 4 (en) K. H. M. Kwan et S. Smith, « Some aspects of the kinetics of cadmium and thallium uptake by fronds of Lemna minor L. », New Phytologist, vol. 117, no 1, , p. 91–102 (ISSN 0028-646X et 1469-8137, DOI 10.1111/j.1469-8137.1991.tb00948.x, lire en ligne, consulté le ).
- ↑ (en) K.H.M. Kwan et S. Smith, « The effect of thallium on the growth of Lemna minor and plant tissue concentrations in relation to both exposure and toxicity », Environmental Pollution, vol. 52, no 3, , p. 203–219 (ISSN 0269-7491, DOI 10.1016/0269-7491(88)90004-8, lire en ligne, consulté le ).
- 1 2 (en) Christel S. Hassler, Ryan D. Chafin, Mary Beth Klinger et Michael R. Twiss, « Application of the biotic ligand model to explain potassium interaction with thallium uptake and toxicity to plankton », Environmental Toxicology and Chemistry, vol. 26, no 6, , p. 1139–1145 (ISSN 0730-7268 et 1552-8618, DOI 10.1897/06-315r.1, lire en ligne, consulté le ).
- ↑ (en) Beata Krasnodębska-Ostręga, Monika Asztemborska, Jerzy Golimowski et Katarzyna Strusińska, « Determination of thallium forms in plant extracts by anion exchange chromatography with inductively coupled plasma mass spectrometry detection (IC-ICP-MS) », Journal of Analytical Atomic Spectrometry, vol. 23, no 12, , p. 1632 (ISSN 0267-9477 et 1364-5544, DOI 10.1039/b804456b, lire en ligne, consulté le ).
- ↑ (en) Teruo Asami, Chizuru Mizui, Takeshi Shimada et Masatsugu Kubota, « Determination of thallium in soils by flame atomic absorption spectrometry », Fresenius Journal of Analytical Chemistry, vol. 356, no 5, , p. 348–351 (ISSN 0937-0633 et 1432-1130, DOI 10.1007/s0021663560348, lire en ligne, consulté le ).
- 1 2 3 Aleš Vaněk, Vladislav Chrastný, c, Leslaw Teper, Jerzy Cabala, Vít Penížek et Michael Komárek, Distribution of thallium and accompanying metals in tree rings of Scots pine (Pinus sylvestris L.) from a smelter-affected area ; Journal of Geochemical Exploration, volume 108, Issue 1, January 2011, Pages 73-80. DOI 10.1016/j.gexplo.2010.10.006, (en) (Abstract)
- ↑ MISA (1991) MISA (Municipal/Industrial Strategy for Abatement), preliminary report on the first six months of process effluent in the MISA pulp and paper sector (January 1, 1990, to June 30, 1990). Environment Ontario, Ontario, Canada.
- ↑ MISA (1991) MISA (Municipal/Industrial Strategy for Abatement), the preliminary report on the second six months of process effluent monitoring in the MISA pulp and paper sector (July 1, 1990, to December 31, 1990). Environment Ontario, Ontario, Canada.
- 1 2 MISA (1991) MISA (Municipal/Industrial Strategy for Abatement), status report on the effluent monitoring data for the iron and steel sector for the period from November 1, 1989, to October 31, 1990. Environment Ontario, Ontario, Canada.
- ↑ (en) V. Cheam, G. Garbai, J. Lechner et J. Rajkumar, « Local impacts of coal mines and power plants across Canada. I. Thallium in waters and sediments », Water Quality Research Journal, vol. 35, no 4, , p. 581–608 (ISSN 1201-3080 et 2408-9443, DOI 10.2166/wqrj.2000.034, lire en ligne, consulté le ).
- ↑ (en) T.-S. Lin, J. Nriagu et X.-Q. Wang, « Thallium Concentration in Lake Trout from Lake Michigan », Bulletin of Environmental Contamination and Toxicology, vol. 67, no 6, , p. 921–925 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/s001280209, lire en ligne, consulté le ).
- 1 2 (en) Jérôme Couture et Sandra Breux, « 4 Quebec City », dans Big City Elections in Canada, University of Toronto Press, , 79–100 p. (lire en ligne).
- 1 2 (en) Nikolaus Gantner, Michael Power, John A. Babaluk et James D. Reist, « Temporal trends of mercury, cesium, potassium, selenium, and thallium in Arctic char (Salvelinus alpinus) from Lake Hazen, Nunavut, Canada : Effects of trophic position, size, and age », Environmental Toxicology and Chemistry, vol. 28, no 2, , p. 254 (ISSN 0730-7268 et 1552-8618, DOI 10.1897/08-054.1, lire en ligne, consulté le ).
- ↑ (en) Jocelyn M. Kelly et David M. Janz, « Assessment of oxidative stress and histopathology in juvenile northern pike (Esox lucius) inhabiting lakes downstream of a uranium mill », Aquatic Toxicology, vol. 92, no 4, , p. 240–249 (ISSN 0166-445X, DOI 10.1016/j.aquatox.2009.02.007, lire en ligne, consulté le ).
- ↑ (en) F. Rappaport et F. Eichhorn, « A quick method for detection of thallium in urine in cases of poisoning », Clinica Chimica Acta, vol. 2, no 1, , p. 16–20 (ISSN 0009-8981, DOI 10.1016/0009-8981(57)90019-0, lire en ligne, consulté le ).
- 1 2 (en) V. Zitko, W. V. Carson et W. G. Carson, « Thallium: Occurrence in the environment and toxicity to fish », Bulletin of Environmental Contamination and Toxicology, vol. 13, no 1, , p. 23–30 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/bf01684859, lire en ligne, consulté le ).
- ↑ (en) J. Pickard, R. Yang, B. Duncan et C. A. McDevitt, « Acute and Sublethal Toxicity of Thallium to Aquatic Organisms », Bulletin of Environmental Contamination and Toxicology, vol. 66, no 1, , p. 94–101 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/s001280000210, lire en ligne, consulté le ).
- ↑ (en) Mariko Mochizuki, Makoto Mori, Mayumi Akinaga et Kyoko Yugami, « Thallium Contamination in Wild Ducks in Japan », Journal of Wildlife Diseases, vol. 41, no 3, , p. 664–668 (ISSN 0090-3558, DOI 10.7589/0090-3558-41.3.664, lire en ligne, consulté le ).
- ↑ Luck W (1891) Beiträge zur Wirkung des thalliums. 79p. Dorpat (inaug. Diss. )
- ↑ Shaw P.G (1932) Proc. Soc. Exper, Biol. & Med.; 30: 488.
- ↑ Hesse E ; Hefter-Heubner Handbuch. Pharmacol., Bd. 3, Pt. 3, 2181, 2184, 2186. cité par Heyroth F.F (1947) Thallium. A Review and Summary of Medical Literature. Thallium. A Review and Summary of Medical Literature |URL=https://collections.nlm.nih.gov/ext/dw/101530497/PDF/101530497.pdf ; résumé : https://www.cabdirect.org/cabdirect/abstract/19482701017 (voir p.16)
- ↑ (en) Arabinda K. Das, Ruma Chakraborty, M. Luisa Cervera et Miguel de la Guardia, « Determination of thallium in biological samples », Analytical and Bioanalytical Chemistry, vol. 385, no 4, , p. 665–670 (ISSN 1618-2642 et 1618-2650, DOI 10.1007/s00216-006-0411-8, lire en ligne, consulté le ).
- ↑ Alexandra Chatelet, Agnès Fournier, Stéfan Jurjanz et Sylvain Lerch, « L’épandage de matières fertilisantes d’origine résiduaire sur les prairies comporte-t-il des risques en termes de transfert de polluants organiques et inorganiques vers la chaîne alimentaire ? », INRA Productions Animales, vol. 28, no 5, , p. 383 (lire en ligne, consulté le ).
- ↑ Durkalec, M., Szkoda, J., Kolacz, R., Opalinski, S., Nawrocka, A., & Zmudzki, J. (2015). Bioaccumulation of lead, cadmium and mercury in roe deer and wild boars from areas with different levels of toxic metal pollution. International Journal of Environmental Research, 9(1), 205-212.
- ↑ (en) A. Tremel, P. Masson, T. Sterckeman et D. Baize, « Thallium in French agrosystems—I. Thallium contents in arable soils », Environmental Pollution, vol. 95, no 3, , p. 293–302 (ISSN 0269-7491, DOI 10.1016/S0269-7491(96)00145-5, lire en ligne, consulté le ).
- ↑ (en) A. Tremel, P. Masson, H. Garraud et O. F. X. Donard, « Thallium in French agrosystems—II. Concentration of thallium in field-grown rape and some other plant species », Environmental Pollution, vol. 97, no 1, , p. 161–168 (ISSN 0269-7491, DOI 10.1016/S0269-7491(97)00060-2, lire en ligne, consulté le ).
- ↑ (en) JAMES C. MUNCH, « THE 1932 Thallotoxicosis outbreak in California », JAMA: The Journal of the American Medical Association, vol. 100, no 17, , p. 1315 (ISSN 0098-7484, DOI 10.1001/jama.1933.02740170013003, lire en ligne, consulté le ).
- 1 2 (en) Dong Li, Huan Yao, Lei Du et Xianyin Zeng, « Thallium(I and III) exposure leads to liver damage and disorders of fatty acid metabolism in mice », Chemosphere, vol. 307, , p. 135618 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2022.135618, lire en ligne, consulté le ).
- ↑ (en) C. Baiocchi, D. Giacosa, G. Saini et P. Cavalli, « Determination of Thallium in Antarctic Snow by Means of Laser Induced Atomic Fluorescence and High Resolution Inductively Coupled Plasma Mass Spectrometry », International Journal of Environmental Analytical Chemistry, vol. 55, nos 1-4, , p. 211–218 (ISSN 0306-7319 et 1029-0397, DOI 10.1080/03067319408026219, lire en ligne, consulté le ).
- 1 2 3 (en) Ven Cheam, « Thallium Contamination of Water in Canada », Water Quality Research Journal, vol. 36, no 4, , p. 851–877 (ISSN 1201-3080 et 2408-9443, DOI 10.2166/wqrj.2001.046, lire en ligne, consulté le ).
- ↑ (en) Brian K. Hall, « Thallium-induced achondroplasia in the embryonic chick », Developmental Biology, vol. 28, no 1, , p. 47–60 (ISSN 0012-1606, DOI 10.1016/0012-1606(72)90125-X, lire en ligne, consulté le ).
- ↑ (en) Wei Xia, Xiaofu Du, Tongzhang Zheng et Bin Zhang, « A Case–Control Study of Prenatal Thallium Exposure and Low Birth Weight in China », Environmental Health Perspectives, vol. 124, no 1, , p. 164–169 (ISSN 0091-6765 et 1552-9924, PMID 26009470, PMCID PMC4710601, DOI 10.1289/ehp.1409202, lire en ligne, consulté le ).
- ↑ Cohorte suivie : Ma'anshan Birth Cohort Study (MABC)
- ↑ Histoire des services secrets français - l'heure des combats (1940 - 1960) (épisode 1), documentaire diffusé le 6 février 2011 sur France 5. Vers la fin du reportage (47 min 30 s) Raymond Muelle, alias lieutenant-colonel Jeanpierre, un ancien du Service Action du SDECE en témoigne.
- ↑ L'assassinat de Félix Moumié
- ↑ « russie - La piste du thallium radioactif est « improbable », selon des sources médicales Le mystère s’épaissit autour de l’empoisonnement de Litvinenko », sur L'Orient-Le Jour, (consulté le ).
- ↑ « Un ex-agent russe empoisonné? », sur lexpress.fr, (consulté le ).
- ↑ (zh) Juan Yuan, Yan Lai, Lei Huang et Fangkun Tang, « Clinical analysis on 2 cases of acute thallium poisoning with combined treatment using blood purification and sodium dimercaptosulfonate », China Occupational Medicine, , p. 347–354 (lire en ligne, consulté le ).
- 1 2 (en) Gözde Aydoğan Kılıç et Mehtap Kutlu, « Effects of exogenous metallothionein against thallium-induced oxidative stress in rat liver », Food and Chemical Toxicology, vol. 48, no 3, , p. 980–987 (DOI 10.1016/j.fct.2010.01.013, lire en ligne, consulté le ).
- ↑ (en) Laura Anaya-Ramos, Araceli Díaz-Ruíz, Camilo Ríos et Marisela Mendez-Armenta, « The acute systemic toxicity of thallium in rats produces oxidative stress: attenuation by metallothionein and Prussian blue », BioMetals, vol. 34, no 6, , p. 1295–1311 (ISSN 1572-8773, DOI 10.1007/s10534-021-00343-8, lire en ligne, consulté le ).
- ↑ Laura Anaya-Ramos, Araceli Díaz-Ruíz, Camilo Ríos et Sergio Montes, Metallothionein alone or in combination with Prussian blue attenuates acute thallium systemic toxicity in rats., (lire en ligne).
- ↑ (en) Abolfazle Darroudi, « Ultra-preconcentration technique for the determination of thallium (I) in water samples by a combination of thallium (I)-imprinted polymer and vortex-assisted liquid–liquid microextraction (microextraction expérimentale liquide-liquide, assistée par vortex et polymère à empreinte de thallium (I), a permis une récupération de 90 à 98% du thallium à l'état de traces) », Microchemical Journal, vol. 179, , p. 107527 (ISSN 0026-265X, DOI 10.1016/j.microc.2022.107527, lire en ligne, consulté le ).
- ↑ Cvetkovic J, Arpadjan S, Karadjova I & Stafilov D (2002) Determination of thallium in wine by electrothermal atomic absorption spectrometry after extraction preconcentration. Spectrochimica Acta Part B: Atomic Spectroscopy, 57(6), 1101–1106.
- 1 2 Couture, P., Fortin, C., Hare, L., Lapointe, D., & Pitre, D. (2011). Critical review of thallium in aquatic ecosystems |URL=https://espace.inrs.ca/id/eprint/830/1/R001272.pdf
- ↑ (en) Simon V. Avery, Geoffrey A. Codd et Geoffrey M. Gadd, « Caesium accumulation and interactions with other monovalent cations in the cyanobacterium Synechocystis PCC 6803 », Microbiology, vol. 137, no 2, , p. 405–413 (ISSN 1350-0872 et 1465-2080, DOI 10.1099/00221287-137-2-405, lire en ligne, consulté le ).
- ↑ Julie Dumas, Efficacité d'assimilation de Sialis velata pour le nickel et le thallium présents chez ses proies ; importance de la distribution subcellulaire des métaux chez les proies (Doctoral dissertation, Université du Québec, Institut national de la recherche scientifique ; Maîtrise ès sciences (M. Sc.) en Sciences de l'eau), 2007 |URL=https://espace.inrs.ca/id/eprint/1508/1/T000447.pdf
- ↑ (en) A.M. Varão, J.D.S. Silva, L.O. Amaral et L.L.P. Aleixo, « Toxic effects of thallium acetate by acute exposure to the nematode C. elegans », Journal of Trace Elements in Medicine and Biology, vol. 68, , p. 126848 (DOI 10.1016/j.jtemb.2021.126848, lire en ligne, consulté le ).
- ↑ (en) Li Yang, Jiangping Xiao, Yi Shen et Xian Liu, « The efficient removal of thallium from sintering flue gas desulfurization wastewater in ferrous metallurgy using emulsion liquid membrane », Environmental Science and Pollution Research, vol. 24, no 31, , p. 24214–24222 (ISSN 1614-7499, DOI 10.1007/s11356-017-0040-0, lire en ligne, consulté le ).
- 1 2 3 4 5 (en) Xiaoliu Huangfu, Chengxue Ma, Jun Ma et Qiang He, « Significantly improving trace thallium removal from surface waters during coagulation enhanced by nanosized manganese dioxide », Chemosphere, vol. 168, , p. 264–271 (DOI 10.1016/j.chemosphere.2016.10.054, lire en ligne, consulté le ).
- ↑ (en) Zhuo Zhao, Yanhang Xiong, Xiankun Cheng et Xue Hou, « Adsorptive removal of trace thallium(I) from wastewater: A review and new perspectives », Journal of Hazardous Materials, vol. 393, , p. 122378 (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2020.122378, lire en ligne, consulté le ).
- ↑ (en) Peng-Cheng Luo, Yao-Jen Tu, Ting-Shan Chan et Jian Zhu, « Adsorptive behavior of thallium using Fe3O4-kaolin composite synthesized by a room temperature ferrite process », Chemosphere, vol. 296, , p. 133899 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2022.133899, lire en ligne, consulté le ).
- ↑ (en) Sumihar Hutapea, Marischa Elveny, Mohammed A. Amin et M. S. Attia, « Adsorption of thallium from wastewater using disparate nano-based materials: A systematic review », Arabian Journal of Chemistry, vol. 14, no 10, , p. 103382 (ISSN 1878-5352, DOI 10.1016/j.arabjc.2021.103382, lire en ligne, consulté le ).
- ↑ (en) Ge Zhang, Huifen Yang, Zhen Li et Meiling Jiang, « Comparative investigation on removal of thallium(Ⅰ) from wastewater using low-grade pyrolusite and pyrolysis residue derived from oily sludge: performance, mechanism and application », Groundwater for Sustainable Development, vol. 16, , p. 100713 (ISSN 2352-801X, DOI 10.1016/j.gsd.2021.100713, lire en ligne, consulté le ).
- ↑ (en) Shunli Wan, Minghai Ma, Lu Lv et Liping Qian, « Selective capture of thallium(I) ion from aqueous solutions by amorphous hydrous manganese dioxide », Chemical Engineering Journal, vol. 239, , p. 200–206 (ISSN 1385-8947, DOI 10.1016/j.cej.2013.11.010, lire en ligne, consulté le ).
- 1 2 (en) Lavinia Lupa, Adina Negrea, Mihaela Ciopec et Petru Negrea, « Ionic liquids impregnated onto inorganic support used for thallium adsorption from aqueous solutions », Separation and Purification Technology, vol. 155, , p. 75–82 (DOI 10.1016/j.seppur.2015.06.043, lire en ligne, consulté le ).
- ↑ (en) L. Cocheci, L. Lupa, N. S. Ţolea et C. Muntean, « Sequential use of ionic liquid functionalized Zn-Al layered double hydroxide as adsorbent and photocatalyst », Separation and Purification Technology, vol. 250, , p. 117104 (ISSN 1383-5866, DOI 10.1016/j.seppur.2020.117104, lire en ligne, consulté le ).
- ↑ (en) Evgeny E. Tereshatov, Valérie Mazan, Maria Boltoeva et Charles M. Folden, « Effect of hydrophobic ionic liquids aqueous solubility on metal extraction from hydrochloric acid media: Mathematical modelling and trivalent thallium behavior », Separation and Purification Technology, vol. 255, , p. 117650 (ISSN 1383-5866, DOI 10.1016/j.seppur.2020.117650, lire en ligne, consulté le ).
- ↑ (en) Nana Wang, Zebin Su, Nairui Deng et Yuyin Qiu, « Removal of thallium(I) from aqueous solutions using titanate nanomaterials: The performance and the influence of morphology », Science of The Total Environment, vol. 717, , p. 137090 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2020.137090, lire en ligne, consulté le ).
- ↑ Elia Laroche, Acteurs et mécanismes des bio-transformations de l’arsenic, de l’antimoine et du thallium pour la mise en place d’éco-technologies appliquées à la gestion d’anciens sites miniers, Université Montpellier, (lire en ligne).
- ↑ (en) Yeisy C. López, Greter A. Ortega, Miguel A. Martínez et Edilso Reguera, « Magnetic Prussian Blue derivative like absorbent cages for an efficient thallium removal », Journal of Cleaner Production, vol. 283, , p. 124587 (ISSN 0959-6526, DOI 10.1016/j.jclepro.2020.124587, lire en ligne, consulté le ).
- ↑ (en) Liangjing Zhang, Yu Yang, Shuxuan Wu et Fu Xia, « Insights into the synergistic removal mechanisms of thallium(I) by biogenic manganese oxides in a wide pH range », Science of The Total Environment, vol. 831, , p. 154865 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2022.154865, lire en ligne, consulté le ).
- ↑ (en) Fa Fang, Nuo Li, Xian Zhang et Juan Liu, « Perspective on Fe0-PS synergetic effect and reaction mechanism in the thallium(I) contaminated water treatment », Environmental Research, vol. 214, , p. 113698 (ISSN 0013-9351, DOI 10.1016/j.envres.2022.113698, lire en ligne, consulté le ).
- ↑ (en) Muhammad Haris, Muhammad Usman, Fang Su et Wang Lei, « Programmable synthesis of exfoliated biochar nanosheets for selective and highly efficient adsorption of thallium », Chemical Engineering Journal, vol. 434, , p. 134842 (DOI 10.1016/j.cej.2022.134842, lire en ligne, consulté le ).
- 1 2 (en) Juan Liu, Xudong Wei, Shixing Ren et Jianying Qi, « Synergetic removal of thallium and antimony from wastewater with jacobsite-biochar-persulfate system », Environmental Pollution, vol. 304, , p. 119196 (ISSN 0269-7491, DOI 10.1016/j.envpol.2022.119196, lire en ligne, consulté le ).
- 1 2 3 4 (en) Cher LaCoste, Brett Robinson, Robert Brooks et Chris Anderson, « The Phytoremediation Potential of Thallium-Contaminated Soils Using Iberis and Biscutella Species », International Journal of Phytoremediation, vol. 1, no 4, , p. 327–338 (ISSN 1522-6514, DOI 10.1080/15226519908500023, lire en ligne, consulté le ).
- 1 2 (en) Amelia Corzo Remigio, Filip Pošćić, Philip Nti Nkrumah et Mansour Edraki, « Comprehensive insights in thallium ecophysiology in the hyperaccumulator Biscutella laevigata », Science of The Total Environment, vol. 838, , p. 155899 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2022.155899, lire en ligne, consulté le ).
- ↑ (en) Cher LaCoste, Brett Robinson et Robert Brooks, « Uptake of Thallium by Vegetables: Its Significance for Human Health, Phytoremediation, and Phytomining », Journal of Plant Nutrition, vol. 24, no 8, , p. 1205–1215 (ISSN 0190-4167, DOI 10.1081/PLN-100106976, lire en ligne, consulté le ).
- 1 2 3 4 (en) Abdelnasser Abidli, Yifeng Huang, Zeineb Ben Rejeb et Aniss Zaoui, « Sustainable and efficient technologies for removal and recovery of toxic and valuable metals from wastewater: Recent progress, challenges, and future perspectives », Chemosphere, vol. 292, , p. 133102 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2021.133102, lire en ligne, consulté le ).
- 1 2 3 (en) Haiyin Xu, Yuanling Luo, Ping Wang et Jian Zhu, « Removal of thallium in water/wastewater: A review », Water Research, vol. 165, , p. 114981 (ISSN 0043-1354, DOI 10.1016/j.watres.2019.114981, lire en ligne, consulté le ).
- ↑ J. Poulleau, 2002. Caractérisation des biogaz-Bibliographie-Mesures sur sites. Rapport final INERIS, DRC-02-27158-AIRE-n316b-JPo. URL=https://ondes-info.ineris.fr/consultation_document/sites/default/files/gesdoc/90378/biogaz.pdf ; voir tableau no 28, p. 19/31.
- ↑ (en) Zenon Lukaszewski, Monika Jakubowska, Wlodzimierz Zembrzuski et Bozena Karbowska, « Flow-Injection Differential-Pulse Anodic Stripping Voltammetry as a Tool for Thallium Monitoring in the Environment », Electroanalysis, vol. 22, nos 17-18, , p. 1963–1966 (DOI 10.1002/elan.201000151, lire en ligne, consulté le ).
- ↑ (en) Helen R. Oliveira, Marcia F. Mesko, Maria Goreti R. Vale et Carlos Augusto P. Silveira, « Development of methods for the determination of cadmium and thallium in oil shale by-products with graphite furnace atomic absorption spectrometry using direct analysis », Microchemical Journal, vol. 116, , p. 55–61 (DOI 10.1016/j.microc.2014.04.006, lire en ligne, consulté le ).
- ↑ (en) Wenchuan Zu, Yu Wang, Xiaotao Yang et Cong Liu, « A portable solution cathode glow discharge-atomic emission spectrometer for the rapid determination of thallium in water samples », Talanta, vol. 173, , p. 88–93 (ISSN 0039-9140, DOI 10.1016/j.talanta.2017.05.073, lire en ligne, consulté le ).
- ↑ Environmental Protection Agency (2009) Toxicological Review of Thallium and compounds (CAS No. 7440-28-0). EPA/635/R-08/001F. www.epa.gov/iris
- ↑ (en) Murat Topal, E. Işıl Arslan Topal et Erdal Öbek, « Evaluation of non-carcinogenic health risks of thallium in grapevine exposed to mine waters of an abandoned mining region in Turkey », Environment, Development and Sustainability, vol. 23, no 8, , p. 11553–11562 (ISSN 1387-585X et 1573-2975, DOI 10.1007/s10668-020-01125-x, lire en ligne, consulté le ).
- ↑ (en) Julijana Cvetković, Sonja Arpadjan, Irina Karadjova et Trajče Stafilov, « Determination of thallium in wine by electrothermal atomic absorption spectrometry after extraction preconcentration », Spectrochimica Acta Part B: Atomic Spectroscopy, vol. 57, no 6, , p. 1101–1106 (ISSN 0584-8547, DOI 10.1016/S0584-8547(02)00032-0, lire en ligne, consulté le ).
- ↑ (en) Zhong Zhang, Baogui Zhang, Jiangping Long et Xingmao Zhang, « Thallium pollution associated with mining of thallium deposits », Science in China Series D: Earth Sciences, vol. 41, no 1, , p. 75–81 (ISSN 1006-9313 et 1862-2801, DOI 10.1007/BF02932424, lire en ligne, consulté le ).
- ↑ Zdzisław M. Migaszewski et Agnieszka Gałuszka (2021). Abundance and fate of thallium and its stable isotopes in the environment. Rev Environ Sci Biotechnol 20:5–30 https://doi.org/10.1007/s11157-020-09564-8(0123456789().,-volV() 0123458697().,-volV); 12 février 2021 | URL=https://d-nb.info/123087500X/34
- ↑ , in
- ↑ (en) Abdel Boughriet, Nicolas Proix, Gabriel Billon et Philippe Recourt, « Environmental Impacts of Heavy Metal Discharges from a Smelter in Deûle-canal Sediments (Northern France) : Concentration Levels and Chemical Fractionation », Water, Air, and Soil Pollution, vol. 180, nos 1-4, , p. 83–95 (ISSN 0049-6979 et 1573-2932, DOI 10.1007/s11270-006-9252-5, lire en ligne, consulté le ).
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- A. Lamy, Le thallium et ses principaux composés, vol. 2, (ISSN 0012-9593, DOI 10.24033/asens.13, lire en ligne), p. 71–144
- Santé Canada, « Ébauche d’évaluation préalable Le thallium et ses composés (PDF, 1,34 Mo) », sur canada.ca, (consulté le ).
 .
. - (en) Les J. Evans et Sarah J. Barabash, « Molybdenum, Silver, Thallium and Vanadium », dans Trace Elements in Soils, John Wiley & Sons, Ltd, , 515–549 p. (ISBN 978-1-4443-1947-7, DOI 10.1002/9781444319477.ch22, lire en ligne)
- (en) Anne Tremel, Pierre Masson, H. Garraud, Olivier François Xavier Donard, Denis Baize et Michel Mench, « Thallium in French agrosystems—II. Concentration of thallium in field-grown rape and some other plant species », Environmental Pollution, vol. 97, nos 1-2, , p. 161-168 (ISSN 0269-7491, e-ISSN 1873-6424, OCLC 180429089, PMID 15093390, DOI 10.1016/s0269-7491(97)00060-2, HAL hal-02698743, S2CID 9377949, lire en ligne).
- US EPA (US Environmental Protection Agency) Toxicological review of thallium and compounds ; Support of Summary Information on the Integrated Risk Information System (IRIS).
- (en) A. M. Varão, J. D. S. Silva, L. O. Amaral et L. L. P. Aleixo, « Toxic effects of thallium acetate by acute exposure to the nematode C. elegans », Journal of Trace Elements in Medicine and Biology, vol. 68, , p. 126848 (ISSN 0946-672X, DOI 10.1016/j.jtemb.2021.126848, lire en ligne, consulté le ).
- (en) Marykate U. Anagboso, Andrew Turner et Charlotte Braungardt, « Fractionation of thallium in the Tamar estuary, south west England », Journal of Geochemical Exploration, vol. 125, , p. 1–7 (DOI 10.1016/j.gexplo.2012.10.018, lire en ligne, consulté le ).
- (en) G.E. Batley et T.M. Florence, « Determination of thallium in natural waters by anodic stripping voltammetry », Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, vol. 61, no 2, , p. 205–211 (DOI 10.1016/S0022-0728(75)80251-8, lire en ligne, consulté le ).
- (en) Kateřina Vejvodová, Aleš Vaněk, Ondřej Drábek et Marko Spasić, « Understanding stable Tl isotopes in industrial processes and the environment: A review », Journal of Environmental Management, vol. 315, , p. 115151 (ISSN 0301-4797, DOI 10.1016/j.jenvman.2022.115151, lire en ligne, consulté le ).
- (en) Chengxue Ma, Xiaoliu Huangfu, Yijie Zou et Ruixing Huang, « Kinetics and mechanism of Thallium(I) oxidation by Permanganate: Role of bromide », Chemosphere, vol. 293, , p. 133652 (ISSN 0045-6535, DOI 10.1016/j.chemosphere.2022.133652, lire en ligne, consulté le ).
- Brieger, « Thallium-Strychninvergiftung », Deutsche Zeitschrift für die Gesamte Gerichtliche Medizin, vol. 10, no 1, , p. 634–637 (ISSN 0937-9827 et 1437-1596, DOI 10.1007/bf02673020, lire en ligne, consulté le )
- (en) Kamran Akhbari et Ali Morsali, « Thallium(I) supramolecular compounds: Structural and properties consideration », Coordination Chemistry Reviews, vol. 254, no 17, , p. 1977–2006 (ISSN 0010-8545, DOI 10.1016/j.ccr.2010.03.006, lire en ligne, consulté le )
- Couture P, Fortin C, Hare L, Lapointe D & Pitre D (2011) Review of thallium in aquatic ecosystems. Quebec City, Canada. Critical Research Report No R-127.
Liens externes
- (en) « Technical data for Thallium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |


