| Astate | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | At | ||||||||||
| Nom | Astate | ||||||||||
| Numéro atomique | 85 | ||||||||||
| Groupe | 17 | ||||||||||
| Période | 6e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Halogène/métalloïde | ||||||||||
| Configuration électronique | [Xe] 4f14 5d10 6s2 6p5 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 32, 18, 7 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | [210 u] | ||||||||||
| Rayon de covalence | 150 pm[1] | ||||||||||
| Rayon de van der Waals | 202 pm | ||||||||||
| État d’oxydation | ±1,3,5,7 | ||||||||||
| Électronégativité (Pauling) | 2,2 | ||||||||||
| Oxyde | inconnu | ||||||||||
| Énergies d’ionisation | |||||||||||
| 1re : ~920 kJ·mol-1 | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Solide | ||||||||||
| Système cristallin | Cubique à faces centrées[2] (prédiction) | ||||||||||
| Couleur | métallique (?) | ||||||||||
| Point de fusion | 302 °C[3] | ||||||||||
| Point d’ébullition | 312 °C à 337 °C[4] (calculé) | ||||||||||
| Conductivité thermique | 1,7 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [5] | ||||||||||
| Précautions | |||||||||||
 Radioélément à activité notable |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
L'astate est un radioélément, de symbole At et de numéro atomique 85. C'est le plus rare des éléments chimiques hors transuraniens trouvés naturellement dans la croûte terrestre, où il est produit par décroissance radioactive d'éléments plus lourds. Tous les isotopes de l'astate ont des demi-vies courtes, le moins instable est l'astate 210 avec une période radioactive de 8,1 heures. Un échantillon visible de l'élément pur n'a jamais été produit mais tout spécimen macroscopique serait rapidement vaporisé par la chaleur résultant de sa propre radioactivité.
Les propriétés de l'astate en tant que matériau ne sont donc pas connues avec certitude. Nombre d'entre elles ont été estimées à partir de la position de l'élément dans la table périodique, l'astate étant vu comme un analogue chimique plus lourd de l'iode, et un membre du groupe des halogènes. Un échantillon d'astate serait probablement sombre et pourrait être un semi-conducteur, ou peut-être un métal ; il aurait probablement une température de fusion plus élevée que l'iode. Chimiquement, plusieurs espèces anioniques de l'astate sont connues et la plupart de ces composés ressemblent à ceux de l'iode. L'élément se comporte également à plusieurs points de vue comme un métal, il est notamment capable de former un cation monoatomique stable en solution aqueuse (contrairement aux halogènes plus légers).
L'élément a été découvert lors de sa première synthèse, effectuée en 1940 par Dale R. Corson, Kenneth Ross MacKenzie et Emilio G. Segrè, à l'université de Californie à Berkeley. L'équipe a suggéré de le nommer astatine en anglais, du grec άστατος / ástatos, « instable ». Quatre isotopes de l'astate ont depuis été identifiés dans la nature mais dans des quantités si faibles qu'il ne s'en trouve que de l'ordre du gramme dans la croûte terrestre à chaque instant. Ni l'isotope avec la demi-vie la plus longue, l'astate 210, ni l'isotope le plus médicalement prometteur, l'astate 211, ne se trouvent dans la nature ; ils sont synthétisés en cyclotron, généralement en bombardant de particules alpha une cible de bismuth 209.
Caractéristiques
L'astate est un élément extrêmement radioactif ; tous ses isotopes connus ont des demi-vies de 8,1 heures ou moins et se désintégrent en autres isotopes de l'astate, en bismuth, en polonium ou en radon. La plupart de ses isotopes sont très instables, avec des demi-vies de moins d'une seconde. Des 101 premiers éléments de la classification périodique, seul le francium est plus radioactif[note 1], et tous les isotopes de l'astate moins radioactifs que le francium sont artificiels et ne se trouvent pas dans la nature[6].
Les propriétés macroscopiques de l'astate ne sont pas connues avec certitude[7]. Les recherches sont limitées par sa courte demi-vie, qui empêche la création de quantités significatives[8] (0,5 µg d'astate serait déjà plus radioactif qu'un gramme de radium). Une quantité d'astate visible à l’œil nu se vaporiserait rapidement en raison de la chaleur intense dégagée par sa forte radioactivité[9]. Il reste à voir s'il serait possible, avec des moyens de refroidissement adéquats, de déposer une quantité macroscopique d'astate sous forme de couche mince[10]. Cet élément chimique est généralement classé parmi les non-métaux ou les métalloïdes[11],[12] ; la formation d'une phase métallique a néanmoins été prédite[10],[13].
Propriétés physiques
La plupart des propriétés physiques de l'astate ont été estimées (par interpolation ou extrapolation) à l'aide de méthodes théoriques ou semi-empiriques[14]. Par exemple, les halogènes sont d'autant plus sombres qu'ils sont lourds : le fluor est presque incolore, le chlore vert-jaune, le brome brun-rouge, et l'iode d'un violet-gris sombre. L'astate est donc parfois décrit comme probablement un solide noir (à supposer qu'il suive cette tendance), ou ayant une apparence métallique (si c'est un métalloïde ou un métal)[15],[16],[17]. On s'attend à ce que les points de fusion et d'ébullition de l'astate suivent également la tendance de la série des halogènes, parmi lesquels ils augmentent avec le numéro atomique. Suivant cette hypothèse, ils sont respectivement estimés à 575 et 610 K (302 et 337 °C)[18]. Certains résultats expérimentaux suggèrent néanmoins des valeurs moins élevées, avec 503 K comme température d’ébullition pour l’astate diatomique[19]. Il se sublime moins facilement que l'iode, ayant une pression de vapeur plus faible[8]. Même ainsi, la moitié d'une quantité donnée d'astate se vaporiserait en l'espace d'une heure environ si elle était déposée sur une surface de verre propre à température ambiante[note 2]. Son spectre d'absorption dans la région des ultraviolets moyens possède des raies à 224,401 et 216,225 nm, ce qui tend à indiquer des transitions électroniques 6p à 7s[21],[22].
La structure de l'astate solide est inconnue[23]. En tant qu'halogène et analogue de l'iode, il pourrait avoir une structure cristalline orthorhombique composée de molécules d'astate diatomique, et se montrer semi-conducteur (avec un gap de 0,7 eV)[24]. Si l'astate sous forme condensée se comporte davantage comme un métal, en revanche, il pourrait cristalliser dans un système cubique à faces centrées, et pourrait même se révéler dans cette hypothèse supraconducteur, comme l'iode qui sous haute pression forme ce type de phase[10]. Les résultats expérimentaux concernant l'existence ou l'inexistence d'astate diatomique (At2) sont rares et non concluants[25],[26],[27],[28],[29]. Certaines sources affirment que cette forme n'existe pas ou du moins n'a jamais été observée[30],[31], d'autres soutiennent ou impliquent le contraire[19],[32],[33]. En dépit de cette controverse, de nombreuses propriétés de l'astate diatomique ont été prédites[34] : par exemple, la longueur de la liaison serait de 300 ± 10 pm, son énergie de dissociation[35] de 83,7 ± 12,5 kJ mol−1, et sa chaleur latente de vaporisation[36] (∆Hvap) de 54,39 kJ mol−1. Cette dernière valeur implique que l'astate pourrait être métallique, au moins sous sa forme liquide, considérant que tous les éléments avec une chaleur latente de vaporisation supérieure à environ 42 kJ mol−1 sont métalliques à l'état liquide[37] ; l'iode diatomique, avec une valeur de 41,71 kJ mol−1, se situe juste en dessous de cette valeur seuil[38],[note 3].
Propriétés chimiques
Sa chimie est « obscurcie par les concentrations extrêmement basses auxquelles les expériences sur l'astate ont été menées, et par la possibilité de réactions avec des impuretés, avec les parois ou les filtres, ou avec des sous-produits radioactifs, et par d'autres interactions parasites à l'échelle nanoscopique »[note 4]. Nombre de ses propriétés chimiques apparentes ont été observées au cours d'expériences où l'astate se trouve en ultratrace, en solution extrêmement diluée[33],[41], typiquement moins[42] de 10−10 mol L−1 (ce qui correspond déjà en activité à environ 1,6 GBq L−1). Certaines propriétés, telle que la formation d'anions, se retrouvent chez les autres halogènes[8]. Il a certaines caractéristiques d'un métal, telle que le fait de se déposer sur une cathode[note 5], de coprécipiter avec d'autres sulfures métalliques dans l'acide chlorhydrique[44], et de former un cation monoatomique stable en solution aqueuse[44],[45]. Il forme des complexes avec l'EDTA, un agent chélatant[46], et il se montre capable de réagir comme un métal lors du marquage d'anticorps ; sous certains aspects l'astate à son degré d'oxydation +I se comporte comme l'argent dans le même état. L'essentiel de la chimie organique de l'astate est néanmoins analogue à celle de l'iode[47] : il est notamment susceptible de former une liaison halogène, plus aisément encore que l'iode[48].
L'astate a une électronégativité de 2,2 sur l'échelle révisée de Pauling, plus basse que celle de l'iode et la même que l'hydrogène. Dans l'astature d'hydrogène (HAt), la charge négative est supposément portée par l'atome d'hydrogène, ce qui implique que ce composé devrait plutôt s'appeler hydrogénure d'astate[49],[50],[51],[52]. Une telle observation serait cohérente avec la valeur de l'électronégativité sur l'échelle d'Allred-Rochow, (1,9), moindre que celle de l'hydrogène (2,2)[53],[note 6]. Il a été prédit en 2011 que l'affinité électronique de l'astate serait inférieure d'un tiers à celle du chlore (qui, parmi les halogènes, possède la plus grande) en raison des interactions spin-orbite[42], cette affinité a été confirmée en 2020 égale[55] à 233 kJ·mol-1[note 7].
Composés
L'astate est moins réactif que l'iode, qui est lui-même le moins réactif des autres halogènes[56]. Ses composés ont été synthétisés en infimes quantités et étudiés autant que possible avant leur désintégration radioactive. Les réactions impliquées ont principalement été testées avec des solutions diluées d'astate mélangées à de plus grandes quantités d'iode. L'iode permet de s'assurer de la présence d'une quantité de matière suffisante pour le bon fonctionnement des techniques de laboratoire habituelles, comme la filtration ou la précipitation[57],[58],[note 8]. Comme l'iode, l'astate peut adopter des degrés d’oxydation impairs de -1 à +7.
Les composés connus formés avec des métaux sont rares. Sont attestés l'astature de sodium[9], de palladium, d'argent, de thallium et de plomb[61]. Certaines caractéristiques des astatures d'argent et de sodium, ainsi que des astatures d'autres alcalins et alcalino-terreux, ont été estimées par extrapolation à partir des halogénures d'autres métaux[62].

Les pionniers de la chimie de l'astate ont remarqué la formation d'un composé d'astate et d'hydrogène généralement appelé astature d’hydrogène[63], bien que « hydrure d'astate » soit un nom plus approprié. Ce composé est facilement oxydé ; l'acidification par de l'acide nitrique dilué donne les formes At0 ou At+, et l'ajout subséquent d'argent(I) ne peut précipiter au mieux que partiellement l'astate sous forme d'astature d'argent(I) (AgAt). Au contraire, l'iode n'est pas oxydé et forme facilement un précipité d'iodure d'argent(I)[8],[64].
L'astate peut former une liaison avec le bore[65], le carbone et l'azote[66]. Différents complexes du bore ont été préparés avec des liaisons At–B, celle-ci étant plus stables que les liaisons At–C[67]. L'astate peut remplacer un hydrogène dans un cycle benzénique pour former de l'astatobenzène, C6H5At ; celui-ci peut être oxydé en C6H5AtCl2 par du chlore. En traitant ce composé par une solution basique d'hypochlorite, on peut produire C6H5AtO2 [68]. Dans le perchlorate de dipyridine-astate(I) [At(C5H5N)2][ClO4] et son analogue nitrate, l'atome d'astate est lié à chacun des azotes des deux anneaux pyridine[66].
Comme composés avec l'oxygène, les ions AtO− et AtO+ ont été mis en évidence en solution aqueuse, formés par la réaction de l'astate avec un oxydant tel que le brome élémentaire ou (pour AtO+) du persulfate de sodium dans une solution d'acide perchlorique[8],[69]. L'espèce précédemment identifiée comme étant AtO2− s'est depuis révélée être AtO(OH)2−, un produit de l'hydrolyse de AtO+ (comme l'est AtOOH)[70]. L'anion AtO3−, bien caractérisé, peut être obtenu entre autres par oxydation de l'astate par de l'hypochlorite de potassium dans une solution d'hydroxyde de potassium[68],[71]. Le triastatate de lanthane La(AtO3)3 a été préparé par oxydation de l'astate dans une solution chaude de Na2S2O8[72]. Une oxydation supplémentaire de AtO3−, par exemple par du difluorure de xénon (en solution basique à chaud) ou du periodate (en solution neutre ou basique), aboutit à l'ion perastatate AtO4−, qui n'est stable qu'à pH supérieur ou égal à 7[73]. On pense que l'astate est également capable de former des cations dans des sels avec des oxyanions, comme l'iodate ou le dichromate, car on observe en solution acide la coprécipitation de l'astate dans un état d'oxydation positif monovalent ou intermédiaire avec des sels insolubles de cations métalliques tels que l'iodate d'argent(I) ou le dichromate de thallium(I)[68],[74].
L'astate peut former des composés avec les autres chalcogènes, par exemple S7At+ et At(CSN)2− avec le soufre, un composé de coordination sélénourée avec le sélénium, et un colloïde d'astate-tellure avec le tellure[75].
L'astate est connu pour réagir avec ses homologues plus légers que sont l'iode, le brome et le chlore à l'état gazeux ; ces réactions produisent des composés interhalogènes de formules AtI, AtBr, et AtCl[59]. Les deux premiers de ces composés peuvent également être produits dans l'eau – l'astate réagit avec une solution d'iode/iodure pour former AtI, tandis que la formation d'AtBr requiert (outre l'astate) une solution d'iode/monobromure d'iode/bromure. L'excès d'iodure ou de bromure peut conduire à la formation d'ions[59] AtBr2− et AtI2−, ou dans une solution de chlorure, ils peuvent produire des espèces comme AtCl2− ou AtBrCl− via des réactions d'équilibre avec les chlorures[60]. L'oxydation de l'élément par du dichromate (en solution d'acide nitrique) montre qu'ajouter des chlorures transforme l'astate en une molécule à l'identification incertaine, probablement AtCl ou AtOCl. De même, on peut produire AtOCl2− ou AtCl2− [59]. Les polyhalogénures PdAtI2, CsAtI2, TlAtI2, [76],[77],[78] et PbAtI[79] sont connus pour avoir été précipités (ou présumés l'avoir été). Dans un spectromètre de masse à plasma (comme source d'ions), les ions [AtI]+, [AtBr]+, et [AtCl]+ ont été formés en introduisant les vapeurs des halogènes plus légers dans la cellule remplie d'hélium contenant l'astate, ce qui est un indice en faveur de l'existence de molécules neutres stables dans le plasma ionisé[59]. Aucun fluorure d'astate n'a encore été découvert. Leur absence a été attribuée, possiblement, à l'extrême réactivité de tels composés, qui inclurait la réaction d'un composé fluoré initialement formé avec les parois en verre du récipient pour former un produit non-volatil[note 9]. C'est pourquoi, bien que la synthèse d'un fluorure d'astate ne soit pas exclue, elle pourrait requérir un solvant liquide de fluorure d'halogène, comme il en a été utilisé pour la caractérisation du fluorure de radon[59],[73].
Histoire
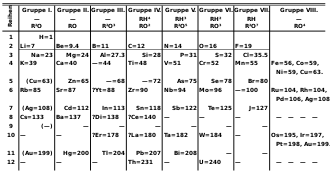
En 1869, lorsque Dimitri Mendeleïev publie son tableau périodique des éléments, l'espace situé sous l'iode est vide. Une fois les bases physiques de la classification des éléments établies par Niels Bohr, cet emplacement semble devoir être occupé par le cinquième halogène. Avant la reconnaissance officielle de sa découverte, cet élément hypothétique est appelé éka-iode (eka-iodine en anglais, du sanskrit एक, éka pour « un ») pour refléter sa position un rang en dessous de l'iode[83] (comme l'éka-bore, l'éka-césium, ou d'autres). Étant donné son extrême rareté, de nombreuses fausses découvertes sont annoncées au fil du temps[84].
La première revendication de découverte de l'éka-iode est faite en 1931 par l'Américain Fred Allison et ses collègues de l'Institut polytechnique d'Alabama (aujourd'hui université d'Auburn), qui utilisent 45 kg de monazite du Brésil pour isoler l'élément. Ils lui donnent le nom d’alabame (alabamine en anglais) d'après l'Alabama et le symbole Am, ensuite modifié en Ab, qui reste utilisé pendant quelques années[85],[86],[87],[88]. La méthode d'Allison et sa découverte sont invalidées en 1934 par Herbert G. MacPherson (en) de l'université de Californie à Berkeley[89].
En 1937, le chimiste indien Rajendralal De annonce la découverte de l'élément 85 à partir de monazite. Il le baptise dakin, probablement d'après la ville de Dacca[90] où il travaille, puis dekhine. Il déclare l'avoir isolé de la chaîne de désintégration du thorium, où il aurait la même place vis-à-vis du thorium que le radium F (polonium 210) dans la série du radium. Cependant, les propriétés du dakin ne correspondent pas à celles de l'astate, et il n'existe en réalité pas d'isotope de l'astate dans la chaîne de désintégration du thorium, même dans les voies de désintégration minoritaires[91]. La véritable identité du dakin reste donc inconnue[92],[93].
En 1936, le Roumain Horia Hulubei et la Française Yvette Cauchois revendiquent la découverte de l'élément 85 par spectroscopie des rayons X. Ils publient un article en 1939 qui confirme et complète leurs données de 1936. Hulubei publie un résumé de ces données en 1944 et affirme que le travail d'autres chercheurs les confirme. Il nomme cet élément dor, du roumain pour « désir, nostalgie »[94]. Sa découverte est réfutée en 1947 par l'Autrichien Friedrich Paneth. En effet, même si les échantillons d'Hulubei contenaient de l'astate, ses moyens pour le détecter étaient trop faibles selon les normes contemporaines pour qu'il ait effectivement pu l'identifier[90]. Hulubei est également à l'origine d'une annonce de découverte erronée du francium, ce qui a pu conduire d'autres chercheurs à considérer ses travaux avec scepticisme[95].

En 1940, le Suisse Walter Minder annonce la découverte de l'élément 85 dans les produits de désintégration bêta du radium A (polonium 218)[note 10] et le nomme helvetium, d'après la Suisse[90]. Berta Karlik et Traude Bernert ne parviennent pas à reproduire son expérience et attribuent ses résultats à une contamination du flux de radon (le radon 222 est l'isotope parent du polonium 218)[97]. Avec la Britannique Alice Leigh-Smith, Minder annonce la découverte d'un autre isotope de l'élément 85 en 1942, vraisemblablement un produit de désintégration bêta du thorium A (polonium 216). Les deux chercheurs le baptisent anglo-helvetium[98],[99] en référence à leurs pays respectifs[90]. Cependant, Karlik et Bernert sont encore une fois incapables de reproduire ces résultats[57].
L'élément est finalement isolé en 1940 par Dale R. Corson, K. R. MacKenzie et Emilio Segrè de l'université de Californie à Berkeley. Au lieu de le chercher dans la nature, ils le synthétisent en bombardant du bismuth 209 avec des particules alpha dans un cyclotron[100],[101]. La réaction s'accompagne de l'émission de deux neutrons et aboutit à l'astate 211, premier isotope formellement identifié. Les découvreurs ne proposent pas immédiatement un nom pour ce nouvel élément en raison de leur méthode : à l'époque, l'identification d'un élément pas encore découvert dans la nature, mais créé par synthèse en quantités invisibles, n'est pas considérée comme valide. De plus, les chimistes hésitent à considérer les radioisotopes comme aussi légitimes que les isotopes stables[102]. En 1943, Berta Karlik et Traude Bernert découvrent l'astate dans deux chaînes de désintégration naturelle, d'abord dans celle de l'uranium 238, puis dans celle de l'uranium 235[103],[104]. Par la suite, l'astate est également découvert[105] dans la chaîne principale de désintégration du neptunium 237[106], mais le neptunium est très rare à l'état naturel, étant produit par capture neutronique dans les minerais d'uranium.
En 1946, Friedrich Paneth appelle à reconnaître enfin les éléments synthétiques, citant notamment parmi ses arguments la récente confirmation de leur occurrence naturelle, et il propose que les découvreurs de ces nouveaux éléments soient ceux qui les nomment. Début 1947, Nature publie les suggestions des découvreurs : une lettre de Corson, MacKenzie et Segrè propose le nom anglais d’astatine[102], venant du grec άστατος / ástatos, « instable », en raison de sa tendance à se désintégrer, avec la terminaison « -ine » qui en anglais est caractéristique des halogènes. Ce nom permet également de perpétuer la tradition consistant à baptiser les halogènes d'après l'une de leurs propriétés[107]. Il est accepté par l’Union internationale de chimie pure et appliquée en 1949[108],[109].
Corson et ses collègues classent l'astate comme un métal en se fondant sur sa chimie analytique[110]. Des études plus poussées mettent en évidence un comportement similaire à l'iode[111],[112], cationique[113],[114] ou amphotérique[115],[116]. Lors d'une rétrospective, en 2003, Corson a écrit que « certaines des propriétés [de l'astate] sont similaires à celles de l'iode » et que l'élément « présente également des propriétés métalliques, plus proches de celles du polonium et du bismuth, ses voisins métalliques »[note 11].
Isotopes
Il y a 41 isotopes connus de l'astate, avec des nombres de masse compris entre 188 et 229 (l'isotope 189At n'ayant pas encore été synthétisé)[117],[118]. La modélisation théorique suggère l'existence possible de 35 isotopes supplémentaires[108]. Aucun isotope stable ou à longue demi-vie n'a été observé, et on ne s'attend pas à ce qu'il en existe[119].
| Données de désintégration alpha pour quelques isotopes[note 12] | ||||
|---|---|---|---|---|
| Nombre
de |
Excès de masse[6] |
Demi-vie[6] | Énergie
moyenne |
Probabilité[6] |
| 207 | -13,243 MeV | 1,80 h | 5,873 MeV | 8,6 % |
| 208 | -12,491 MeV | 1,63 h | 5,752 MeV | 0,55 % |
| 209 | -12,880 MeV | 5,41 h | 5,758 MeV | 4,1 % |
| 210 | -11,972 MeV | 8,1 h | 5,632 MeV | 0,175 % |
| 211 | -11,647 MeV | 7,21 h | 5,983 MeV | 41,8 % |
| 212 | -8,621 MeV | 0,31 s | 7,825 MeV | ≈ 100 % |
| 213 | -6,579 MeV | 125 ns | 9,255 MeV | 100 % |
| 214 | -3,380 MeV | 558 ns | 8,986 MeV | 100 % |
| 219 | 10,397 MeV | 56 s | 6,324 MeV | 97 % |
| 220 | 14,350 MeV | 3,71 min | 6,052 MeV | 8 % |
Les énergies de désintégration des désintégrations alpha de l'astate suivent la même tendance que pour d'autres éléments lourds[119]. Les isotopes les plus légers ont des énergies alpha de désintégration relativement élevées, qui décroissent lorsque les isotopes sont plus lourds. L'astate 211 a une énergie significativement plus grande que l'isotope précédent, parce qu'il a un noyau à 126 neutrons, ce qui correspond à un nombre magique et donc à une couche de neutrons remplie. Bien que sa demi-vie soit comparable à l'isotope précédent (7,2 h pour 211At, 8,1 h pour 210At), sa probabilité de désintégration par voie alpha est bien plus grande : 41,81 % contre seulement 0,18 %[6]. Les deux isotopes suivants dégagent encore plus d'énergie, avec notamment l'astate 213, qui libère le plus d'énergie. Pour cette raison, c'est aussi l'isotope connu qui a la plus courte demi-vie[119]. Bien que les isotopes plus lourds libèrent moins d'énergie, il n'existe aucun isotope à longue demi-vie, en raison du rôle croissant de la désintégration bêta (émission d'électron)[119]. Ce mode de désintégration est particulièrement important pour l'astate ; dès 1950 des scientifiques postulent que tous les isotopes de cet élément se désintégreraient par voie bêta[120]. Des modes de désintégration bêta ont été trouvés pour tous les nucléides connus de l'astate sauf 213At, 214At, 215At et 216mAt[6]. L'astate 210 et les isotopes plus légers peuvent se désintégrer selon le mode β+ (émission de positron), l'astate 216 et les isotopes plus lourds se désintègrent sur le mode β−, et l'astate 212 peut se désintégrer suivant les deux modes, tandis que l'astate 211 peut subir une capture électronique[6].
Le moins radioactif des isotopes est l'astate 210, avec une demi-vie de 8,1 h. Son mode de désintégration principal est β+, vers le polonium 210, lui-même émetteur alpha, qui a une demi-vie plus longue, égale à 138 j. Au total, seuls cinq isotopes connus ont une demi-vie supérieure à une heure (de 207At à 211At). L'isotope le plus radioactif à l'état fondamental connu est l'astate 213, avec une demi-vie de 125 ns. Il se désintègre par voie alpha vers le bismuth 209, quasi stable[6].
On connaît à l'astate 24 isomères nucléaires, qui sont des noyaux avec un ou plusieurs nucléons dans un état excité. Un isomère nucléaire est parfois appelé métastable, ce qui signifie que le système a une énergie interne plus élevée que l'état fondamental (l'état d'énergie minimale), et donc que l'isomère nucléaire a tendance à retourner à l'état fondamental. Il peut y avoir plus d'un isomère nucléaire par isotope. Le moins radioactif d'entre eux est l'astate 202m1[note 13], qui a une demi-vie d'environ 3 minutes. Le plus radioactif est l'astate 214m1, d'une demi-vie de 265 nanosecondes (plus courte que celle de tous les nucléides connus sauf 213At)[6],[108].
Abondance
-FR.svg.png.webp)
Parmi les éléments présents dans la nature, les seuls éléments moins abondants que l’astate sont des transuraniens, raison pour laquelle il y est généralement considéré comme l'élément le plus rare[121]. La quantité totale de cet élément dans la croûte terrestre (masse de 2,36 × 1025 grammes)[122] est estimée comprise entre le dixième et la trentaine de grammes à un instant donné[123],[8].
Tout atome d’astate présent à la formation de la Terre s’est désintégré. Les quatre isotopes présents dans la nature (215At, 217At, 218At et 219At[124]) sont continuellement renouvelés en tant que produits des désintégrations des isotopes primordiaux du thorium, de l’uranium et de traces de neptunium 237 radiogénique. Les seize premiers kilomètres en profondeur de l’ensemble du continent américain contiennent de l’ordre de 1012 atomes d’astate 215 à un instant considéré (de l’ordre de 3,5 × 10−10 grammes)[125]. L’astate 217 est produit lors de la désintégration du neptunium 237 (voir figure ci-contre), présent à l’état de traces dans les minerais d’uranium où il est produit par transmutation[126]. L’astate 218 est le premier isotope découvert dans la nature[127] quand l’astate 219, avec une demi-vie d’environ 56 secondes, est l’isotope présent dans le milieu naturel ayant la plus longue période radioactive[6].
Certains isotopes de l’astate ne sont pas toujours considérés comme présents naturellement dans l’environnement, par méconnaissance[115],[128] ou désaccords dans la littérature. Ainsi, la présence de l’astate 216 dans la nature a été rapportée[129] mais son signalement est controversé et non confirmé[130].
Synthèse
Formation
L'astate a été produit pour la première fois en bombardant une cible de bismuth 209 avec des particules alpha énergétiques, et cette voie de synthèse reste la plus utilisée pour produire les isotopes à relativement longue demi-vie 209At, 210At et 211At. L'astate n'est produit qu'en très faibles quantités, les techniques modernes permettant de monter jusqu'à 6,6 GBq[132] produits en une fois (à peu près 86 ng, soit 2,47 × 1014 atomes). La synthèse de quantités plus importantes d'astate en utilisant cette méthode est limitée par la faible disponibilité de cyclotrons adéquats et par la perspective de fondre la cible[132],[133],[note 14]. La radiolyse du solvant en raison de l'effet cumulatif de la désintégration de l'astate[135] pose également problème. Avec des techniques cryoscopiques, il est possible que l'on puisse atteindre le microgramme d'astate produit, par irradiation de proton d'une cible de thorium ou d'uranium, générant du radon 211 qui décroît en astate 211. On s'attend néanmoins à ce que cette méthode résulte en une contamination de l'isotope produit par de l'astate 210[136].
L'isotope le plus important est l'astate 211, le seul qui ait un usage commercial. Pour produire la cible de bismuth, le métal est déposé par pulvérisation cathodique sur une surface d'or, de cuivre ou d'aluminium, à raison de 50 à 100 mg cm−2. L'oxyde de bismuth peut être utilisé à la place ; il est alors soudé à une plaque de cuivre[137]. La cible est gardée sous atmosphère inerte d'azote[138], et elle est refroidie à l'eau pour éviter la vaporisation prématurée de l'astate[137]. Dans un accélérateur de particules, comme un cyclotron[139], les particules alpha entrent en collision avec le bismuth. Bien qu'un seul isotope du bismuth soit utilisé (le bismuth 209), la réaction peut se produire de trois façons différentes en fonction de l'énergie des particules alpha, produisant 209At, 210At ou 211At. Pour éviter de produire les nucléides non souhaités, l'énergie maximum de l'accélérateur de particules est fixée à une valeur (idéalement 29,17 MeV)[140] supérieure à celle nécessaire pour produire l'astate 211 (pour bien produire l'isotope voulu) mais inférieure à celle qui aboutirait à l'astate 210 (pour éviter de produire des isotopes indésirables)[137].
Méthodes de séparation
Dans la mesure où l'astate est le produit principal de la synthèse, après sa formation il doit seulement être isolé de la cible et de toute contamination. Plusieurs méthodes sont possibles à cet effet, « mais elles suivent généralement l'une de deux approches — distillation sèche ou traitement en solution acide de la cible suivi d'une extraction par solvant »[note 15]. Les méthodes abordées ci-après sont des adaptions modernes de procédures plus anciennes, telles que revues par Kugler et Keller[141],[note 16]. Les techniques d'avant 1985 incluaient souvent l'élimination du polonium 210, qui était alors co-produit lors de l'irradiation, mais cette mesure est moins nécessaire en veillant à ce que l'énergie de la ligne d'irradiation du cyclotron ne dépasse pas une valeur seuil[132].
Par voie sèche
La cible irradiée contenant maintenant de l'astate est chauffée à environ 650 °C. L'astate se volatilise, puis est condensée (typiquement dans un piège à froid). Des températures plus élevées (jusqu'à 850 °C) peuvent accroître le rendement, au risque de contaminer l'échantillon via la co-volatilisation du bismuth. Il peut être nécessaire de redistiller le condensat pour limiter la présence de bismuth[142] (car le bismuth peut interférer avec les réactions de marquage de l'astate). L'astate est récupéré à partir du piège en utilisant de la soude diluée, du méthanol ou du chloroforme. Des rendements approchant les 80 % peuvent être atteints. La voie sèche est la méthode la plus utilisée pour produire une forme chimiquement utilisable d'astate[133],[143].
Par voie humide
La cible de bismuth (parfois de trioxyde de bismuth) est dissoute dans de l'acide concentré (généralement nitrique ou perchlorique). L'astate est extrait à l'aide d'un solvant organique tel que de l'éther de butyle ou d'isopropyle, ou du thiosemicarbazide. Un rendement de séparation de 93 % à l'acide nitrique a été publié, chutant à 72 % à la fin des opérations de purification (distillation de l'acide nitrique, purge des oxydes d'azote résiduels, et resolvatation du nitrate de bismuth pour permettre l'extraction liquide-liquide)[144]. Les méthodes par voie humide impliquent « plusieurs étapes demandant la manipulation de produits radioactifs »[note 17] et ne conviennent pas vraiment à l'isolation de grandes quantités d'astate. Elles peuvent néanmoins permettre la production d'astate à un degré d'oxydation spécifique et peuvent donc trouver plus d'applications dans le domaine de la radiochimie expérimentale[132].
Utilisations et précautions
« [L'astate est] une plaie à produire et un enfer à manipuler[note 18]. »
— P. Durbin, Human Radiation Studies: Remembering the Early Years, 1995
Quelques composés d'astate 211 et leurs utilisations[146] Agent Applications Colloïdes d'astate-tellure Tumeurs compartimentales Diphosphate de 6-astato-2-méthyl-1,4-naphtaquinole Adénocarcinome Bleu de méthylène radiomarqué Mélanomes Guanidine de méta-astatobenzyl Tumeurs neuro-endocrines 5-astato-2'-déoxyuridine Diverses Composés de biotine radiomarqués Diverses de pré-ciblage Octréotide radiomarqué Récepteurs de la somatostatine Anticorps monoclonaux et fragments radiomarqués Diverses Biphosphonates radiomarqués Métastases osseuses
L'astate 211 est l'objet de recherches actives dans le domaine de la médecine nucléaire[146]. L'isotope doit être utilisé rapidement après sa synthèse étant donné sa demi-vie de 7,2 h ; cette période est néanmoins suffisante pour permettre des stratégies de marquage en plusieurs étapes. L'astate 211 a un potentiel pour être utilisé dans des traitements d'alpha-immunothérapie, puisqu'il se désintègre soit en mode alpha[147] (vers le bismuth 207), soit par capture électronique (vers le polonium 211, à très courte demi-vie et lui-même émetteur alpha). Les rayons X émis par le polonium 211, entre environ 77 et 92 keV, permettent le suivi de l'astate dans les animaux et les patients[146]. Bien que l'astate 210, avec une demi-vie légèrement plus longue que l'astate 211, puisse paraître plus intéressant pour la même application, cet isotope est totalement impropre à l'usage médical car il se désintègre en polonium 210, extrêmement toxique, notamment pour la moelle osseuse, et avec une demi-vie plus longue[148],[132].
La différence principale dans le milieu médical entre l'astate 211 et l'iode 131 (un isotope de l'iode utilisé en médecine nucléaire) réside dans l'émission de rayonnements bêta à hautes énergies par 131I contrairement à 211At. Le rayonnement bêta a un pouvoir pénétrant dans les tissus plus important que le rayonnement alpha : une particule alpha d'énergie moyenne émise par 211At peut traverser 70 µm dans les tissus environnants quand une particule bêta d'énergie moyenne issue d'131I peut parvenir presque trente fois plus loin, traversant environ 2 mm[137]. Une courte demi-vie associée au pouvoir pénétrant limité du rayonnement alpha dans les tissus est un avantage lorsque la « charge tumorale est faible et/ou les populations de cellules malignes sont situées à proximité immédiate de tissus normaux sains »[note 19]. Une mortalité cellulaire significative dans des cultures de cellules reproduisant des cancers humains a ainsi été atteinte avec un à dix atomes d'astate 211 liés par cellule[149].

Le développement de médicaments à base d'astate pour la lutte contre le cancer s'est heurté à plusieurs obstacles. La Seconde Guerre mondiale a retardé les recherches de près d’une décennie. Les résultats d'essais préliminaires indiquaient qu'un agent de transport sélectif pour le cancer aurait besoin d'être développé, et ce n'est que dans les années 1970 que des anticorps monoclonaux pouvant jouer ce rôle arrivèrent sur le marché[136]. Contrairement à l'iode, l'astate a tendance à casser sa liaison avec de telles molécules, surtout avec les carbones hybridés sp3[note 20] (moins pour ceux hybridés sp2). Étant donné la toxicité de l'astate, qui a tendance à s'accumuler dans le corps lorsque le radioisotope est libre d'y circuler, il est vital de s'assurer qu'il reste attaché à sa molécule-hôte. Si l'efficacité des molécules de transport qui sont lentement métabolisées peut être évaluée, les molécules plus rapidement métabolisées demeurent un obstacle non négligeable à l'évaluation de l'astate en tant que traitement médical. Atténuer la radiolyse (due à l'astate) des molécules porteuses est une autre voie possible de développement. Une application pratique de l'astate comme traitement anticancéreux pourrait potentiellement profiter à un nombre « effarant » de patients ; la production d'astate dans des quantités qui seraient alors nécessaires reste un problème[136],[150],[note 21].
Des études chez l'animal montrent que l'astate, comme l'iode quoiqu'à un moindre degré, est surtout concentré dans la thyroïde. Contrairement à l'iode, l'astate fait également preuve d'une tendance à s'accumuler dans les poumons et la rate, peut-être en raison de l'oxydation in vivo de At− vers At+[47]. Lorsque l'astate est administré sous la forme d'un radiocolloïde, il a tendance à se concentrer dans le foie. Des expériences chez les rats et les singes suggèrent que l'astate 211 cause de bien plus graves dégâts à la thyroïde que n'en fait l'iode 131. Des injections répétées du nucléide résultent ainsi en une nécrose et de la dysplasie cellulaire dans la glande thyroïde[151]. Des études préliminaires suggèrent que l'injection d'astate 211 chez des rongeurs femelles provoque des modifications morphologiques du tissu mammaire[152] ; cette conclusion est restée controversée pendant des années. Le consensus qui a été atteint par la suite est que cet effet était probablement causé par l'irradiation des tissus de la poitrine, combiné aux modifications hormonales dues à l'irradiation des ovaires[145]. D'infimes quantités d'astate peuvent être manipulées sans danger sous sorbonne si la hotte est bien aspirante ; l'introduction de l'élément dans l'organisme doit cependant être évitée[153].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Astatine » (voir la liste des auteurs).
Notes
- ↑ C'est-à-dire que l'isotope le plus stable (à plus longue demi-vie) du francium, le francium 223, a une demi-vie de 22 minutes, plus courte que celle de l'isotope le plus stable de l'astate.
- ↑ Cette durée de demi-vaporisation monterait à 16 heures si le dépôt était réalisé sur une surface d'or ou de platine, peut-être en raison des interactions encore mal comprises entre l'astate et ces métaux nobles[20].
- ↑ La réfractivité molaire de l'astate diatomique a été extrapolée à 41,4 cm3 en utilisant la méthode donnée par Johnson[39] (c'est-à-dire à partir du graphe des valeurs connues pour F, Cl, Br et I tracées en fonction du cube de leur rayon de covalence). Cette valeur indique que l'astate peut être un métal dans son état condensé, si l'on se fonde sur le critère de Goldhammer-Herzfeld, qui prédit un comportement métallique si le rapport de la réfractivité molaire sur le volume molaire est supérieur ou égal à 1[40].
- ↑ « The foregoing description is however clouded by the extremely low concentrations at which astatine experiments have been conducted, and the possibility of reactions with impurities, walls and filters, or radioactivity by-products, and other unwanted nano-scale interactions »[24].
- ↑ Il est également possible qu'il s'agisse de sorption sur une cathode plutôt que d'électrodéposition[43].
- ↑ L'algorithme utilisé pour générer l'échelle d'Allred-Rochow ne fonctionne pas pour l'hydrogène, il génère une valeur proche de celle de l'oxygène (3,5). À la place, on assigne à l'hydrogène une valeur de 2,2. En dépit de ses défauts, l'échelle d'Allred-Rochow est assez largement reconnue et utilisée[54].
- ↑ 2,41578(7) eV d'après l'article, valeur convertie dans le système SI
- ↑ L'iode peut remplir ce rôle en dépit de ses réactions avec l'astate en solution aqueuse, parce que ces réactions nécessitent l'ion iodure (I−), pas le diode I2 (ou du moins pas seulement)[59],[60].
- ↑ Une première tentative de fluorer l'astate en utilisant du trifluorure de chlore a conduit à la formation d'un produit de réaction qui est resté « collé » à la paroi en verre. Du monofluorure de chlore, du chlore et du tétrafluorosilane se sont formés. Les auteurs de l'expériences l'ont qualifiée de « troublante » et ont admis qu'ils s'attendaient à la formation d'un fluorure volatil[80]. Dix ans plus tard, ce composé a été prédit comme étant non-volatil, contrairement aux autres halogènes mais comme le difluorure de radon[81] ; on avait alors déterminé que celui-ci était ionique[82].
- ↑ L'astate 218 est bien l'isotope-fils du polonium 218 par désintégration bêta[96], qui est une voie minoritaire (0,02 % des désintégrations).
- ↑ « Some of the properties [of astatine] are similar to iodine, its lower homolog. It also exhibits metallic properties, more like its metallic neighbors Po and Bi »[107].
- ↑ Dans cette table, sous les mots « excès de masse », les équivalents en énergie sont donnés plutôt que les valeurs en masse.
- ↑ « m1 » signifie qu'il s'agit du premier état excité au-dessus de l'état fondamental. « m2 » et autres indications similaires indiquent les états d'énergie plus élevée. Le nombre est parfois omis si l'isomère nucléaire en question est le seul bien établit, comme pour l'astate 216m.
- ↑ Voir néanmoins Nagatsu et al.[134], qui encapsulent la cible de bismuth dans un fin film d'aluminium et le place dans un portoir en niobium capable de retenir du bismuth fondu.
- ↑ « A variety of methods have been reported for 211At recovery but they generally follow one of two approaches – dry distillation or acid treatment of the target followed by solvent extraction »[132].
- ↑ Voir aussi Lavrukhina et Pozdnyakov 1970, p. 243–253.
- ↑ « multiple radioactivity handling steps »[132].
- ↑ « [Astatine is] miserable to make and hell to work with »[145].
- ↑ « in clinical settings where tumor burden is low and/or malignant cell populations are located in close proximity to essential normal tissue structures »[132].
- ↑ En d'autres termes, là où l'orbitale atomique s d'un carbone et trois orbitales p s'hybrident pour donner quatre orbitales, dont la forme est intermédiaire entre l'orbitale s originelle et les orbitales p.
- ↑
« Unfortunately, the conundrum confronting the 211At field is that commercial supply of 211At awaits the demonstration of clinical efficacy; however, the demonstration of clinical efficacy requires a reliable supply of 211At[132]. »
« Malheureusement, le dilemme auquel est confronté le domaine d'étude de l'astate 211 est que le développement commercial de la production d'astate 211 attend qu'il soit fait la preuve de son efficacité clinique ; cependant, cette démonstration d'efficacité nécessite l'existence d'une source fiable d'astate 211. »
Références
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j).
- ↑ (en) Andreas Hermann, Roald Hoffmann et Neil W. Ashcroft, « Condensed Astatine: Monatomic and Metallic », Physical Review Letters, vol. 111, no 11, , article no 116404 (PMID 24074111, DOI 10.1103/PhysRevLett.111.116404, Bibcode 2013PhRvL.111k6404H, lire en ligne)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0).
- ↑ (en) K. Otozai et N. Takashi, « Estimation of the Chemical Form and the Boiling point of Elementary Astatine by Radiogaschromatography », Radiochimica Acta, vol. 31, nos 3-4, , p. 201-204 (DOI 10.1524/ract.1982.31.34.201, lire en ligne)
- ↑ (en) Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009.
- 1 2 3 4 5 6 7 8 9 10 (en) « The Nubase evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, no 1, , p. 3–128 (ISSN 0375-9474, DOI 10.1016/j.nuclphysa.2003.11.001, lire en ligne, consulté le ).
- ↑ Greenwood et Earnshaw 2002, p. 795.
- 1 2 3 4 5 6 (en) Nils Wiberg (trad. de l'allemand par M. Eagleson et W. D. Brewer), Holleman-Wiberg : Inorganic Chemistry, B. J. Aylett, , 1884 p. (ISBN 978-0-12-352651-9, lire en ligne), p. 423.
- 1 2 (en) Emsley, J., Nature's Building Blocks : An A-Z Guide to the Elements, Oxford University Press, , 699 p. (ISBN 978-0-19-960563-7, lire en ligne), pp. 57–58.
- 1 2 3 (en) Andreas Hermann, Roald Hoffmann et N. W. Ashcroft, « Condensed Astatine: Monatomic and Metallic », Physical Review Letters, vol. 111, no 11, , p. 116404 (DOI 10.1103/PhysRevLett.111.116404, lire en ligne, consulté le ).
- ↑ (en) Kotz, J. C., Treichel, P. M. et Townsend, J., Chemistry & Chemical Reactivity, Cengage Learning, , 8e éd., 1296 p. (ISBN 978-0-8400-4828-8), p. 65.
- ↑ (en) Thomas P. Jahn et Gerd P. Bienert, MIPs and Their Roles in the Exchange of Metalloids, New York, N.Y./Austin, Tex., Springer, , 145 p. (ISBN 978-1-4419-6315-4, lire en ligne), p. 41.
- ↑ (en) Sławomir Siekierski et John Burgess, Concise Chemistry of the Elements, Horwood Pub., , 198 p. (ISBN 978-1-898563-71-6, lire en ligne), pp. 65, 122.
- ↑ (en) Maddock, A. G., "Astatine". Supplement to Mellor's Comprehensive Treatise on Inorganic and Theoretical Chemistry, Supplement II, Part 1, (F, Cl, Br, I, At)., Longmans, Green & Co. (Ltd.), , pp. 1064–1079.
- ↑ (en) Garrett, A. B., Richardson, J. B. et Kiefer, A. S., Chemistry : A First Course in Modern Chemistry, Ginn, (lire en ligne), p. 313.
- ↑ (en) Glenn T. Seaborg, Transuranium element (Encyclopedia Britannica) (lire en ligne).
- ↑ (en) Hock Leong Oon, Chemistry Expression : An Inquiry Approach : O Level, Special, Express, Panpac Education Pte Ltd, , 446 p. (ISBN 978-981-271-162-5, lire en ligne).
- ↑ (en) Per Freiesleben Hansen (trad. du danois), The Science of Construction Materials, Heidelberg/New York, Springer Science & Business Media, (ISBN 978-3-540-70898-8, lire en ligne).
- 1 2 (en) K. Otozai et N. Takahashi, « Estimation of the Chemical Form and the Boiling Point of Elementary Astatine by Radiogas-chromatography », Radiochimica Acta, vol. 31, nos 3–4, , p. 201–203 (DOI 10.1524/ract.1982.31.34.201, lire en ligne).
- ↑ Lavrukhina et Pozdnyakov 1970, p. 251.
- ↑ (en) Ralph McLaughlin, « Absorption Spectrum of Astatine* », JOSA, vol. 54, no 8, , p. 965–967 (DOI 10.1364/josa.54.000965, lire en ligne, consulté le ).
- ↑ Lavrukhina et Pozdnyakov 1970, p. 235.
- ↑ J. Donohue, The Structures of the Elements, Robert E. Krieger, (ISBN 978-0-89874-230-5, lire en ligne), p. 400.
- 1 2 (en) R. Vernon, « Which Elements are Metalloids? », Journal of Chemical Education, vol. 90, no 12, , p. 1703–1707 (1704) (DOI 10.1021/ed3008457, Bibcode 2013JChEd..90.1703V).
- ↑ J. Merinis, G. Legoux et G. Bouissières, « Etude de la formation en phase gazeuse de composés interhalogénés d'astate par thermochromatographie », Radiochemical and Radioanalytical Letters, vol. 11, no 1, , p. 59–64.
- ↑ (en) N. Takahashi et K. Otozai, « The Mechanism of the Reaction of Elementary Astatine with Organic Solvents », Journal of Radioanalytical and Nuclear Chemistry, vol. 103, , p. 1–9 (DOI 10.1007/BF02165358).
- ↑ (en) N. Takahashi, D. Yano et H. Baba « Chemical Behavior of Astatine Molecules » ()
— « (ibid.) », dans Proceedings of the International Conference on Evolution in Beam Applications, Takasaki, Japan, November 5–8, 1991, p. 536–539. - ↑ Zuckerman et Hagen 1989, p. 21.
- ↑ Kugler et Keller 1985, p. 110, 116, 210–211, 224.
- ↑ (en) R. A. Meyers, « Halogen Chemistry », dans Encyclopedia of Physical Science and Technology, Academic Press, , 3e éd., 197–222 (202) (ISBN 978-0-12-227410-7).
- ↑ C. Keller, W. Wolf et J. Shani, Ullmann's Encyclopedia of Industrial Chemistry, vol. 31, , 89–117 (96) (ISBN 978-3-527-30673-2 et 3-527-30673-0, DOI 10.1002/14356007.o22_o15), « Radionuclides, 2. Radioactive Elements and Artificial Radionuclides ».
- ↑ S. S. Zumdahl et S. A. Zumdahl, Chemistry, Cengage Learning, , 8e éd., 1184 p. (ISBN 978-0-547-12532-9 et 0-547-12532-1, lire en ligne), p. 56.
- 1 2 C. E. Housecroft et A. G. Sharpe, Inorganic chemistry : solutions manual, Pearson Education, , 3e éd., 368 p. (ISBN 978-0-13-175553-6, lire en ligne), p. 533.
- ↑ Kugler et Keller 1985, p. 116.
- ↑ (en) L. Visscher et K. G. Dyall, « Relativistic and Correlation Effects on Molecular properties. I. The Dihalogens F2, Cl2, Br2, I2, and At2 », The Journal of Chemical Physics, vol. 104, no 22, , p. 9040–9046 (DOI 10.1063/1.471636, Bibcode 1996JChPh.104.9040V, lire en ligne).
- ↑ (ru) V. P. Glushko, V. A. Medvedev et G. A. Bergma, Termicheskie Konstanty Veshchestv, vol. 1, Nakua, , p. 65.
- ↑ (en) C. N. R. Rao et P. Ganguly, « A New Criterion for the Metallicity of Elements », Solid State Communications, vol. 57, no 1, , p. 5–6 (DOI 10.1016/0038-1098(86)90659-9, Bibcode 1986SSCom..57....5R).
- ↑ G. W. C. Kaye et T. H. Laby, Tables of Physical and Chemical Constants, Longman, , 14e éd. (ISBN 0-582-46326-2).
- ↑ (en) G. R. Johnson « Dielectric properties of Polytetrafluorethylene » () (lire en ligne, consulté le )
—Conference on Electrical Insulation and Dielectric Phenomenon
— « (ibid.) », dans 1966 Annual Report, National Academy of Sciences—National Research Council, p. 78–83 (81). - ↑ (en) P. P. Edwards et M. J. Sienko, « On the Occurrence of Metallic Character in the Periodic Table of the Elements », Journal of Chemical Education, vol. 60, no 9, , p. 691–696 (DOI 10.1021/ed060p691, Bibcode 1983JChEd..60..691E).
- ↑ A. Smith et W. F. Ehret, College chemistry, Appleton-Century-Crofts, , p. 457.
- 1 2 (en) J. Champion, M. Seydou, A. Sabatié-Gogova, E. Renault, G. Montavon et N. Galland, « Assessment of an Effective Quasirelativistic Methodology Designed to Study Astatine Chemistry in Aqueous Solution », Physical Chemistry Chemical Physics, vol. 13, no 33, , p. 14984–14992 (14984) (DOI 10.1039/C1CP20512A, Bibcode 2011PCCP...1314984C).
- ↑ (en) M. Milanov, V. Doberenz, V. A. Khalkin et A. Marinov, « Chemical Properties of Positive Singly Charged Astatine Ion in Aqueous Solution », Journal of Radioanalytical and Nuclear Chemistry, vol. 83, no 2, , p. 291–299 (DOI 10.1007/BF02037143).
- 1 2 Lavrukhina et Pozdnyakov 1970, p. 234.
- ↑ (en) J. Champion, C. Alliot, E. Renault, B. M. Mokili, M. Chérel, N. Galland et G. Montavon, « Astatine Standard Redox Potentials and Speciation in Acidic Medium », The Journal of Physical Chemistry A, vol. 114, no 1, , p. 576–582 (581) (DOI 10.1021/jp9077008, Bibcode 2010JPCA..114..576C, lire en ligne).
- ↑ (en) S. Milesz, M. Jovchev, D. Schumann et V. A. Khalkin, « The EDTA Complexes of Astatine », Journal of Radioanalytical and Nuclear Chemistry, vol. 127, no 3, , p. 193–198 (DOI 10.1007/BF02164864).
- 1 2 (en) F. Guérard, J.-F. Gestin et M. W. Brechbiel, « Production of [211At]-Astatinated Radiopharmaceuticals and Applications in Targeted α-Particle Therapy », Cancer Biotherapy and Radiopharmaceuticals, vol. 28, , p. 1–20 (PMID 23075373, PMCID 3545490, DOI 10.1089/cbr.2012.1292).
- ↑ (en) Ning Guo, Rémi Maurice, David Teze, Jérôme Graton, Julie Champion, Gilles Montavon et Nicolas Galland, « Experimental and computational evidence of halogen bonds involving astatine », Nature Chemistry, vol. 10, no 4, , p. 428–434 (ISSN 1755-4330 et 1755-4349, DOI 10.1038/s41557-018-0011-1, lire en ligne, consulté le ).
- ↑ (en) M. Dolg, W. Kuchle, H. Stoll, H. Preuss et P. Schwerdtfeger, « Ab Initio Pseudopotentials for Hg to Rn: II. Molecular Calculations on the Hydrides of Hg to At and the Fluorides of Rn », Molecular Physics, vol. 74, no 6, , p. 1265–1285 (1265, 1270, 1282) (DOI 10.1080/00268979100102951, Bibcode 1991MolPh..74.1265D).
- ↑ (en) T. Saue, K. Faegri et O. Gropen, « Relativistic Effects on the Bonding of Heavy and Superheavy Hydrogen Halides », Chemical Physics Letters, vol. 263, nos 3–4, , p. 360–366 (361–362) (DOI 10.1016/S0009-2614(96)01250-X, Bibcode 1996CPL...263..360S).
- ↑ M. Barysz, Relativistic Methods for Chemists, Springer, (ISBN 978-1-4020-9974-8, lire en ligne), p. 79.
- ↑ (en) J. S. Thayer, « Relativistic Effects and the Chemistry of the Heaviest Main-group elements », Journal of Chemical Education, vol. 82, no 11, , p. 1721–1727 (1725) (DOI 10.1021/ed082p1721, Bibcode 2005JChEd..82.1721T).
- ↑ G. Wulfsberg, Inorganic Chemistry, University Science Books, (ISBN 1-891389-01-7), p. 37.
- ↑ D. W. Smith, Inorganic Substances : A Prelude to the Study of Descriptive Inorganic Chemistry, Cambridge University Press, (ISBN 0-521-33738-0, lire en ligne), p. 135.
- ↑ (en) David Leimbach, Julia Karls, Yangyang Guo et Rizwan Ahmed, « The electron affinity of astatine », Nature Communications, vol. 11, no 1, , p. 3824 (ISSN 2041-1723, DOI 10.1038/s41467-020-17599-2, lire en ligne, consulté le )
- ↑ (en) E. Anders, « Technetium and astatine chemistry », Annual Review of Nuclear Science, vol. 9, , p. 203–220 (DOI 10.1146/annurev.ns.09.120159.001223, Bibcode 1959ARNPS...9..203A)
 .
. - 1 2 3 4 (en) V. D. Nefedov, Yu. V. Norseev, M. A. Toropova et Vladimir A. Khalkin, « Astatine », Russian Chemical Reviews, vol. 37, no 2, , p. 87–98 (DOI 10.1070/RC1968v037n02ABEH001603, Bibcode 1968RuCRv..37...87N)
 .
. - ↑ (en) A. H. W., Jr. Aten, T. Doorgeest, U. Hollstein et H. P. Moeken, « Section 5: Radiochemical Methods. Analytical Chemistry of Astatine », Analyst, vol. 77, no 920, , p. 774–777 (DOI 10.1039/AN9527700774, Bibcode 1952Ana....77..774A)
 .
. - 1 2 3 4 5 6 Zuckerman et Hagen 1989, p. 31.
- 1 2 Zuckerman et Hagen 1989, p. 38.
- ↑ Kugler et Keller 1985, p. 213–214.
- ↑ Kugler et Keller 1985, p. 214–218.
- ↑ Kugler et Keller 1985, p. 211.
- ↑ Kugler et Keller 1985, p. 109–110, 129, 213.
- ↑ M. Davidson, Contemporary boron chemistry, Royal Society of Chemistry, , 538 p. (ISBN 978-0-85404-835-9, lire en ligne), p. 146.
- 1 2 Zuckerman et Hagen 1989, p. 276.
- ↑ (en) J. Elgqvist, R. Hultborn, S. Lindegren, S. Palm et S. Speer (dir.), Targeted Radionuclide Therapy, Philadelphie, Lippincott Williams & Wilkins, , 380–396 (383) (ISBN 978-0-7817-9693-4, lire en ligne), « Ovarian cancer: background and clinical perspectives ».
- 1 2 3 Zuckerman et Hagen 1989, p. 190–191.
- ↑ Kugler et Keller 1985, p. 111.
- ↑ (en) Dumitru-Claudiu Sergentu, David Teze, Andréa Sabatié-Gogova, Cyrille Alliot, Ning Guo, Fadel Bassel, Isidro Da Silva, David Deniaud, Rémi Maurice, Julie Champion, Nicolas Galland et Gilles Montavon, « Advances on the Determination of the Astatine Pourbaix Diagram: Predomination of AtO(OH)2− over At− in Basic Conditions », Chem. Eur. J., vol. 2016, no 22, , p. 2964–71 (DOI 10.1002/chem.201504403).
- ↑ Kugler et Keller 1985, p. 222.
- ↑ Lavrukhina et Pozdnyakov 1970, p. 238.
- 1 2 Kugler et Keller 1985, p. 112, 192–193.
- ↑ Kugler et Keller 1985, p. 219.
- ↑ Zuckerman et Hagen 1989, p. 192–193.
- ↑ Zuckerman et Hagen 1990, p. 212.
- ↑ (en) G. A. Brinkman et H. W. Aten, « Decomposition of Caesium Diiodo Astatate (I), (CsAtI2) », Radiochimica Acta, vol. 2, no 1, , p. 48 (DOI 10.1524/ract.1963.2.1.48, lire en ligne).
- ↑ Zuckerman et Hagen 1990, p. 60.
- ↑ Zuckerman et Hagen 1989, p. 426.
- ↑ (en) E. H. Appelman, E. N. Sloth et M. H. Studier, « Observation of Astatine Compounds by Time-of-Flight Mass Spectrometry », Inorganic Chemistry, vol. 5, no 5, , p. 766–769 (DOI 10.1021/ic50039a016).
- ↑ (en) K. S. Pitzer, « Fluorides of Radon and Element 118 », Journal of the Chemical Society, Chemical Communications, vol. 5, no 18, , p. 760b–761 (DOI 10.1039/C3975000760B).
- ↑ (en) N. Bartlett et F. O. Sladky, « The Chemistry of Krypton, Xenon and Radon », dans J. C. Bailar, H. J. Emeléus, R. Nyholm et al., Comprehensive Inorganic Chemistry, vol. 1, Pergamon, , 213–330 p. (ISBN 0-08-017275-X).
- ↑ (en) P. Ball, The Ingredients : A Guided Tour of the Elements, Oxford University Press, , 100–102 p. (ISBN 978-0-19-284100-1).
- ↑ Lavrukhina et Pozdnyakov 1970, p. 228.
- ↑ (en) Marco Fontani, Mariagrazia Costa et Mary Virginia Orna, The Lost Elements : The Periodic Table's Shadow Side, New York, Oxford University Press, (1re éd. 2014), 531 p. (ISBN 9780199383344), p. 329-330.
- ↑ (en) F. Allison, E. J Murphy, E. R. Bishop et A. L. Sommer, « Evidence of the Detection of Element 85 in Certain Substances », Physical Review, vol. 37, no 9, , p. 1178–1180 (DOI 10.1103/PhysRev.37.1178, Bibcode 1931PhRv...37.1178A)
 .
. - ↑ (en) « Alabamine & Virginium », Time Magazine, (lire en ligne).
- ↑ (en) R. F. Trimble, « What Happened to Alabamine, Virginium, and Illinium? », Journal of Chemical Education, vol. 52, no 9, , p. 585 (DOI 10.1021/ed052p585, Bibcode 1975JChEd..52..585T)
 .
. - ↑ (en) H. G. MacPherson, « An Investigation of the Magneto-optic Method of Chemical Analysis », Physical Review, vol. 47, no 4, , p. 310–315 (DOI 10.1103/PhysRev.47.310, Bibcode 1935PhRv...47..310M).
- 1 2 3 4 [PDF] (en) S. C. Burdette et B. F. Thornton, « Finding Eka-Iodine: Discovery Priority in Modern Times », Bulletin for the History of Chemistry, vol. 35, , p. 86–96 (lire en ligne).
- ↑ (en) « Isotope data for thorium-232 in the Periodic Table », sur www.periodictable.com (consulté le ).
- ↑ (en) J. W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Longmans, Green, (OCLC 13842122, lire en ligne), p. 1066.
- ↑ (en) Marco Fontani, Mariagrazia Costa et Mary Virginia Orna, The Lost Elements : The Periodic Table's Shadow Side, New York, Oxford University Press, (1re éd. 2014), 531 p. (ISBN 9780199383344), p. 338-339.
- ↑ Scerri 2013, p. 168.
- ↑ Scerri 2013, p. 170.
- ↑ (en) « Isotope data for polonium-218 in the Periodic Table », sur www.periodictable.com (consulté le ).
- ↑ (de) B. Karlik et T. Bernert, « Über Eine Vermutete β-Strahlung des Radium A und die Natürliche Existenz des Elementes 85 » [« About a Suspected β-radiation of Radium A, and the Natural Existence of the Element 85 »], Naturwissenschaften, vol. 30, nos 44–45, , p. 685–686 (DOI 10.1007/BF01487965, Bibcode 1942NW.....30..685K)
 .
. - ↑ (en) A. Leigh-Smith et W. Minder, « Experimental Evidence of the Existence of Element 85 in the Thorium Family », Nature, vol. 150, no 3817, , p. 767–768 (DOI 10.1038/150767a0, Bibcode 1942Natur.150..767L)
 .
. - ↑ (en) Marco Fontani, Mariagrazia Costa et Mary Virginia Orna, The Lost Elements : The Periodic Table's Shadow Side, New York, Oxford University Press, (1re éd. 2014), 531 p. (ISBN 9780199383344), p. 342-343.
- ↑ (en) D. R. Corson, K. R. MacKenzie et E. Segrè, « Artificially Radioactive Element 85 », Physical Review, vol. 58, no 8, , p. 672–678 (DOI 10.1103/PhysRev.58.672, Bibcode 1940PhRv...58..672C)
 .
. - ↑ « Astate », Encyclopædia Universalis (consulté le ).
- 1 2 Helen Miles Davis, The Chemical Elements, Science Service, Ballantine Books, , 2e éd., 29 p. (lire en ligne).
- ↑ (de) B. Karlik et T. Bernert, « Eine Neue Natürliche α-Strahlung » [« Un nouveau rayonnement α naturel »], Naturwissenschaften, vol. 31, nos 25–26, , p. 298–299 (DOI 10.1007/BF01475613, Bibcode 1943NW.....31..298K)
 .
. - ↑ (de) B. Karlik et T. Bernert, « Das Element 85 in den Natürlichen Zerfallsreihen » [« L'élément 85 dans la série de désintégration naturelle »], Zeitschrift für Physik, vol. 123, nos 1–2, , p. 51–72 (DOI 10.1007/BF01375144, Bibcode 1944ZPhy..123...51K)
 .
. - ↑ C. M. Lederer, J. M. Hollander et I. Perlman, Table of Isotopes, John Wiley & Sons, , 6e éd., p. 1–657.
- ↑ (en) « Isotope data for neptunium-237 in the Periodic Table », sur www.periodictable.com (consulté le ).
- 1 2 (en) D. R. Corson, « Astatine », Chemical & Engineering News, vol. 81, no 36, (lire en ligne).
- 1 2 3 (en) C. Fry et M. Thoennessen, « Discovery of the astatine, radon, francium, and radium isotopes », Atomic Data and Nuclear Data Tables, vol. 09, , p. 497–519 (DOI 10.1016/j.adt.2012.05.003, Bibcode 2013ADNDT..99..497F, arXiv 1205.5841).
- ↑ (en) « Names of New Elements Confirmed by International Union of Chemistry », Chemical & Engineering News, vol. 27, no 42, , p. 2996–3091 (ISSN 0009-2347, DOI 10.1021/cen-v027n042.p2996, lire en ligne, consulté le ).
- ↑ Corson, MacKenzie et Segrè 1940, p. 672, 677.
- ↑ (en) J. G. Hamilton et M. H. Soley, « A Comparison of the Metabolism of Iodine and of Element 85 (Eka-Iodine) », Proceedings of the National Academy of Sciences, vol. 26, no 8, , p. 483–489 (PMID 16588388, PMCID 1078214, DOI 10.1073/pnas.26.8.483, Bibcode 1940PNAS...26..483H, lire en ligne).
- ↑ (en) H. M. Neumann, « Solvent Distribution Studies of the Chemistry of Astatine », Journal of Inorganic and Nuclear Chemistry, vol. 4, nos 5–6, , p. 349–353 (DOI 10.1016/0022-1902(57)80018-9).
- ↑ (en) G. L. Johnson, R. F. Leininger et E. Segrè, « Chemical Properties of Astatine. I », Journal of Chemical Physics, vol. 17, no 1, , p. 1–10 (DOI 10.1063/1.1747034, Bibcode 1949JChPh..17....1J).
- ↑ (de) I. Dreyer, R. Dreyer et V. A. Chalkin, « Cations of Astatine in Aqueous Solutions; Production and some Characteristics », Radiochemical and Radioanalytical Letters, vol. 36, no 6, , p. 389–398.
- 1 2 (en) A. H. W., Jr. Aten, « The Chemistry of Astatine », Advances in Inorganic Chemistry and Radiochemistry, vol. 6, , p. 207–223 (DOI 10.1016/S0065-2792(08)60227-7).
- ↑ (en) V. D. Nefedov, Yu. V. Norseev, M. A. Toropova et V. A. Khalkin, « Astatine », Russian Chemical Reviews, vol. 37, no 2, , p. 87–98 (DOI 10.1070/RC1968v037n02ABEH001603, Bibcode 1968RuCRv..37...87N).
- ↑ (en) C. Fry et M. Thoennessen, « Discovery of the astatine, radon, francium, and radium isotopes », Atomic Data and Nuclear Data Tables, vol. 99, no 5, , p. 497–519 (DOI 10.1016/j.adt.2012.05.003, lire en ligne, consulté le )
- ↑ (en) Henna Kokkonen, Université de Jyväskylä, « Decay properties of the new isotopes 188At and 190At » [PDF]
- 1 2 3 4 Lavrukhina et Pozdnyakov 1970, p. 229.
- ↑ K. Rankama, Isotope Geology, Pergamon Press, , 2e éd. (ISBN 978-0-470-70800-2), p. 403.
- ↑ (en) Geerd-J Meyer, « Astatine », Journal of Labelled Compounds and Radiopharmaceuticals, vol. 61, no 3, , p. 154–164 (ISSN 0362-4803, DOI 10.1002/jlcr.3573, lire en ligne, consulté le ).
- ↑ D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, CRC Press, , 85e éd. (ISBN 0-8493-0485-7), p. 14-10.
- ↑ (en) D. Scott Wilbur, « Enigmatic astatine », Nature Chemistry, vol. 5, no 3, , p. 246 (DOI 10.1038/nchem.1580, lire en ligne, consulté le ).
- ↑ Lavrukhina et Pozdnyakov 1970, p. 228–229.
- ↑ I. Asimov, Only a Trillion, Abelard-Schuman, (lire en ligne), p. 24.
- ↑ (en) « Part II: Analytical Chemistry of the Elements », dans I. M. Kolthoff et P. J. Elving, Treatise on Analytical Chemistry, vol. 4, New York, Interscience Encyclopedia, , p. 487.
- ↑ Kugler et Keller 1985, p. 4.
- ↑ (en) M. Maiti et S. Lahiri, « Production cross section of At radionuclides from 7Li+natPb and 9Be+natTl reactions », Physical Review C, vol. 84, no 6, , p. 07601–07604 (07601) (DOI 10.1103/PhysRevC.84.067601, Bibcode 2011PhRvC..84f7601M, arXiv 1109.6413).
- ↑ Greenwood et Earnshaw 2002, p. 796.
- ↑ Kugler et Keller 1985, p. 5.
- ↑ (en) G. W. Barton, A. Ghiorso et I. Perlman, « Radioactivity of Astatine Isotopes », Physical Review, vol. 82, no 1, , p. 13–19 (DOI 10.1103/PhysRev.82.13, Bibcode 1951PhRv...82...13B)
 .
. - 1 2 3 4 5 6 7 8 9 Zalutsky et Pruszynski 2011.
- 1 2 (en) R. H. Larsen, B. W. Wieland et M. R. J. Zalutsky, « Evaluation of an Internal Cyclotron Target for the Production of 211At via the 209Bi (α,2n)211At reaction », Applied Radiation and Isotopes, vol. 47, no 2, , p. 135–143 (DOI 10.1016/0969-8043(95)00285-5).
- ↑ (en) K. Nagatsu, K. H. Minegishi, M. Fukada, H. Suzuki, S. Hasegawa et M. Zhang, « Production of 211At by a vertical beam irradiation method », Applied Radiation and Isotopes, vol. 94, , p. 363–371 (DOI 10.1016/j.apradiso.2014.09.012).
- ↑ (en) J. Barbet, M. Bourgeois et J. Chatal, Therapeutic Nuclear Medicine, Springer, , 95–104 (99) (ISBN 978-3-540-36718-5), « Cyclotron-Based Radiopharmaceuticals for Nuclear Medicine Therapy ».
- 1 2 3 (en) D. S. Wilbur, « Overcoming the Obstacles to Clinical Evaluation of 211At-Labeled Radiopharmaceuticals », The Journal of Nuclear Medicine, vol. 42, no 10, , p. 1516–1518 (PMID 11585866, lire en ligne).
- 1 2 3 4 Lavrukhina et Pozdnyakov 1970, p. 233.
- ↑ (en) R. Gopalan, Inorganic Chemistry for Undergraduates, Universities Press, , 953 p. (ISBN 978-81-7371-660-7, lire en ligne), p. 547.
- ↑ (en) T. Stigbrand, J. Carlsson et G. P. Adams, Targeted Radionuclide Tumor Therapy : Biological Aspects, Springer, (ISBN 978-1-4020-8695-3, lire en ligne), p. 150.
- ↑ (en) G. Gyehong, K. Chun, S. H. Park et B. Kim, « Production of α-particle emitting 211At using 45 MeV α-beam », Physics in Medicine and Biology, vol. 59, no 11, , p. 2849–2860 (DOI 10.1088/0031-9155/59/11/2849, Bibcode 2014PMB....59.2849K).
- ↑ Kugler et Keller 1985, p. 95–106, 133–139.
- ↑ Kugler et Keller 1985, p. 97.
- ↑ (en) S. Lindegren, T. Bäck et H. J. Jensen, « Dry-distillation of Astatine-211 from Irradiated Bismuth Targets: A Time-saving Procedure with High Recovery Yields », Applied Radiation and Isotopes, vol. 55, no 2, , p. 157–160 (DOI 10.1016/S0969-8043(01)00044-6).
- ↑ (en) A. T. Yordanov, O. Pozzi, S. Carlin, G. J. Akabani, B. Wieland et M. R. Zalutsky, « Wet Harvesting of No-carrier-added 211At from an Irradiated 209Bi Target for Radiopharmaceutical Applications », Journal of Radioanalytical and Nuclear Chemistry, vol. 262, no 3, , p. 593–599 (DOI 10.1007/s10967-005-0481-7).
- 1 2 (en) D. Fisher « Oral History of Dr. Patricia Wallace Durbin, Ph.D. » () (lire en ligne, consulté le )
— « (ibid.) », dans Human Radiation Studies: Remembering the Early Years, United States Department of Energy, Office of Human Radiation Experiments - 1 2 3 Vértes, Nagy et Klencsár 2003, p. 337.
- ↑ (en) Michael Zalutsky et Ganesan Vaidyanathan, « Astatine-211-Labeled Radiotherapeutics An Emerging Approach to Targeted Alpha-Particle Radiotherapy », Current Pharmaceutical Design, vol. 6, no 14, , p. 1433–1455 (DOI 10.2174/1381612003399275).
- ↑ (en) D. Scott Wilbur, « Enigmatic astatine », Nature Chemistry, vol. 5, no 3, , p. 246 (PMID 23422568, DOI 10.1038/nchem.1580, Bibcode 2013NatCh...5..246W, lire en ligne, consulté le ).
- ↑ Vértes, Nagy et Klencsár 2003, p. 338.
- ↑ (en) G. Vaidyanathan et M. R. Zalutsky, « Astatine Radiopharmaceuticals: Prospects and Problems », Current Radiopharmaceuticals, vol. 1, no 3, , p. 177–196 (PMID 20150978, PMCID 2818997, DOI 10.2174/1874471010801030177).
- ↑ Lavrukhina et Pozdnyakov 1970, p. 232–233.
- ↑ (en) T. T., Jr. Odell, A. C. Upton, H. Schwiegk (dir.) et F. Turba (dir.), Radioactive Isotopes in Physiology Diagnostics and Therapy [« Isotopes radioactifs dans le diagnostic et la thérapie de physiologie »], Springer-Verlag, (1re éd. Softcover reprint of the hardcover 1st edition 1961), 375–392 (385) (ISBN 978-3-642-49477-2), « Late Effects of Internally Deposited Radioisotopes ».
- ↑ (en) Cornelius Keller, Walter Wolf et Jashovam Shani, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.o22_o15), « Radionuclides, 2. Radioactive Elements and Artificial Radionuclides ».
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) D. R. Corson, K. R. MacKenzie et E. Segrè, « Artificially Radioactive Element 85 », Physical Review, vol. 58, no 8, , p. 672–678 (DOI 10.1103/PhysRev.58.672, Bibcode 1940PhRv...58..672C).

- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, Oxford/Auckland/Boston etc., Butterworth-Heinemann, , 2e éd., 1341 p. (ISBN 0-7506-3365-4).

- (en) H. K. Kugler et C. Keller, 'At, Astatine', System No. 8a, vol. 8, Springer-Verlag, coll. « Gmelin Handbook of Inorganic and Organometallic Chemistry », , 8e éd. (ISBN 3-540-93516-9).

- (en) A. K. Lavrukhina et A. A. Pozdnyakov (Translated by R. Kondor), Analytical Chemistry of Technetium, Promethium, Astatine, and Francium, Ann Arbor–Humphrey Science Publishers, (ISBN 0-250-39923-7).

- (en) Eric Scerri, A Tale of Seven Elements, Oxford University Press, , 304 p. (ISBN 978-0-19-991074-8, lire en ligne).

- (en) A. Vértes, S. Nagy et Z. Klencsár, Handbook of Nuclear Chemistry, vol. 4, Springer, , 398 p. (ISBN 978-1-4020-1316-4, lire en ligne).

- (en) M. R. Zalutsky et M. Pruszynski, « Astatine-211: Production and Availability », Current Radiopharmaceuticals, vol. 4, no 3, , p. 177–185 (PMID 22201707, PMCID 3503149, DOI 10.2174/1874471011104030177).

- (en) J. J. Zuckerman et A. P. Hagen, Inorganic Reactions and Methods, Volume 3, The Formation of Bonds to Halogens (Part 1), John Wiley & Sons, , 710 p. (ISBN 978-0-471-18656-4).

- (en) J. J. Zuckerman et A. P. Hagen, Inorganic Reactions and Methods, Volume 4, The Formation of Bonds to Halogens (Part 2), John Wiley & Sons, , 491 p. (ISBN 978-0-471-18657-1).

Liens externes
- (en) « Technical data for Astatine » (consulté le ), qui en sous-pages donne les données connues pour chaque isotope.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |