| Cérium | |||||||||||
 Cérium sous argon. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ce | ||||||||||
| Nom | Cérium | ||||||||||
| Numéro atomique | 58 | ||||||||||
| Groupe | – | ||||||||||
| Période | 6e période | ||||||||||
| Bloc | Bloc f | ||||||||||
| Famille d'éléments | Lanthanide | ||||||||||
| Configuration électronique | [Xe] 4f1 5d1 6s2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 19, 9, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 140,116 ± 0,001 u[1] | ||||||||||
| Rayon atomique (calc) | 185 pm | ||||||||||
| Rayon de covalence | 204 ± 9 pm[2] | ||||||||||
| État d’oxydation | 3,4 | ||||||||||
| Électronégativité (Pauling) | 1,12 | ||||||||||
| Oxyde | Base | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 5,538 7 eV | 2e : 10,85 eV | ||||||||||
| 3e : 20,198 eV | 4e : 36,758 eV | ||||||||||
| 5e : 65,55 eV | 6e : 77,6 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide | ||||||||||
| Masse volumique | 6,770 g·cm-3 (25 °C)[1] | ||||||||||
| Système cristallin | Hexagonal compact | ||||||||||
| Dureté (Mohs) | 2,5 | ||||||||||
| Couleur | blanc argenté | ||||||||||
| Point de fusion | 799 °C[1] | ||||||||||
| Point d’ébullition | 3 443 °C[1] | ||||||||||
| Énergie de fusion | 5,46 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 414 kJ·mol-1 | ||||||||||
| Volume molaire | 2,069×10-4 m3·mol-1 | ||||||||||
| Vitesse du son | 2 100 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 190 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 1,15×106 S·m-1 | ||||||||||
| Conductivité thermique | 11,4 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [4] | ||||||||||
| No ECHA | 100.028.322 | ||||||||||
| Précautions | |||||||||||
| SGH[5] | |||||||||||
  Danger |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le cérium est un élément chimique, de symbole Ce et de numéro atomique 58. Il fait partie de la famille des lanthanides.
Historique
| Découvertes des terres rares. | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Diagrammes des découvertes des terres rares. Les dates entre parenthèses sont les dates d'annonces des découvertes[6]. Les branches représentent les séparations des éléments à partir d'un ancien (l'un des nouveaux éléments conservant le nom de l'ancien, sauf pour le didyme). |
Le cérium[alpha 1] a été identifié en 1803 par Martin Heinrich Klaproth et pratiquement en même temps par Jöns Jacob Berzelius et Wilhelm Hisinger. Son nom fait référence à la planète naine « Cérès » découverte en janvier 1801[7]. En 1825, il a été obtenu par Carl Gustav Mosander pour la première fois à l'état raisonnablement pur.
Isotopes
Le cérium naturel est composé de quatre isotopes : 136Ce, 138Ce, 140Ce et 142Ce.
Propriétés

Le cérium est un métal gris , le plus abondant du groupe des terres rares (abondance dans la nature de 48 ppm[8]).
À température ambiante, il est malléable et s'oxyde rapidement à l'air.
Phases du cérium pur
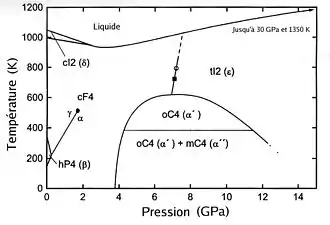
Utilisations
- Pierre à briquet : le cérium entre dans la composition du mischmétal, base des pierres à briquet.
- Polissage du verre : le dioxyde de cérium (CeO2) est l'une des meilleures poudres de polissage du verre.
- Protection contre l'ionisation : les verres dopés à l'oxyde de cérium sont protégés contre l'effet de solarisation du rayonnement ultraviolet et la radioactivité qui provoquent un effet d'ionisation et brise les liaisons pontantes Si-O.
- Pots d'échappement : il est utilisé afin de diminuer les émissions nocives des moteurs Diesel (filtre à particules).
- Fours : il est utilisé (oxyde) dans le revêtement des fours « auto-nettoyants ».
- Manchon à incandescence : l'oxyde de cérium est imprégné dans une gaine de tissu combustible utilisée dans les lampes à pétrole sous pression, sous l'effet de la chaleur celui-ci brille fortement.
- Autres utilisations : utilisé comme colorant du verre, dans les luminophores pour tubes cathodiques et également pour améliorer l'absorption des rayons X par la dalle des mêmes tubes.
Usage médical
Le cérium est utilisé sous forme de nitrate de cérium (en) (quelques pourcents) dans certaines crèmes[alpha 2] ou dans des pansements (associé à la sulfadiazine argentique) pour soigner les brûlures graves[9]. En réaction au cérium, l'organisme produit des calcifications superficielles qui diminuent les possibilités de colonisation bactérienne et préviennent « la formation d’un tissu de granulation (limitation de la cicatrisation hypertrophique) dans les brûlures »[9].
Inoculé dans l'organisme, comme d'autres substances étrangères non dégradables, il peut induire un granulome ou une sarcoïdose, plus ou moins marquée selon le statut immunitaire de l'individu[9].
Toxicité, écotoxicité
Elles sont mal connues (écotoxicité surtout),
- l'IRSN a produit une fiche pédagogique sur le radioisotope[10].
- Dans un cas au moins, une patiente soignée par un pansement contenant de l'argent et du cérium après une brûlure grave a présenté une granulomatose au cérium[9].
- Les nanoparticules de dioxyde de cérium (NP CeO2) figurent dans la liste prioritaire des nanomatériaux manufacturés de l'OCDE devant faire l'objet d'une évaluation écotoxicologique. Des larves de chironome (Chironomus riparius) ont été exposées à des taux de 2,5, 25, 250 et 2500 mg de CeO2 NP/kg de sédiments ; l'absorption du produit (larves vivant dans le sédiment), le stress oxydatif, les effets génotoxiques in vivo et quelques autres paramètres biologiques ont été étudiés : on n'a pas détecté de mortalité significative chez C. riparius ni de signes de stress oxydant mais elle a montré que la larve absorbe ce produit et qu'il est génotoxique (dès avant 25 mg/kg de sédiments, et de manière corrélée à la concentration. Ce moustique n'est pas mis en danger aux doses environnementales attendues, mais « l'accumulation importante de NP de CeO2 par les larves de chironomidés peut présenter un risque par transfert trophique vers des organismes plus en amont de la chaîne alimentaire » concluent les auteurs [11]
Notes et références
Notes
Références
- 1 2 3 4 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ SIGMA-ALDRICH
- ↑ (en) Episodes from the History of the Rare Earth Elements, Springer Netherlands, coll. « Chemists and Chemistry », (ISBN 9789401066143 et 9789400902879, DOI 10.1007/978-94-009-0287-9), xxi.
- 1 2 (en) C. H. Evans, Episodes from the History of the Rare Earth Elements, Springer Netherlands, coll. « Chemists and Chemistry », (ISBN 9789401066143 et 9789400902879, DOI 10.1007/978-94-009-0287-9), « The Discovery Of Cerium - A Fascinating Story », p. 13–36.
- ↑ Concepcion Cascales, Pactrick Maestro, Pierre-Charles Porcher, Regino Saez Puche, « Lanthane et lanthanides : 2.État naturel », sur l’Encyclopædia Universalis (consulté le ))
- 1 2 3 4 T. Boye, J.-P. Terrier, C. Coillot, B. Guennoc, B. Fournier, F. Carsuzaa (2006) Granulomatose cutanée au cérium (chez une femme de 57 ans, gravement brûlée quatre ans auparavant); Annales de Dermatologie et de Vénéréologie, Volume 133, Issue 1, January 2006, Pages 50-52
- ↑ IRSN, Fiche pédagogique sur le 144Ce et l'environnement
- ↑ Dimitrija Savić‐Zdravković & al. (2019) A Multiparametric Approach to Cerium Oxide Nanoparticle Toxicity Assessment in Non‐Biting Midges ; 03 Oct. 2019 | Environ Toxicol Chem 2019; 39: 131-140 https://doi.org/10.1002/etc.4605.
Voir aussi
Liens externes
- (en) « Technical data for Cerium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |